Under hösten sjunger syrsor i allmänhet pipande sånger i det tempererade östasiatiska landet Japan. Även om den afrikanska fältgrillen Gryllus bimaculatus har sitt ursprung i tropiska länder är den ett framväxande modelldjur globalt sett på grund av sin förmåga att återskapa amputerade ben under nymf och sitt utvecklingssätt (kort groddband) (Mito och Noji, 2008).
Många levande organismer i djurriket har förmågan att återskapa sina kroppsdelar efter en skada. Exempel på kroppsdelar som kan återbildas är linsen och svansen hos amfibier, huvudet hos planarier och hjärtat hos fiskar. Däremot har man länge antagit att människor inte kan återskapa förlorade kroppsdelar, med undantag för vissa vävnader, bland annat överhuden, levern och äggstocksytan efter ägglossning. Därför är det viktigt att belysa de molekylära mekanismer som är involverade i regenerationsprocesser med hjälp av djurmodeller som kan regenerera kroppsdelar för att sedan tillämpas på icke-regenerativa mänskliga organ och vävnader.
Under de senaste två åren har jämförande genomiska studier av två planariaarter med olika regenerativa förmågor lett till en framgångsrik regeneration av huvuden genom att minska beta-cateninaktiviteten från annars icke-regenerativa svansfragment (Umesono et al., 2013). Studier av ryggradsdjur med förmåga att återskapa lemmar, inklusive vattensalamander, grodor och salamandrar, har visat att regenerering av lemmar sker stegvis. Lämningsregenereringsprocessen är uppdelad i minst tre faser: sårläkning, dedifferentiering och återuppbyggnad, där återuppbyggnadsfasen efterliknar embryonalutvecklingen (Endo et al., 2004).
Skricklans ben består av sex segment som är ordnade längs den proximo-distala (PD) axeln: coxa, trochanter, femur, tibia, tarsus och klo (figur 1). 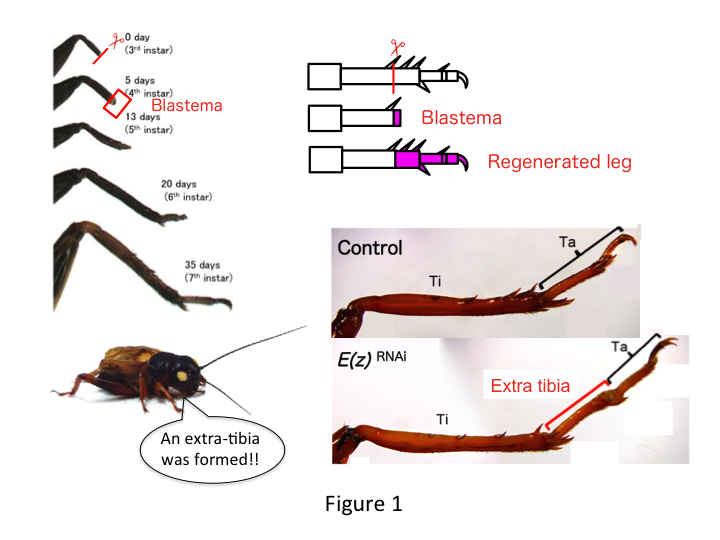 Tarsus är vidare uppdelad i tre tarsomerer. När skenbenet amputeras hos den tredjeinstar-nymfen regenererar benet och återfår sin allometriska storlek och korrekta form vid sjätte instar (dvs. inom 20 dagar efter amputationen), och återfår nästan normal storlek och form som vuxen. Strax efter läkningen utvecklas blastema (en pool av celler som förökar sig) i det distala området av det amputerade benet. Blastema-cellerna förökar sig och bildar de saknade strukturerna genom interkalära processer mellan den mest distala regionen och den återstående delen av benet (French et al., 1976).
Tarsus är vidare uppdelad i tre tarsomerer. När skenbenet amputeras hos den tredjeinstar-nymfen regenererar benet och återfår sin allometriska storlek och korrekta form vid sjätte instar (dvs. inom 20 dagar efter amputationen), och återfår nästan normal storlek och form som vuxen. Strax efter läkningen utvecklas blastema (en pool av celler som förökar sig) i det distala området av det amputerade benet. Blastema-cellerna förökar sig och bildar de saknade strukturerna genom interkalära processer mellan den mest distala regionen och den återstående delen av benet (French et al., 1976).
Tidigare utförde vi en jämförande transkriptomanalys av regenererande och normala amputerade ben hos syrsor för att profilera mRNA-uttrycket som är förknippat med benregenerering (Bando et al., 2013). Vi fokuserade först på uppregleringen av Jak/Stat-vägsgener, som är kopplade till immunsystemet. RNA-interferens (RNAi) av gener i denna väg störde benregenerationen grundligt. Däremot orsakade RNAi mot Socs, en suppressor av cytokinsignalering, benförlängning. Ytterligare experiment visade att Jak/Stat-vägen främjar cellproliferation nedströms Ds/Fat-vägen.
Därefter undersökte vi den epigenetiska regleringen under syrsors benregeneration. Tetsuya Bando, en seniorforskare i vår grupp, identifierade en gen för histon H3 lysin 27 (H3K27) metyltransferas, E(z), och en gen för histon H3K27 demetylas, Utx, i G. bimaculatus. Kloning av gener från Gryllus är numera en okomplicerad process tack vare den information som finns tillgänglig om syrsornas genom (Mito och Noji, personlig kommunikation). Metylering av histon H3K27 av E(z) undertrycker uttrycket av målgener genom att rekrytera Polycomb-gruppens proteiner. Omvänt främjar demetylering av det trimetylerade histonet H3K27 med Utx genuttrycket. Tetsuya fann att transkriptionen av både E(z)- och Utx-gener uppregleras i blastemacellerna från amputerade ben (Bando et al., 2013). In situ-hybridisering verifierade att båda generna är ubiquitärt transkriberade i syrsors regenererande ben, och att båda generna uttrycks i embryon under utveckling (Hamada et al., 2015). Immunfärgning på de amputerade små benen efter RNAi av Yoshimasa Hamada (doktorand) bekräftade att E(z) och Utx bidrar till metylering respektive demetylering vid histon H3K27me3 under benregeneration.
Däremot fann Yoshimasa oväntat att det extra bensegmentet bildas efter RNAi mot E(z) (figur 1). Inledningsvis kunde vi inte fastställa identiteten hos bensegmentet. Morfologiskt verkade bensegmentet vara en tibia, eftersom det hade taggar och sporrar som var karakteristiska för en äkta tibia. Vår inledande hypotes var att fenotyperna efter RNAi kunde bero på amputationsplatsen i tibia. Men även när ett ben amputeras i den distala delen av lårbenet uppstår det extra tibia-liknande segmentet. Mönsterbildningen längs de antero-posteriora och dorso-ventrala axlarna förblev oförändrad, utom längs PD-axeln. Vi undersökte sedan om amputationsplatsen längs PD-axeln i tibia påverkade den fenotypiska svårighetsgraden. Den extratibia som bildades blev längre ju mer proximala amputationsställena på tibia var (figur 1). Omvänt resulterade RNAi mot Utx i förlust av ledbildning mellan tarsomer 1 (Ta1) och Ta2 (figur 2). 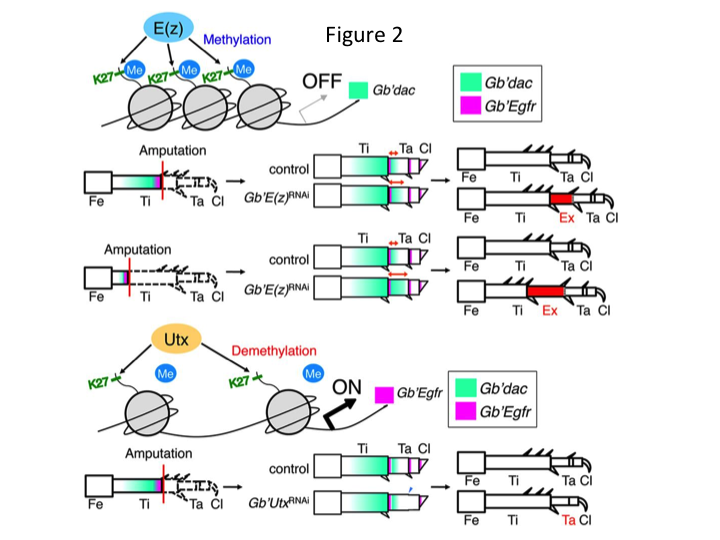 In situ-hybridisering visade att uttrycket av benmönstergener förändrades längs PD-axeln. Specifikt utökades uttrycket av dac-området (dac) i E(z)RNAi-regenererade ben, medan Egfr-uttrycket minskade i UtxRNAi-ben. Därför kan E(z) reprimera dac-uttryck under normal benregeneration, medan Utx inducerar Egfr-uttryck.
In situ-hybridisering visade att uttrycket av benmönstergener förändrades längs PD-axeln. Specifikt utökades uttrycket av dac-området (dac) i E(z)RNAi-regenererade ben, medan Egfr-uttrycket minskade i UtxRNAi-ben. Därför kan E(z) reprimera dac-uttryck under normal benregeneration, medan Utx inducerar Egfr-uttryck.
Dac kodar för en transkriptionell co-repressor som kategoriseras i benspaltsgener. dac producerar grova lägesvärden längs benets PD-axel och medierar bildandet av det distala skenbenet och Ta1 (den proximala tarsomeren) under syrenbensregeneration (dac-uttrycksdomän visas i grönt i figur 2) (Ishimaru et al., 2015). Specifikt främjar dac tibiacellproliferation. Eftersom RNAi mot E(z) uppreglerar dac kan därför E(z)-uttryck i blastemacellerna undertrycka den blastemala överproliferationen genom att undertrycka extra dac-uttryck.
Denna information väcker frågan om hur E(z) specifikt reglerar dac-uttrycket. Vidare, vilken mekanism är det som bestämmer målgenerna för E(z)? E(z) tillhör Polycomb repressive complex 2 (PRC2), som är ett av tre Polycomb group (PcG)-komplex (Schuettengruber et al., 2007). Under gräshoppsembryogenesen undertrycker E(z) den främre expansionen av Hox-genuttrycket och ger embryon rätt identitet (Matsuoka et al., 2015). Denna information tyder på att E(z):s målgener skiljer sig åt beroende på den cellulära kontexten. Ett DNA-bindande protein, Pleiohomeotic (Pho), binder tillsammans med andra faktorer till målgenernas Polycomb responselement (PRE), varefter E(z) trimetylerar histon H3K27. Även om PREs endast har identifierats i Drosophila har metaanalysen av förmodade målgener för PcG-proteiner visat att många av målgenerna är gemensamma för flugan, musen och människan. dac och Egfr ingår bland dessa gener (Schuettengruber et al., 2007). Således innehåller troligen den regulatoriska regionen för syrsans dac-gen PREs, genom vilka E(z) epigenetiskt reglerar uttrycket av dac under syrsans benregeneration (figur 2). Pågående forskning är inriktad på att karaktärisera funktionerna hos Pho-genen och andra PcG-komplexgener och epigenetiska modifierare under Gryllus benregeneration.
Till sist, varför orsakar E(z) RNAi extratibia-bildning? Ett hypotetiskt scenario är att när skenbenet amputeras vid den proximala positionen där dac-uttrycket är lågt, tillåter Utx-uttryck (som dominerar E(z)-uttrycket) dac-uttryck (figur 3a) för att återställa skenbenet. 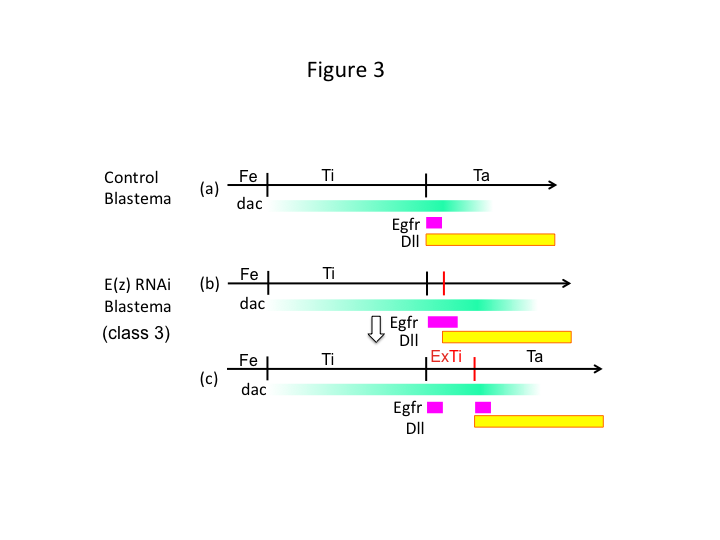 Dessa histonmodifierare känner alltså av positionsvärdena längs amputationsplatsens PD-axel och finjusterar uttrycksnivån för benmönstergener, som dac. Vid E(z) RNAi strax före proximal amputation induceras ett intensivt dac-uttryck som expanderar i det regenererande benet (figur 3b). Distal-less (Dll)-uttrycket, som är en annan benmönstergen som specificerar benets distala domän (Angelini och Kaufman, 2005), kan förskjutas mer distalt beroende på expanderat dac-uttryck (figur 3b). Således kan den Egfr-uttryckande domänen delas upp i två delar där (1) Dll-uttrycket är lågt och (2) Dll är högt. Extratiben bildas troligen mellan de två olika Egfr-uttryckande domänerna genom interkalering av cellproliferation och mönstring (figur 3c).
Dessa histonmodifierare känner alltså av positionsvärdena längs amputationsplatsens PD-axel och finjusterar uttrycksnivån för benmönstergener, som dac. Vid E(z) RNAi strax före proximal amputation induceras ett intensivt dac-uttryck som expanderar i det regenererande benet (figur 3b). Distal-less (Dll)-uttrycket, som är en annan benmönstergen som specificerar benets distala domän (Angelini och Kaufman, 2005), kan förskjutas mer distalt beroende på expanderat dac-uttryck (figur 3b). Således kan den Egfr-uttryckande domänen delas upp i två delar där (1) Dll-uttrycket är lågt och (2) Dll är högt. Extratiben bildas troligen mellan de två olika Egfr-uttryckande domänerna genom interkalering av cellproliferation och mönstring (figur 3c).
Vårt mål är att klarlägga blåkopior för att ”göra ett regenererat ben” med hjälp av denna attraktiva hemimetabola insektsmodell. Blåkopiorna förväntas klargöra hur antalet bensegment bestäms. Våra slående observationer av RNAi mot E(z) som leder till ”extra tibia-bildning” utgör ett viktigt steg mot att belysa denna process.
- Mito, T. och Noji, S. (2008). Den tvåfläckiga syrsan Gryllus bimaculatus: En ny modell för utvecklings- och regenerationsstudier. Cold Spring Harb Protoc, 331-346.
- Umesono, Y., Tasaki, J., Nishimura, Y., Hrouda, M., Kawaguchi, E., Yazawa, S., Nishimura, O., Hosoda, K., Inoue, T. och Agata, K. (2013). Den molekylära logiken för planariers regeneration längs den främre-posteriora axeln. Nature 500, 73-76.
- Endo, T., Bryant, S. V. and Gardiner, D. M. (2004). Ett stegvis modellsystem för regeneration av lemmar. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. och Bryant, S. V. (1976). Mönsterreglering i epimorfiska fält. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, T., Ohuchi, H., Noji, S. och Mito, T. (2013). Analys av RNA-Seq-data avslöjar inblandning av JAK/STAT-signalering under benregeneration hos syrsan Gryllus bimaculatus. Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. och Ohuchi, H. (2015). Benregeneration regleras epigenetiskt av histon H3K27-metylering hos syrsan Gryllus bimaculatus. Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. och Mito, T. (2015). Involvering av dachshund och Distal-less i distal mönsterbildning av syrenbenet under regeneration. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. och Cavalli, G. (2007). Genombrottsreglering av polycomb- och trithoraxproteiner. Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. och Mito, T. (2015). Insekter med kort grodd utnyttjar både det föråldrade och avledda sättet för Polycomb-grupp-medierad epigenetisk tystnad av Hox-gener. Biol Open 4, 702-709.
- Angelini,R. and Kaufman, T. C. (2005). Insekters bihang och jämförande ontogenetik. Dev Biol 286, 57-77.
Share
- Nummer:*
- Ditt namn:*
- Din e-postadress:*
- Detaljer:*
Skicka in rapport
 (1 röster)
(1 röster)
Tags: Chromatin och epigenetik, syrsa, regeneration
Kategorier: Forskning