En automne, les grillons présentent généralement des chants stridents dans le pays tempéré d’Asie orientale qu’est le Japon. Bien que le grillon des champs africain Gryllus bimaculatus soit originaire des pays tropicaux, il constitue un animal modèle émergent à l’échelle mondiale en raison de sa capacité à régénérer des pattes amputées pendant la nymphe et de son mode de développement (bande germinale courte) (Mito et Noji, 2008).
De nombreux organismes vivants du règne animal sont capables de faire repousser leurs parties du corps après une blessure. Parmi les exemples de parties du corps qui peuvent être repoussées, on peut citer la lentille et la queue des amphibiens, la tête des planaires et le cœur des poissons. En revanche, on a longtemps supposé que les humains ne pouvaient pas reconstituer les parties perdues de leur corps, à l’exception de certains tissus particuliers, notamment l’épiderme, le foie et la surface ovarienne après l’ovulation. Par conséquent, il est important d’élucider les mécanismes moléculaires impliqués dans les processus de régénération en utilisant des modèles animaux capables de régénérer des parties du corps pour une application ultérieure dans les organes et tissus humains non régénérables.
Au cours des deux dernières années, des études génomiques comparatives de deux espèces de planaires ayant des capacités de régénération différentes ont conduit à la régénération réussie de têtes en réduisant l’activité de la bêta-caténine à partir de fragments de queue autrement non régénérables (Umesono et al., 2013). Des études sur des vertébrés ayant la capacité de restaurer des membres, notamment des tritons, des grenouilles et des salamandres, ont démontré que la régénération des membres se produit de manière progressive. Le processus de régénération des membres est divisé en au moins trois phases : la cicatrisation, la dédifférenciation et le redéveloppement, la phase de redéveloppement imitant le développement embryonnaire (Endo et al., 2004).
La patte du grillon est composée de six segments qui sont disposés le long de l’axe proximo-distal (PD) : coxa, trochanter, fémur, tibia, tarse et griffe (figure 1). 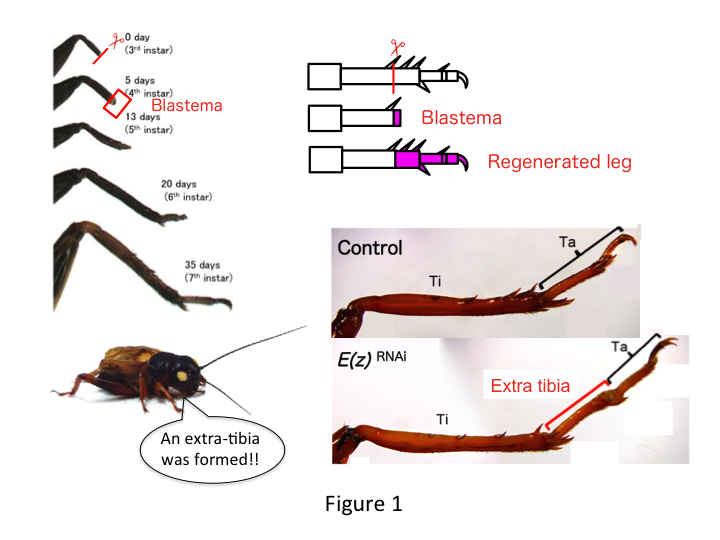 Le tarse est encore subdivisé en trois tarsomères. Lorsque le tibia de la nymphe du troisième stade est amputé, la patte se régénère et retrouve sa taille allométrique et sa forme appropriée au sixième stade (c’est-à-dire dans les 20 jours suivant l’amputation), retrouvant ainsi une taille et une forme adulte presque normales. Peu après la guérison, le blastème (un ensemble de cellules qui prolifèrent) se développe dans la région distale de la patte amputée. Les cellules du blastème prolifèrent et forment les structures manquantes par des processus intercalaires entre la région la plus distale et la partie restante de la patte (French et al., 1976).
Le tarse est encore subdivisé en trois tarsomères. Lorsque le tibia de la nymphe du troisième stade est amputé, la patte se régénère et retrouve sa taille allométrique et sa forme appropriée au sixième stade (c’est-à-dire dans les 20 jours suivant l’amputation), retrouvant ainsi une taille et une forme adulte presque normales. Peu après la guérison, le blastème (un ensemble de cellules qui prolifèrent) se développe dans la région distale de la patte amputée. Les cellules du blastème prolifèrent et forment les structures manquantes par des processus intercalaires entre la région la plus distale et la partie restante de la patte (French et al., 1976).
Préalablement, nous avons effectué une analyse transcriptomique comparative de pattes amputées régénérantes et normales de grillons afin de profiler l’expression des ARNm associés à la régénération des pattes (Bando et al., 2013). Nous nous sommes d’abord concentrés sur la régulation ascendante des gènes de la voie Jak/Stat, qui sont liés au système immunitaire. L’interférence ARN (ARNi) des gènes de cette voie a profondément perturbé la régénération des pattes. En revanche, l’ARNi contre Socs, un suppresseur de la signalisation des cytokines, a provoqué l’allongement des pattes. Des expériences supplémentaires ont montré que la voie Jak/Stat favorise la prolifération cellulaire en aval de la voie Ds/Fat.
Par la suite, nous avons étudié la régulation épigénétique au cours de la régénération des pattes de grillons. Tetsuya Bando, un chercheur principal de notre groupe, a identifié un gène pour l’histone H3 lysine 27 (H3K27) méthyltransférase, E(z), et un gène pour l’histone H3K27 déméthylase, Utx, chez G. bimaculatus. Le clonage des gènes de Gryllus est maintenant un processus simple grâce aux informations disponibles sur le génome du grillon (Mito et Noji, communication personnelle). La méthylation de l’histone H3K27 par E(z) réprime l’expression des gènes cibles en recrutant les protéines du groupe Polycomb. Inversement, la déméthylation de l’histone H3K27 triméthylée par Utx favorise l’expression des gènes. Tetsuya a constaté que la transcription des gènes E(z) et Utx est régulée à la hausse dans les cellules du blastème des jambes amputées (Bando et al., 2013). L’hybridation in situ a permis de vérifier que les deux gènes sont transcrits de manière ubiquitaire dans les pattes régénératrices des grillons, et que les deux gènes sont exprimés dans les embryons en développement (Hamada et al., 2015). Des immunomarquages sur les petites pattes amputées après ARNi par Yoshimasa Hamada (un étudiant en doctorat) ont confirmé que E(z) et Utx contribuent à la méthylation et à la déméthylation au niveau de l’histone H3K27me3, respectivement, pendant la régénération des pattes.
Toutefois, Yoshimasa a découvert de manière inattendue que le segment de patte supplémentaire est formé après ARNi contre E(z) (Figure 1). Initialement, nous n’avons pas été en mesure de déterminer l’identité du segment de jambe. Morphologiquement, le segment de jambe semblait être un tibia, car il possédait des épines et des éperons caractéristiques d’un tibia authentique. Notre première hypothèse était que les phénotypes après l’ARNi pouvaient dépendre du site d’amputation du tibia. Cependant, même lorsqu’une jambe est amputée dans la partie distale du fémur, le segment supplémentaire ressemblant à un tibia émerge. La formation des motifs le long des axes antéro-postérieur et dorso-ventral reste inchangée, sauf le long de l’axe PD. Nous avons ensuite examiné si le site d’amputation le long de l’axe PD dans le tibia influençait la sévérité phénotypique. L’extra-tibia qui se formait devenait plus long plus les sites d’amputation sur le tibia étaient proximaux (Figure 1). Inversement, l’ARNi contre Utx a entraîné la perte de la formation d’une articulation entre le tarsomère 1 (Ta1) et le Ta2 (Figure 2). 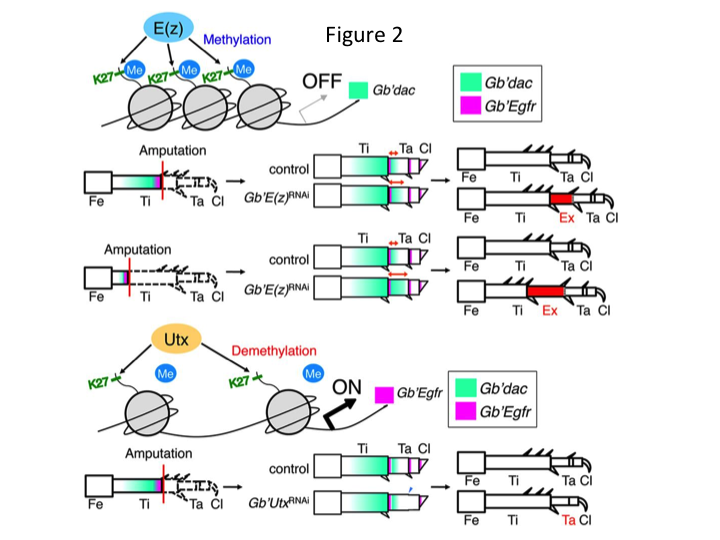 L’hybridation in situ a montré que l’expression des gènes de structuration des pattes s’est modifiée le long de l’axe PD. Plus précisément, le domaine d’expression de dachshund (dac) s’est étendu dans les pattes régénératrices E(z)RNAi, tandis que l’expression d’Egfr a diminué dans les pattes UtxRNAi. Par conséquent, E(z) peut réprimer l’expression de dac au cours de la régénération normale de la jambe, tandis que Utx induit l’expression d’Egfr.
L’hybridation in situ a montré que l’expression des gènes de structuration des pattes s’est modifiée le long de l’axe PD. Plus précisément, le domaine d’expression de dachshund (dac) s’est étendu dans les pattes régénératrices E(z)RNAi, tandis que l’expression d’Egfr a diminué dans les pattes UtxRNAi. Par conséquent, E(z) peut réprimer l’expression de dac au cours de la régénération normale de la jambe, tandis que Utx induit l’expression d’Egfr.
dac code un corépresseur transcriptionnel qui est catégorisé dans les gènes de l’écart de la jambe. dac produit des valeurs positionnelles brutes le long de l’axe PD de la jambe et médiateur de la formation du tibia distal et Ta1 (le tarsomère proximal) au cours de la régénération de la jambe du criquet (le domaine d’expression de dac est représenté en vert dans la Figure 2) (Ishimaru et al., 2015). Plus précisément, dac favorise la prolifération des cellules tibiales. Par conséquent, parce que l’ARNi contre E(z) upregule dac, l’expression de E(z) dans les cellules du blastème peut supprimer la surprolifération blastémale en réprimant l’expression supplémentaire de dac.
Cette information soulève la question de savoir comment E(z) régule spécifiquement l’expression de dac. En outre, quel est le mécanisme qui détermine les gènes cibles de E(z) ? E(z) appartient au complexe répressif Polycomb 2 (PRC2), qui est l’un des trois complexes du groupe Polycomb (PcG) (Schuettengruber et al., 2007). Au cours de l’embryogenèse du criquet, E(z) réprime l’expansion antérieure de l’expression des gènes Hox et assure une identité correcte des embryons (Matsuoka et al., 2015). Ces informations indiquent que les gènes cibles de E(z) diffèrent en fonction du contexte cellulaire. Une protéine de liaison à l’ADN, Pleiohomeotic (Pho), ainsi que d’autres facteurs, se lie aux éléments de réponse Polycomb (PRE) des gènes cibles, après quoi E(z) triméthyle l’histone H3K27. Bien que les PRE n’aient été identifiés que chez la drosophile, la méta-analyse des gènes cibles putatifs des protéines PcG a montré que de nombreux gènes cibles sont communs à la mouche, à la souris et à l’homme. dac et Egfr sont inclus parmi ces gènes (Schuettengruber et al., 2007). Ainsi, la région régulatrice du gène dac du grillon contient probablement des PRE, par lesquels E(z) régule épigénétiquement l’expression de dac pendant la régénération de la patte du grillon (Figure 2). Les recherches en cours visent à caractériser les fonctions du gène Pho et d’autres gènes du complexe PcG et modificateurs épigénétiques au cours de la régénération des pattes de Gryllus.
Enfin, pourquoi l’ARNi E(z) provoque-t-il la formation d’extra-tibias ? Un scénario hypothétique est que lorsque le tibia est amputé à la position proximale où l’expression de dac est faible, l’expression de Utx (qui domine l’expression de E(z)) permet l’expression de dac (Figure 3a) pour restaurer le tibia.
Notre objectif est d’élucider les blueprints pour « faire une jambe régénérée » en utilisant ce modèle attractif d’insecte hémimétabole. Ces plans devraient permettre de clarifier comment le nombre de segments de pattes est déterminé. Nos observations frappantes sur l’ARNi contre E(z) conduisant à la « formation de tibias supplémentaires » représentent une étape importante vers l’élucidation de ce processus.
- Mito, T. et Noji, S. (2008). Le grillon à deux points Gryllus bimaculatus : Un modèle émergent pour les études sur le développement et la régénération. Cold Spring Harb Protoc, 331-346.
- Umesono, Y., Tasaki, J., Nishimura, Y., Hrouda, M., Kawaguchi, E., Yazawa, S., Nishimura, O., Hosoda, K., Inoue, T. et Agata, K. (2013). La logique moléculaire de la régénération des planaires le long de l’axe antéro-postérieur. Nature 500, 73-76.
- Endo, T., Bryant, S. V. et Gardiner, D. M. (2004). Un système modèle par étapes pour la régénération des membres. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. et Bryant, S. V. (1976). Régulation des motifs dans les champs épimorphes. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, T., Ohuchi, H., Noji, S. et Mito, T. (2013). L’analyse des données RNA-Seq révèle l’implication de la signalisation JAK/STAT pendant la régénération des pattes chez le grillon Gryllus bimaculatus. Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. et Ohuchi, H. (2015). La régénération des pattes est régulée épigénétiquement par la méthylation de l’histone H3K27 chez le grillon Gryllus bimaculatus. Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. et Mito, T. (2015). Implication du teckel et de Distal-less dans la formation du motif distal de la patte du grillon pendant la régénération. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. et Cavalli, G. (2007). Régulation du génome par les protéines polycomb et trithorax. Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. et Mito, T. (2015). Les insectes à germe court utilisent à la fois le mode ancestral et dérivé du silençage épigénétique des gènes Hox médié par le groupe Polycomb. Biol Open 4, 702-709.
- Angelini,R. et Kaufman, T. C. (2005). Les appendices des insectes et l’ontogénétique comparative. Dev Biol 286, 57-77.
Share
- Issue:*
- Your Name:*
- Your Email :*
- Détails:*
Soumettre le rapport
 (1 votes)
(1 votes)
Tags : Chromatine et épigénétique, grillon, régénération
Catégories : Recherche