Syksyllä sirkat esittävät yleensä sirkutuslauluja lauhkean Itä-Aasian maassa Japanissa. Vaikka afrikkalainen kenttäsirkka Gryllus bimaculatus on kotoisin trooppisista maista, se on maailmanlaajuisesti nouseva mallieläin, koska se kykenee uudistamaan amputoituja jalkoja nymfinaikana ja koska sen kehitystapa (lyhyt sukusolukkovyöhyke) on lyhyt (Mito ja Noji, 2008) (Mito ja Noji, 2008).
Monet elävät organismit eläinkunnassa kykenevät kasvattamaan ruumiinosiaan uudelleen loukkaantumisen jälkeen. Esimerkkejä ruumiinosista, jotka voivat kasvaa uudelleen, ovat sammakkoeläinten linssi ja häntä, plantaarien pää ja kalojen sydän. Sitä vastoin pitkään on oletettu, että ihminen ei pysty kasvattamaan takaisin menetettyjä ruumiinosia, lukuun ottamatta tiettyjä kudoksia, kuten epidermistä, maksaa ja munasarjojen pintaa ovulaation jälkeen. Siksi on tärkeää selvittää regeneraatioprosesseihin liittyviä molekyylimekanismeja käyttämällä eläinmalleja, jotka pystyvät regeneroimaan ruumiinosia, jotta niitä voitaisiin myöhemmin soveltaa ihmisen ei-regeneroituviin elimiin ja kudoksiin.
Viimeisten kahden vuoden aikana kahden planaarilajin, joilla on erilaiset regeneraatiokyvyt, vertailevat genomitutkimukset johtivat onnistuneeseen pään regeneraatioon alentamalla beetakateniinin aktiivisuutta muuten ei-regeneroituvista hännänpalasista (Umesono ym., 2013). Tutkimukset selkärankaisilla, joilla on kyky palauttaa raajoja, mukaan lukien muurahaiset, sammakot ja salamanterit, ovat osoittaneet, että raajojen regeneraatio tapahtuu vaiheittain. Raajojen regeneraatioprosessi jaetaan ainakin kolmeen vaiheeseen: haavan paranemiseen, dedifferentiaatioon ja uudelleenkehitykseen, ja uudelleenkehitysvaihe jäljittelee alkionkehitystä (Endo ym., 2004).
Sirkan jalka koostuu kuudesta segmentistä, jotka ovat järjestäytyneet proksimodistaalisen (PD) akselin suuntaisesti: coxa (koxa), trochanter (trokanteeri), femur (reisiluu), tibia (sääriluu), tarsus (sääriluu), tarsus (sääriluujalka) ja claw (kynsijalka) (kuva 1). 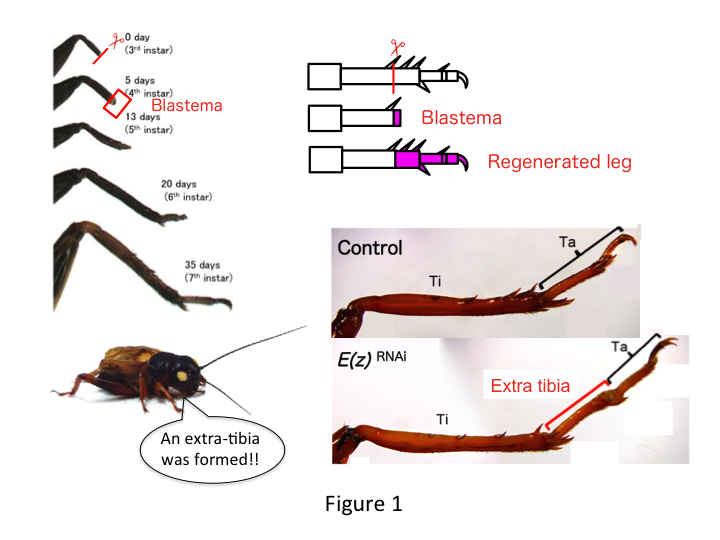 Tarsus jakautuu edelleen kolmeen tarsomeeriin. Kun kolmannessa tähdessä olevan nymfin sääriluu amputoidaan, jalka uudistuu ja palauttaa allometrisen kokonsa ja oikean muotonsa kuudenteen tähtiputkeen mennessä (eli 20 päivän kuluessa amputoinnista), jolloin se saavuttaa lähes normaalin aikuisen koon ja muodon. Pian paranemisen jälkeen amputoidun jalan distaalialueelle kehittyy blastema (lisääntyvien solujen allas). Blastema-solut lisääntyvät ja muodostavat puuttuvat rakenteet interkalaarisilla prosesseilla distaalisimman alueen ja jalan jäljelle jäävän osan välille (French ym., 1976).
Tarsus jakautuu edelleen kolmeen tarsomeeriin. Kun kolmannessa tähdessä olevan nymfin sääriluu amputoidaan, jalka uudistuu ja palauttaa allometrisen kokonsa ja oikean muotonsa kuudenteen tähtiputkeen mennessä (eli 20 päivän kuluessa amputoinnista), jolloin se saavuttaa lähes normaalin aikuisen koon ja muodon. Pian paranemisen jälkeen amputoidun jalan distaalialueelle kehittyy blastema (lisääntyvien solujen allas). Blastema-solut lisääntyvät ja muodostavat puuttuvat rakenteet interkalaarisilla prosesseilla distaalisimman alueen ja jalan jäljelle jäävän osan välille (French ym., 1976).
Aiemmin suoritimme vertailevan transkriptomianalyysin regeneroituvista ja normaaleista amputoiduista sirkkojen jaloista profiloidaksemme jalan regeneraatioon liittyvää mRNA-ekspressiota (Bando ym., 2013). Keskityimme ensin immuunijärjestelmään liittyvien Jak/Stat-reitin geenien ylössäätelyyn. Tämän polun geenien RNA-interferenssi (RNAi) häiritsi perusteellisesti jalkojen regeneraatiota. Sitä vastoin RNAi sytokiinisignalointia tukevaa Socs-geeniä vastaan aiheutti jalkojen pidentymistä. Lisäkokeet osoittivat, että Jak/Stat-reitti edistää solujen proliferaatiota Ds/Fat-reitin alapuolella.
Selvitimme tämän jälkeen epigeneettistä säätelyä sirkan jalkojen uudistumisen aikana. Tetsuya Bando, ryhmämme vanhempi tutkija, tunnisti yhden histoni H3 lysiini 27:n (H3K27) metyylitransferaasigeenin, E(z), ja yhden histoni H3K27-demetylaasigeenin, Utx, geenin G. bimaculatusissa. Grylluksen geenien kloonaaminen on nyt suoraviivainen prosessi, koska sirkan genomista on saatavilla tietoa (Mito ja Noji, henkilökohtainen tiedonanto). E(z):n suorittama histoni H3K27:n metylaatio tukahduttaa kohdegeenien ilmentymistä rekrytoimalla Polycomb-ryhmän proteiineja. Sitä vastoin trimetyloituneen histoni H3K27:n demetyloituminen Utx:n toimesta edistää geenien ilmentymistä. Tetsuya havaitsi, että sekä E(z)- että Utx-geenien transkriptio on säännelty ylöspäin amputoitujen jalkojen blastema-soluissa (Bando ym., 2013). In situ -hybridisaatio varmisti, että molemmat geenit transkriboituvat ubikvitaarisesti sirkkojen uudistuvissa jaloissa ja että molemmat geenit ilmentyvät kehittyvissä alkioissa (Hamada ym., 2015). Yoshimasa Hamadan (tohtorikoulutettava) tekemä immunovärjäys amputoiduista pikkusirkkojen jaloista RNAi:n jälkeen vahvisti, että E(z) ja Utx osallistuvat metylaatioon ja demetylaatioon histoni H3K27me3:n kohdalla vastaavasti jalkojen regeneraation aikana.
Yoshimasa havaitsi kuitenkin yllättäen, että ylimääräinen jalan segmentti muodostuu E(z:n vastaisen RNAi:n jälkeen (kuva 1). Aluksi emme pystyneet määrittämään jalkasegmentin identiteettiä. Morfologisesti jalkasegmentti näytti olevan sääriluu, koska siinä oli aidolle sääriluun luonteenomaisia piikkejä ja kannuksia. Ensimmäinen hypoteesimme oli, että RNAi:n jälkeiset fenotyypit saattaisivat riippua sääriluun amputaatiokohdasta. Kuitenkin myös silloin, kun jalka amputoidaan reisiluun distaaliosasta, ylimääräinen sääriluun kaltainen segmentti syntyy. Kuvionmuodostus antero-posteriorista ja dorso-ventraalista akselia pitkin pysyi muuttumattomana lukuun ottamatta PD-akselia. Tämän jälkeen tutkittiin, vaikuttaako sääriluun PD-akselin varrella oleva amputaatiokohta fenotyypin vakavuuteen. Muodostuneet ylimääräiset sääriluut pitenivät sitä enemmän, mitä proksimaalisempi amputaatiokohta sääriluussa oli (kuva 1). Sitä vastoin RNAi Utxia vastaan johti siihen, että nivelen muodostuminen tarsomere 1:n (Ta1) ja Ta2:n välille hävisi (kuva 2). 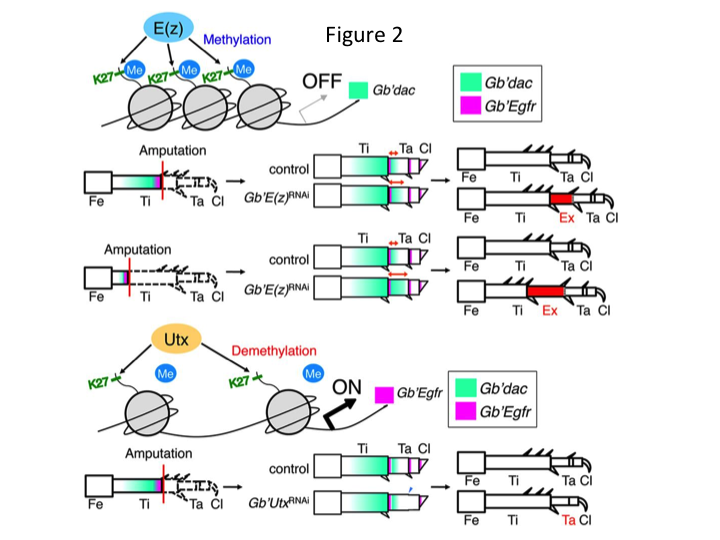 In situ -hybridisaatio osoitti, että jalkojen mallinnusgeenien ilmentyminen muuttui PD-akselia pitkin. Erityisesti dac-geenin (dac) ekspressio laajeni E(z)RNAi-regeneroivissa jaloissa, kun taas Egfr-ekspressio väheni UtxRNAi-jaloissa. Näin ollen E(z) saattaa tukahduttaa dac-ekspressiota normaalin jalan regeneraation aikana, kun taas Utx indusoi Egfr-ekspressiota.
In situ -hybridisaatio osoitti, että jalkojen mallinnusgeenien ilmentyminen muuttui PD-akselia pitkin. Erityisesti dac-geenin (dac) ekspressio laajeni E(z)RNAi-regeneroivissa jaloissa, kun taas Egfr-ekspressio väheni UtxRNAi-jaloissa. Näin ollen E(z) saattaa tukahduttaa dac-ekspressiota normaalin jalan regeneraation aikana, kun taas Utx indusoi Egfr-ekspressiota.
dac koodaa transkriptionaalista ko-repressoria, joka on luokiteltu jalan aukkogeeneihin. dac tuottaa raa’at asentoarvot jalan PD-akselia pitkin ja välittää distaalisen sääriluun ja Ta1:n (proksimaalisen tarsomeren) muodostumista sirkkajalan regeneraation aikana (dac:n ilmentymisalue on esitetty vihreällä värillä kuviossa 2) (Ishimaru ym. ym., 2015). Erityisesti dac edistää sääriluun solujen proliferaatiota. Siksi, koska RNAi E(z):tä vastaan säätelee dac:ia ylöspäin, E(z):n ilmentyminen blastemasoluissa saattaa tukahduttaa blastemalin yliproliferaation tukahduttamalla ylimääräisen dac:n ilmentymisen.
Tämä tieto herättää kysymyksen siitä, miten E(z) säätelee spesifisesti dac:n ilmentymistä. Lisäksi mikä on se mekanismi, joka määrittää E(z):n kohdegeenit? E(z) kuuluu Polycomb-repressiiviseen kompleksiin 2 (PRC2), joka on yksi kolmesta Polycomb-ryhmän (PcG) kompleksista (Schuettengruber ym., 2007). Sirkkaembryogeneesin aikana E(z) tukahduttaa Hox-geenien ilmentymisen etummaista laajenemista ja varmistaa alkioiden oikean identiteetin (Matsuoka ym., 2015). Nämä tiedot osoittavat, että E(z):n kohdegeenit vaihtelevat solukontekstista riippuen. DNA:ta sitova proteiini Pleiohomeotic (Pho) sitoutuu yhdessä muiden tekijöiden kanssa kohdegeenien Polycomb-vaste-elementteihin (PRE), minkä jälkeen E(z) trimetyloi histoni H3K27:n. Vaikka PRE:t on tunnistettu vain Drosofiassa, PcG-proteiinien oletettujen kohdegeenien meta-analyysi on osoittanut, että monet kohdegeenit ovat yhteisiä kärpäsellä, hiirellä ja ihmisellä. dac ja Egfr kuuluvat näihin geeneihin (Schuettengruber ym., 2007). Näin ollen sirkan dac-geenin säätelyalue sisältää todennäköisesti PRE:itä, joiden kautta E(z) säätelee epigeneettisesti dacin ilmentymistä sirkan jalkojen uudistumisen aikana (kuva 2). Käynnissä oleva tutkimus keskittyy Pho-geenin ja muiden PcG-kompleksin geenien ja epigeneettisten modifioijien toimintojen luonnehtimiseen Gryllus-sirkan jalkojen regeneraation aikana.
Loppujen lopuksi, miksi E(z)-RNAi aiheuttaa ekstra-tibian muodostumista? Yksi hypoteettinen skenaario on, että kun sääriluu amputoidaan proksimaalisesta kohdasta, jossa dac-ekspressio on vähäistä, Utx-ekspressio (joka dominoi E(z)-ekspressiota) sallii dac-ekspression (kuva 3a) palauttaa sääriluun. 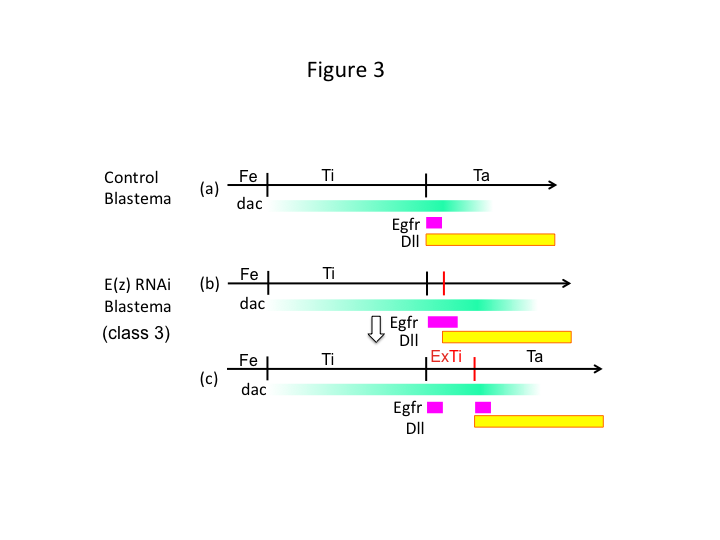 Siten nämä histonimodifikaattorit aistivat amputointikohdan PD-akselin pituiset asentoarvot ja hienosäätävät jalkojen mallinnusgeenien, kuten dacin, ilmentymistasoa. E(z) RNAi:n tapauksessa juuri ennen proksimaalista amputaatiota voimakas dac-ekspressio indusoituu ja laajenee uudistuvassa jalassa (kuva 3b). Distal-less (Dll) -geenin ilmentyminen, joka on toinen jalan aukkogeeni, joka määrittelee jalan distaalisen alueen (Angelini ja Kaufman, 2005), voi siirtyä distaalisemmaksi riippuen laajentuneesta dac-ekspressiosta (kuva 3b). Egfr:ää ilmentävä domeeni voidaan siis erottaa kahteen osaan, joissa (1) Dll-ekspressio on matala ja (2) Dll-ekspressio on korkea. Ekstra-tibia muodostuu luultavasti näiden kahden eri Egfr-ekspressoivan domainin väliin solujen interkaloituvan proliferaation ja kuvioinnin avulla (kuva 3c).
Siten nämä histonimodifikaattorit aistivat amputointikohdan PD-akselin pituiset asentoarvot ja hienosäätävät jalkojen mallinnusgeenien, kuten dacin, ilmentymistasoa. E(z) RNAi:n tapauksessa juuri ennen proksimaalista amputaatiota voimakas dac-ekspressio indusoituu ja laajenee uudistuvassa jalassa (kuva 3b). Distal-less (Dll) -geenin ilmentyminen, joka on toinen jalan aukkogeeni, joka määrittelee jalan distaalisen alueen (Angelini ja Kaufman, 2005), voi siirtyä distaalisemmaksi riippuen laajentuneesta dac-ekspressiosta (kuva 3b). Egfr:ää ilmentävä domeeni voidaan siis erottaa kahteen osaan, joissa (1) Dll-ekspressio on matala ja (2) Dll-ekspressio on korkea. Ekstra-tibia muodostuu luultavasti näiden kahden eri Egfr-ekspressoivan domainin väliin solujen interkaloituvan proliferaation ja kuvioinnin avulla (kuva 3c).
Tavoitteenamme on selvittää piirustukset ”uudistetun jalan tekemisestä” tämän houkuttelevan hemimetabolisen hyönteismallin avulla. Piirustusten odotetaan selventävän, miten jalkasegmenttien lukumäärä määräytyy. Silmiinpistävät havaintomme RNAi:sta E(z):tä vastaan, joka johtaa ”ylimääräisen sääriluun muodostumiseen”, ovat tärkeä askel kohti tämän prosessin selvittämistä.
- Mito, T. ja Noji, S. (2008). Kaksitahuksinen sirkka Gryllus bimaculatus: An emerging Model for Developmental and Regeneration Studies. Cold Spring Harb Protoc, 331-346.
- Umesono, Y., Tasaki, J., Nishimura, Y., Hrouda, M., Kawaguchi, E., Yazawa, S., Nishimura, O., Hosoda, K., Inoue, T. ja Agata, K. (2013). Molekulaarinen logiikka planarialaisen regeneraation etu- ja taka-akselia pitkin. Nature 500, 73-76.
- Endo, T., Bryant, S. V. ja Gardiner, D. M. (2004). Vaiheittainen mallijärjestelmä raajojen regeneraatiolle. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. ja Bryant, S. V. (1976). Kuvion säätely epimorfisissa kentissä. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, Y., Nakamura, T., Ohuchi, H., Noji, S. ja Mito, T. (2013). RNA-Seq-datan analyysi paljastaa JAK/STAT-signaloinnin osallistumisen sirkka Gryllus bimaculatusin jalkojen uudistumisen aikana. Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. ja Ohuchi, H. (2015). Jalkojen uudistumista säätelee epigeneettisesti histoni H3K27-metylaatio sirkka Gryllus bimaculatusissa. Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. ja Mito, T. (2015). Dachshundin ja Distal-lessin osallistuminen sirkkajalan distaalisen kuvion muodostumiseen regeneraation aikana. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. ja Cavalli, G. (2007). Genomin säätely polycomb- ja trithorax-proteiinien avulla. Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. ja Mito, T. (2015). Lyhyet itiöhyönteiset hyödyntävät sekä esi- että johdettua Polycomb-ryhmän välittämää Hox-geenien epigeneettistä hiljentämistapaa. Biol Open 4, 702-709.
- Angelini,R. ja Kaufman, T. C. (2005). Hyönteisten lisäkkeet ja vertaileva ontogenetiikka. Dev Biol 286, 57-77.
Jaa
- Aihe:*
- Nimesi:*
- Sähköpostisi:*
- Details:*
Submit Report
 (1 votes)
(1 votes)
Tags: Kromatiini ja epigenetiikka, sirkka, uudistuminen
Kategoriat: Tutkimus