東アジアの温暖な日本では、秋になるとコオロギが鳴くのが一般的である。 アフリカンフィールドコオロギGryllus bimaculatusは熱帯地方が原産地ですが、ニンフ中に切断された脚を再生する能力とその発生様式(短い生殖帯)から、世界的に新しいモデル動物となっています(Mito and Noji, 2008)<1188>動物界では多くの生物が、怪我をしてもその体の一部を再生させることができます。 両生類の水晶体や尾、プラナリアの頭部、魚類の心臓などがその例である。 一方、ヒトは、表皮、肝臓、排卵後の卵巣表面など、特定の組織を除いて、失った身体の一部を元に戻すことはできないとされてきた。 そこで、体の一部を再生できる動物モデルを用いて再生過程に関わる分子機構を解明し、その後の非再生ヒト臓器・組織への応用を図ることが重要である。
この2年間で、再生能力の異なる2種のプラナリアの比較ゲノム研究により、再生できない尾断片からベータカテニン活性を低下させて頭部の再生に成功した(Umesono et al.、2013)。 イモリ、カエル、サンショウウオなど四肢の再生能力を持つ脊椎動物の研究により、四肢の再生は段階的に行われることが明らかにされています。 手足の再生過程は、少なくとも創傷治癒、脱分化、再開発の3段階に分けられ、再開発段階は胚の発生を模倣している(Endo et al.、2004)。
コオロギの足は、近位-遠位(PD)軸に沿って並ぶ、尾骨、トロカンタ、大腿骨、脛骨、足根、爪の6節からなる(図1)。 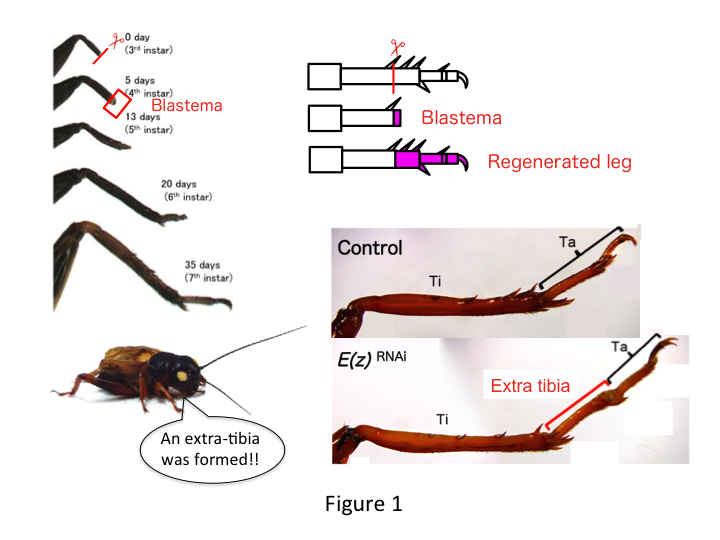 足根はさらに3つの足根骨に細分化されます。 3齢幼虫の脛骨を切断すると、6齢までに(つまり切断後20日以内に)脚が再生し、ほぼ正常な成虫の大きさと形に回復する。 切断された脚の遠位部には、治癒後すぐに胚盤胞(増殖する細胞の集まり)が形成される。 ブラステマ細胞は増殖し、最遠位部と脚の残存部との間の間質突起によって欠損構造を形成する(French et al.、1976)。
足根はさらに3つの足根骨に細分化されます。 3齢幼虫の脛骨を切断すると、6齢までに(つまり切断後20日以内に)脚が再生し、ほぼ正常な成虫の大きさと形に回復する。 切断された脚の遠位部には、治癒後すぐに胚盤胞(増殖する細胞の集まり)が形成される。 ブラステマ細胞は増殖し、最遠位部と脚の残存部との間の間質突起によって欠損構造を形成する(French et al.、1976)。
以前、我々はコオロギの再生脚と正常切断脚の比較トランスクリプトーム解析を行って脚再生に関わるmRNA発現をプロファイルした(Bando et al.、 2013)。 まず、免疫系に関連するJak/Stat経路遺伝子の発現上昇に着目した。 この経路の遺伝子をRNA干渉(RNAi)すると、脚の再生が徹底的に阻害された。 一方、サイトカインシグナルを抑制するSocsに対するRNAiは脚の伸長を引き起こした。 追加の実験により、Jak/Stat経路がDs/Fat経路の下流で細胞増殖を促進することが示されました。
その後、コオロギの脚の再生におけるエピジェネティック制御について調査しました。 坂東哲也(当研究室主任研究員)は、G. bimaculatusからヒストンH3リジン27(H3K27)メチル化酵素の遺伝子E(z)、ヒストンH3K27脱メチル化酵素の遺伝子Utxを1つずつ同定しました。 グリルス遺伝子のクローニングは、コオロギのゲノムに関する情報が入手できるようになったため、現在では簡単な作業となっている(Mito and Noji, personal communication)。 E(z)によるヒストンH3K27のメチル化は、Polycombグループタンパク質をリクルートすることにより、標的遺伝子の発現を抑制する。 逆に、トリメチル化されたヒストンH3K27をUtxが脱メチル化することで、遺伝子発現が促進される。 哲也は、切断された脚の胚盤細胞において、E(z)遺伝子とUtx遺伝子の両方の転写が上昇することを発見しました(Bando et al.、2013)。 In situハイブリダイゼーションにより、両遺伝子がコオロギの再生脚でユビキタスに転写されること、そして両遺伝子が発生途上の胚で発現することを検証した(Hamada et al.、2015)。 濱田芳正(博士課程)によりRNAi後に切断された小さな脚の免疫染色が行われ、脚の再生時にE(z)とUtxがそれぞれヒストンH3K27me3でのメチル化、脱メチル化に寄与することが確認されました
しかし、芳正は予想外にE(z)に対するRNAi後に余分の脚節を形成することを発見します(図1)。 当初、この脚節の正体は分からなかった。 形態学的には、脚節は本物の脛骨に特徴的な棘や突起を持っていたため、脛骨のように見えたのだ。 私たちは、RNAi後の表現型は脛骨の切断部位に依存するのではないかという仮説を立てました。 しかし、大腿骨の遠位部で脚を切断した場合でも、余分な脛骨様のセグメントが出現するのです。 前後軸と背腹軸に沿ったパターン形成は、PD軸を除いて変化しなかった。 次に、脛骨のPD軸に沿った切断部位が表現型の重症度に影響を与えるかどうかを検討した。 形成された余剰脛骨は、脛骨の切断部位が近接するほど長くなった(図1)。 逆に、Utxに対するRNAiは、足根骨1(Ta1)とTa2間の関節形成を失わせる結果となった(図2)。 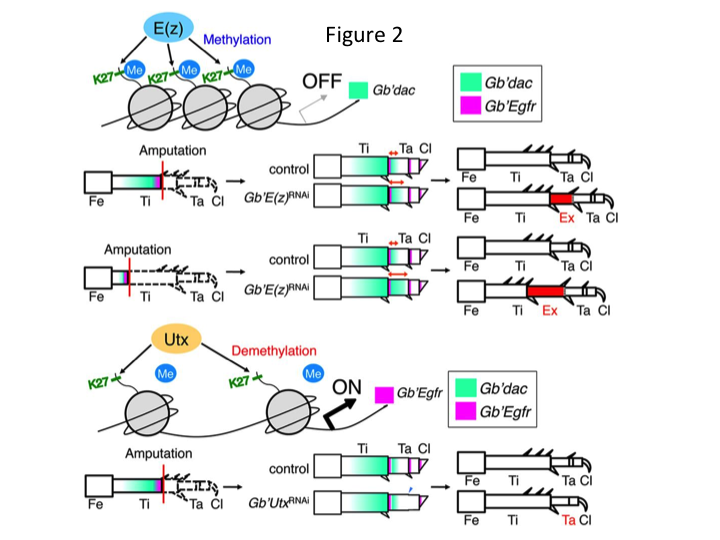 In situハイブリダイゼーションにより、脚部パターン形成遺伝子の発現がPD軸に沿って変化することが示された。 具体的には、E(z)RNAiで再生した脚ではダックスフントのドメイン(dac)の発現が拡大し、一方、UtxRNAiの脚ではEgfrの発現が減少していることがわかった。 したがって、E(z)は正常な脚の再生時にdacの発現を抑制し、一方、UtxはEgfrの発現を誘導すると考えられる。
In situハイブリダイゼーションにより、脚部パターン形成遺伝子の発現がPD軸に沿って変化することが示された。 具体的には、E(z)RNAiで再生した脚ではダックスフントのドメイン(dac)の発現が拡大し、一方、UtxRNAiの脚ではEgfrの発現が減少していることがわかった。 したがって、E(z)は正常な脚の再生時にdacの発現を抑制し、一方、UtxはEgfrの発現を誘導すると考えられる。
dac は脚ギャップ遺伝子に分類される転写共同抑制因子をコードし、dacは脚のPD軸に沿って粗位置値を作り出し、クリケット脚再生時に遠位脛骨とTa1(近位足根部)を形成する仲介をする(図2において緑でdac発現領域を示す)(石丸ら,2015年)。 具体的には、dacは脛骨細胞の増殖を促進する。 したがって、E(z)に対するRNAiはdacをアップレギュレートするため、胚盤細胞におけるE(z)の発現は余分なdacの発現を抑制することにより胚盤の過剰増殖を抑制していると考えられる
この情報は、E(z)がどのように特異的にdacの発現を制御しているのかという疑問を投げかけるものであった。 さらに、E(z)の標的遺伝子を決定する機構は何であろうか。 E(z)は3つのPolycomb group (PcG) complexの一つであるPolycomb repressive complex 2 (PRC2) に属する (Schuettengruber et al., 2007)。 コオロギの胚発生において、E(z)はHox遺伝子発現の前方拡大を抑制し、胚に適切なアイデンティティを与える(Matsuoka et al.、2015)。 この情報は、E(z)の標的遺伝子が細胞の状況によって異なることを示しています。 DNA結合タンパク質であるPleiohomeotic (Pho) が他の因子とともに標的遺伝子のPolycomb response element (PRE) に結合し、その後E(z)はヒストンH3K27をトリメチル化する。 PREはショウジョウバエでしか同定されていないが、PcGタンパク質の推定標的遺伝子のメタ解析により、標的遺伝子の多くが、ハエ、マウス、ヒトに共通であることが示されている。 したがって、コオロギのdac遺伝子の制御領域にはおそらくPREが存在し、これを通じてE(z)はコオロギの脚の再生時にdacの発現をエピジェネティックに制御していると考えられる(図2)。 現在進行中の研究は、Gryllus脚の再生におけるPho遺伝子や他のPcG複合遺伝子およびエピジェネティック修飾因子の機能を特徴付けることに焦点を当てている。
最後に、なぜE(z) RNAiは余脛骨形成を引き起こすのだろうか? 一つの仮説として、脛骨がdacの発現が低い近位位置で切断されたとき、Utxの発現(E(z)発現を支配する)がdacの発現(図3a)を許して脛骨を回復させるというシナリオがある。 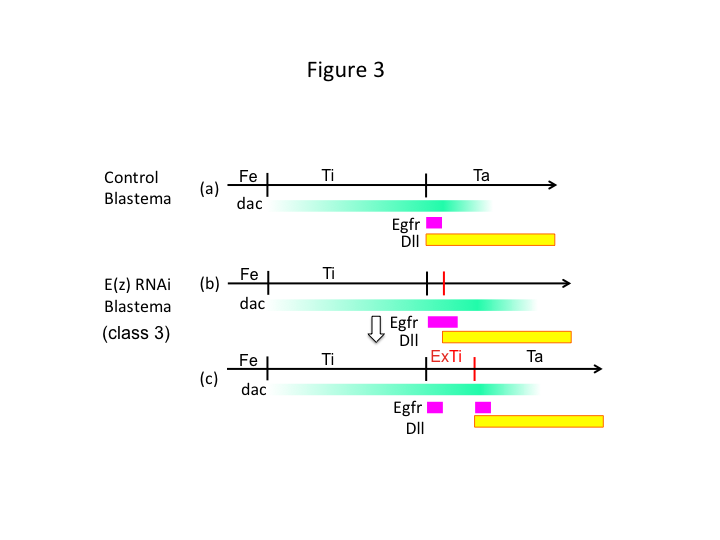 このように、これらのヒストン修飾因子は切断部位のPD軸に沿った位置値を感知し、dacのような脚部パターン形成遺伝子の発現レベルを微調整しているのである。 近位切断の直前にE(z) RNAiを行った場合、再生する脚ではdacの激しい発現が誘導され、拡大している(図3b)。 脚の遠位領域を指定するもう一つの脚部ギャップ遺伝子であるDll (Angelini and Kaufman, 2005)の発現は、拡大したdacの発現に応じてより遠位にシフトする可能性がある(図3b)。 したがって、Egfr発現領域は、(1)Dllの発現が低い部分と(2)Dllの発現が高い部分に分かれる可能性がある。 この魅力的な半代謝性昆虫モデルを用いて、「再生脚を作る」ための青写真を明らかにすることが我々の目標である(図3c)。 この設計図により、脚の節数がどのように決定されるかが明らかになると期待される。 E(z)に対するRNAiが「余分な脛骨の形成」をもたらすという私たちの印象的な観察は、このプロセスの解明に向けて重要な一歩となります。
このように、これらのヒストン修飾因子は切断部位のPD軸に沿った位置値を感知し、dacのような脚部パターン形成遺伝子の発現レベルを微調整しているのである。 近位切断の直前にE(z) RNAiを行った場合、再生する脚ではdacの激しい発現が誘導され、拡大している(図3b)。 脚の遠位領域を指定するもう一つの脚部ギャップ遺伝子であるDll (Angelini and Kaufman, 2005)の発現は、拡大したdacの発現に応じてより遠位にシフトする可能性がある(図3b)。 したがって、Egfr発現領域は、(1)Dllの発現が低い部分と(2)Dllの発現が高い部分に分かれる可能性がある。 この魅力的な半代謝性昆虫モデルを用いて、「再生脚を作る」ための青写真を明らかにすることが我々の目標である(図3c)。 この設計図により、脚の節数がどのように決定されるかが明らかになると期待される。 E(z)に対するRNAiが「余分な脛骨の形成」をもたらすという私たちの印象的な観察は、このプロセスの解明に向けて重要な一歩となります。
- Mito, T. and Noji, S.A. (2008). 二枚舌のコオロギ Gryllus bimaculatus: 発生・再生研究のための新たなモデル. Cold Spring Harb Protoc, 331-346.
- 梅園祐子・田崎淳一・西村陽子・廣田稔・川口恵子・矢沢慎一・西村修・細田和也・井上哲也・縣一樹(2013). プラナリアの前後軸に沿った再生の分子論理。 Nature 500, 73-76.
- Endo, T., Bryant, S. V. and Gardiner, D. M. (2004). 四肢再生の段階的モデルシステム. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. and Bryant, S. V. (1976). エピモルフィックフィールドにおけるパターン調節. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, T., Ohuchi, H., Noji, S. and Mito, T. (2013). RNA-Seqデータの解析により、コオロギGryllus bimaculatusの脚部再生におけるJAK/STATシグナルの関与が明らかとなった。 Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. and Ohuchi, H. (2015). コオロギGryllus bimaculatusにおける脚の再生はヒストンH3K27メチル化によってエピジェネティックに制御されている。 Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. and Mito, T. (2015). コオロギ脚の再生時の遠位パターン形成におけるdachshundとDistal-lessの関与. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. and Cavalli, G. (2007). ポリコームとトリソラックスタンパク質によるゲノム制御。 Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. and Mito, T.(2015).ポリコムタンパク質とトリソラックスタンパク質によるゲノム制御. 短胚昆虫は、Hox遺伝子のPolycombグループ媒介エピジェネティックサイレンシングの祖先モードと派生モードの両方を利用する。 Biol Open 4, 702-709.
- Angelini,R. and Kaufman,T. C. (2005). 昆虫の付属器と比較個体発生学. Dev Biol 286, 57-77.
Share
- Issue:*
- Your Name:*
- Your Email:*
- Details:*
Submit Report
 (1 votes)
(1 votes)
Tags.Tags: クロマチン・エピジェネティクス、コオロギ、再生
カテゴリー: 研究