In de herfst laten krekels in het gematigde Oost-Aziatische land Japan over het algemeen tsjirpen horen. Hoewel de Afrikaanse veldkrekel Gryllus bimaculatus afkomstig is uit tropische landen, is het wereldwijd een opkomend modeldier vanwege zijn vermogen om geamputeerde poten tijdens de nimf te regenereren en zijn ontwikkelingsmodus (korte kiemband) (Mito en Noji, 2008).
Veel levende organismen in het dierenrijk zijn in staat om hun lichaamsdelen na verwonding opnieuw te laten aangroeien. Voorbeelden van lichaamsdelen die weer kunnen aangroeien zijn de lens en de staart van amfibieën, de kop van planaria en het hart van vissen. Daarentegen is lang aangenomen dat de mens verloren lichaamsdelen niet kan herstellen, met uitzondering van bepaalde weefsels, waaronder de opperhuid, de lever, en het oppervlak van de eierstokken na de ovulatie. Daarom is het belangrijk om de moleculaire mechanismen die betrokken zijn bij regeneratieprocessen op te helderen met behulp van diermodellen die in staat zijn om lichaamsdelen te regenereren voor latere toepassing in niet-regeneratieve menselijke organen en weefsels.
In de afgelopen 2 jaar hebben vergelijkende genomische studies van twee planarianensoorten met verschillende regeneratieve capaciteiten geleid tot de succesvolle regeneratie van hoofden door het verminderen van bèta-catenine activiteit van anders niet-regeneratieve staartfragmenten (Umesono et al., 2013). Studies van gewervelde dieren met het vermogen om ledematen te regenereren, waaronder salamanders, kikkers en salamanders, hebben aangetoond dat de regeneratie van ledematen stapsgewijs verloopt. Het regeneratieproces van ledematen is verdeeld in ten minste drie fasen: wondgenezing, dedifferentiatie, en herontwikkeling, waarbij de herontwikkelingsfase de embryonale ontwikkeling nabootst (Endo et al., 2004).
De krekelpoot is samengesteld uit zes segmenten die zijn gerangschikt langs de proximo-distale (PD) as: coxa, trochanter, femur, tibia, tarsus, en klauw (figuur 1). 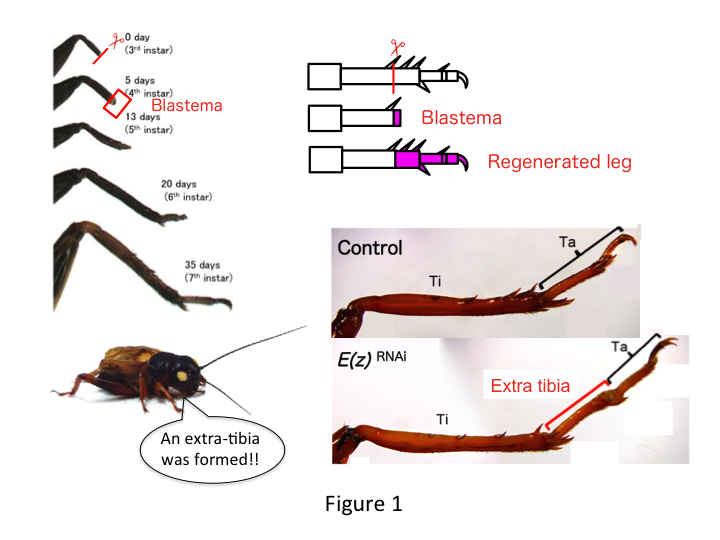 De tarsus is verder onderverdeeld in drie tarsomeren. Wanneer de tibia van de derde-instar nimf wordt geamputeerd, regenereert de poot en krijgt zijn allometrische grootte en juiste vorm terug tegen de zesde instar (d.w.z. binnen 20 dagen na amputatie), en is hersteld tot bijna normale volwassen grootte en vorm. Spoedig na de genezing ontwikkelt zich in het distale gebied van het geamputeerde been een blastema (een poel van woekerende cellen). Blastema cellen woekeren en vormen de ontbrekende structuren door intercalaire processen tussen de meest distale regio en het resterende deel van de poot (French et al., 1976).
De tarsus is verder onderverdeeld in drie tarsomeren. Wanneer de tibia van de derde-instar nimf wordt geamputeerd, regenereert de poot en krijgt zijn allometrische grootte en juiste vorm terug tegen de zesde instar (d.w.z. binnen 20 dagen na amputatie), en is hersteld tot bijna normale volwassen grootte en vorm. Spoedig na de genezing ontwikkelt zich in het distale gebied van het geamputeerde been een blastema (een poel van woekerende cellen). Blastema cellen woekeren en vormen de ontbrekende structuren door intercalaire processen tussen de meest distale regio en het resterende deel van de poot (French et al., 1976).
Vroeger hebben we vergelijkende transcriptoom analyse uitgevoerd van regenererende en normale geamputeerde poten van krekels om mRNA expressie geassocieerd met beenregeneratie te profileren (Bando et al., 2013). We richtten ons eerst op de upregulatie van Jak/Stat pathway genen, die gekoppeld zijn aan het immuunsysteem. RNA-interferentie (RNAi) van genen in deze pathway verstoorde de beenregeneratie grondig. RNAi tegen Socs, een onderdrukker van cytokinesignalering, zorgde daarentegen voor beenverlenging. Aanvullende experimenten toonden aan dat de Jak/Stat pathway celproliferatie bevordert stroomafwaarts van de Ds/Fat pathway.
Subsequent onderzochten we epigenetische regulatie tijdens de regeneratie van krekelpoten. Tetsuya Bando, een senior onderzoeker in onze groep, identificeerde één gen voor histon H3 lysine 27 (H3K27) methyltransferase, E(z), en één gen voor histon H3K27 demethylase, Utx, in G. bimaculatus. Het klonen van Gryllus-genen is nu een eenvoudig proces, omdat er informatie beschikbaar is over het genoom van de krekel (Mito en Noji, persoonlijke communicatie). Methylering van histon H3K27 door E(z) onderdrukt de expressie van doelgenen door Polycomb-groep eiwitten aan te trekken. Omgekeerd bevordert demethylering van het getrimethyleerde histon H3K27 door Utx de expressie van genen. Tetsuya ontdekte dat de transcriptie van zowel E(z) als Utx genen geüpreguleerd is in de blastema cellen van geamputeerde benen (Bando et al., 2013). In situ hybridisatie verifieerde dat beide genen ubiquitair getranscribeerd zijn in de regenererende poten van krekels, en dat beide genen tot expressie komen in zich ontwikkelende embryo’s (Hamada et al., 2015). Immunostaining op de geamputeerde kleine poten na RNAi door Yoshimasa Hamada (een promovendus) bevestigde dat E(z) en Utx bijdragen aan de methylering en demethylering op histon H3K27me3, respectievelijk, tijdens pootregeneratie.
Hoewel, Yoshimasa vond onverwachts dat het extra pootsegment wordt gevormd na RNAi tegen E(z) (figuur 1). Aanvankelijk waren we niet in staat om de identiteit van het beensegment te bepalen. Morfologisch leek het beensegment een tibia te zijn, omdat het stekels en uitlopers had die kenmerkend waren voor een authentieke tibia. Onze eerste hypothese was dat de fenotypes na RNAi afhankelijk zouden kunnen zijn van de amputatieplaats in de tibia. Echter, zelfs wanneer een been in het distale deel van het femur wordt geamputeerd, ontstaat een extra tibia-achtig segment. De patroonvorming langs de antero-posterior en dorso-ventrale assen bleef onveranderd, behalve langs de PD-as. Vervolgens onderzochten we of de amputatieplaats langs de PD-as in de tibia van invloed was op de fenotypische ernst. De extra-tibia die gevormd werd, werd langer naarmate de amputatieplaatsen op de tibia proximaal waren (Figuur 1). Omgekeerd resulteerde RNAi tegen Utx in het verlies van gewrichtsvorming tussen tarsomeer 1 (Ta1) en Ta2 (figuur 2). 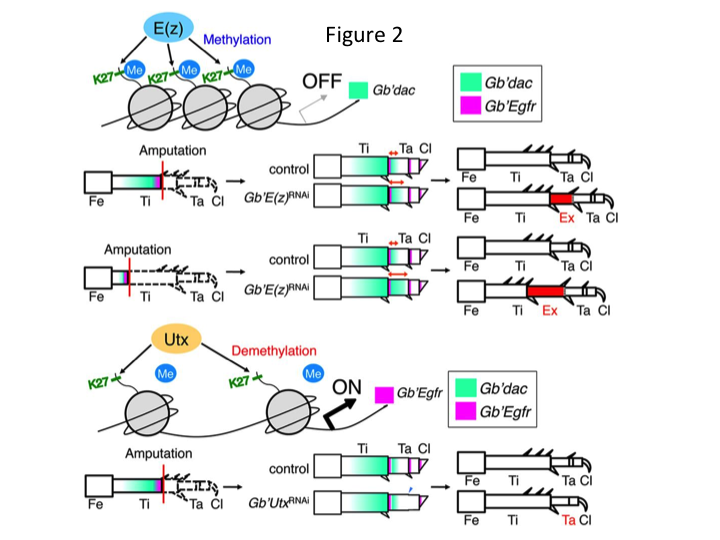 In situ hybridisatie toonde aan dat de expressie van been patroon genen veranderd langs de PD-as. In het bijzonder, het domein van teckel (dac) expressie uitgebreid in E (z) RNAi regenererende benen, terwijl Egfr expressie verminderde in UtxRNAi benen. Daarom kan E(z) dac-expressie onderdrukken tijdens normale beenregeneratie, terwijl Utx Egfr-expressie induceert.
In situ hybridisatie toonde aan dat de expressie van been patroon genen veranderd langs de PD-as. In het bijzonder, het domein van teckel (dac) expressie uitgebreid in E (z) RNAi regenererende benen, terwijl Egfr expressie verminderde in UtxRNAi benen. Daarom kan E(z) dac-expressie onderdrukken tijdens normale beenregeneratie, terwijl Utx Egfr-expressie induceert.
dac codeert voor een transcriptionele co-repressor die is gecategoriseerd in beenkloofgenen. dac produceert ruwe positiewaarden langs de PD-as van het been en bemiddelt de vorming van de distale tibia en Ta1 (de proximale tarsomeer) tijdens krekelbeenregeneratie (dac-expressiedomein wordt in groen weergegeven in figuur 2) (Ishimaru et al., 2015). Specifiek, dac bevordert tibiale cel proliferatie. Daarom, omdat RNAi tegen E(z) dac upreguleert, kan E(z) expressie in de blastemacellen de blastemale overproliferatie onderdrukken door extra dac expressie te onderdrukken.
Deze informatie roept de vraag op hoe E(z) specifiek dac expressie reguleert. Bovendien, wat is het mechanisme dat de doelgenen van E(z) bepaalt? E(z) behoort tot het Polycomb repressief complex 2 (PRC2), dat één van de drie Polycomb groep (PcG) complexen is (Schuettengruber et al., 2007). Tijdens de krekelembryogenese onderdrukt E(z) de voorste expansie van Hox-genexpressie en zorgt het voor de juiste identiteit in embryo’s (Matsuoka et al., 2015). Deze informatie wijst erop dat de doelgenen van E(z) verschillen afhankelijk van de cellulaire context. Een DNA-bindend eiwit, Pleiohomeotic (Pho), bindt zich samen met andere factoren aan de Polycomb response elements (PRE) van doelgenen, waarna E(z) histon H3K27 trimethyleert. Hoewel PREs alleen in Drosophila zijn geïdentificeerd, heeft de meta-analyse van vermoedelijke doelgenen voor PcG eiwitten aangetoond dat veel van de doelgenen gemeenschappelijk zijn voor de vlieg, de muis, en de mens. dac en Egfr zijn opgenomen onder deze genen (Schuettengruber et al., 2007). Zo is de regulerende regio van de krekel dac gen bevat waarschijnlijk PREs, waardoor E (z) epigenetisch reguleert de expressie van dac tijdens krekel been regeneratie (figuur 2). Lopend onderzoek is gericht op het karakteriseren van de functies van het Pho-gen en andere PcG-complex genen en epigenetische modifiers tijdens de regeneratie van de Grylluspoot.
Ten slotte, waarom veroorzaakt E(z) RNAi de vorming van extra-tibia? Een hypothetisch scenario is dat wanneer de tibia wordt geamputeerd op de proximale positie waar dac expressie laag is, Utx expressie (die E (z) expressie domineert) dac expressie mogelijk maakt (figuur 3a) om de tibia te herstellen. 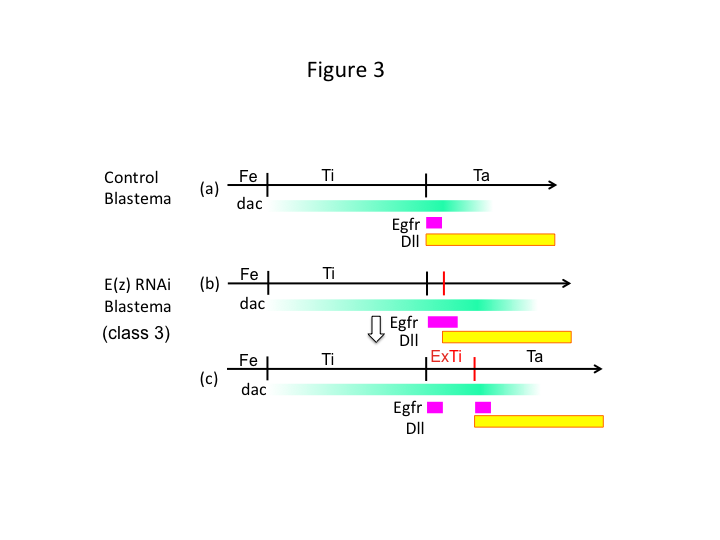 Dus, deze histon modifiers voelen de positionele waarden langs de PD-as van de amputatie site, en fine-tunen van het expressieniveau van been patroon genen, zoals dac. In het geval van E (z) RNAi vlak voor proximale amputatie, is intense dac expressie geïnduceerd en breidt zich uit in de regenererende been (Figuur 3b). Distale-minder (Dll) expressie, dat is een ander been kloof gen dat de distale domein van het been (Angelini en Kaufman, 2005) specificeert, kan meer distaal verschuiven, afhankelijk van uitgebreide dac expressie (figuur 3b). Zo kan de Egfr-expressie domein worden gescheiden in twee delen waar (1) Dll expressie is laag en (2) Dll is hoog. De extra-tibia vormt zich waarschijnlijk tussen de twee verschillende Egfr-expresserende domeinen door intercalerende celproliferatie en patroonvorming (figuur 3c).
Dus, deze histon modifiers voelen de positionele waarden langs de PD-as van de amputatie site, en fine-tunen van het expressieniveau van been patroon genen, zoals dac. In het geval van E (z) RNAi vlak voor proximale amputatie, is intense dac expressie geïnduceerd en breidt zich uit in de regenererende been (Figuur 3b). Distale-minder (Dll) expressie, dat is een ander been kloof gen dat de distale domein van het been (Angelini en Kaufman, 2005) specificeert, kan meer distaal verschuiven, afhankelijk van uitgebreide dac expressie (figuur 3b). Zo kan de Egfr-expressie domein worden gescheiden in twee delen waar (1) Dll expressie is laag en (2) Dll is hoog. De extra-tibia vormt zich waarschijnlijk tussen de twee verschillende Egfr-expresserende domeinen door intercalerende celproliferatie en patroonvorming (figuur 3c).
Ons doel is het ophelderen van blauwdrukken voor “het maken van een geregenereerd been” met behulp van deze aantrekkelijke hemimetabolous insect model. De blauwdrukken zullen naar verwachting duidelijk maken hoe het aantal beensegmenten wordt bepaald. Onze opvallende waarnemingen van RNAi tegen E(z) die leidt tot “extra tibia vorming” vormen een belangrijke stap in de opheldering van dit proces.
- Mito, T. and Noji, S. (2008). De tweepuntige krekel Gryllus bimaculatus: Een opkomend model voor ontwikkelings- en regeneratiestudies. Cold Spring Harb Protoc, 331-346.
- Umesono, Y., Tasaki, J., Nishimura, Y., Hrouda, M., Kawaguchi, E., Yazawa, S., Nishimura, O., Hosoda, K., Inoue, T. and Agata, K. (2013). De moleculaire logica voor planarian regeneratie langs de anterior-posterior as. Nature 500, 73-76.
- Endo, T., Bryant, S. V. and Gardiner, D. M. (2004). Een stapsgewijs modelsysteem voor regeneratie van ledematen. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. and Bryant, S. V. (1976). Patroonregulatie in epimorfe velden. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, T., Ohuchi, H., Noji, S. and Mito, T. (2013). Analyse van RNA-Seq data onthult betrokkenheid van JAK/STAT signalering tijdens beenregeneratie bij de krekel Gryllus bimaculatus. Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. and Ohuchi, H. (2015). Beenregeneratie wordt epigenetisch gereguleerd door histon H3K27 methylering in de krekel Gryllus bimaculatus. Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. and Mito, T. (2015). Betrokkenheid van dachshund en Distal-less bij distale patroonvorming van de krekelpoot tijdens regeneratie. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. and Cavalli, G. (2007). Genoomregulatie door polycomb en trithorax eiwitten. Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. and Mito, T. (2015). Korte kiem insecten maken gebruik van zowel de voorouderlijke als afgeleide modus van Polycomb groep-gemedieerde epigenetische silencing van Hox genen. Biol Open 4, 702-709.
- Angelini,R. and Kaufman, T. C. (2005). Insect appendages and comparative ontogenetics. Dev Biol 286, 57-77.
Share
- Issue:*
- Your Name:*
- Your Email:*
- Details:*
Indienen verslag
 (1 stemmen)
(1 stemmen)
Tags: Chromatine en epigenetica, krekel, regeneratie
Categorieën: Onderzoek