A tücskök ősszel általában ciripelő éneket adnak elő a mérsékelt kelet-ázsiai Japánban. Bár az afrikai mezei tücsök, a Gryllus bimaculatus trópusi országokból származik, világszerte feltörekvő modellállatnak számít, mivel a nimfa alatt amputált lábakat képes regenerálni, és fejlődési módja (rövid csírasáv) miatt (Mito és Noji, 2008).
Az állatvilág számos élőlénye képes sérülés után visszanöveszteni testrészeiket. A visszanöveszthető testrészekre példa a kétéltűek lencséje és farka, a planáriák feje és a halak szíve. Ezzel szemben sokáig úgy vélték, hogy az ember nem képes az elvesztett testrészek visszanövesztésére, kivéve bizonyos szöveteket, köztük a felhámot, a májat és a petefészek felszínét az ovuláció után. Ezért fontos a regenerációs folyamatokban szerepet játszó molekuláris mechanizmusok feltárása olyan állati modellek segítségével, amelyek képesek testrészek regenerálására, hogy később a nem regenerálódó emberi szervekben és szövetekben is alkalmazhatók legyenek.
Az elmúlt két évben két különböző regenerációs képességű planáriafaj összehasonlító genomikai vizsgálatai során sikerült fejeket regenerálni a béta-katenin aktivitás csökkentésével az egyébként nem regenerálódó farokrészekből (Umesono et al., 2013). A végtagok helyreállítására képes gerincesek, köztük a gőték, békák és szalamandrák vizsgálatai azt mutatták, hogy a végtagok regenerációja lépcsőzetes módon történik. A végtagregeneráció folyamata legalább három fázisra osztható: sebgyógyulás, dedifferenciálódás és újraképződés, az újraképződési fázis az embrionális fejlődést utánozza (Endo et al., 2004).
A tücsökláb hat szegmensből áll, amelyek a proximo-distális (PD) tengely mentén helyezkednek el: coxa, trochanter, femur, tibia, tarsus és karom (1. ábra). 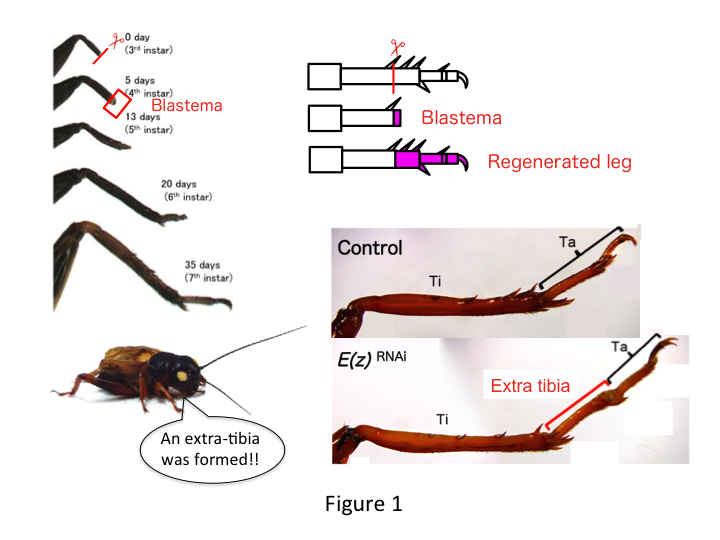 A tarsus tovább tagolódik három tarsomerre. Ha a harmadnapos nimfa sípcsontját amputálják, a láb regenerálódik, és a hatodik petefészekre (azaz az amputációt követő 20 napon belül) visszanyeri allometrikus méretét és megfelelő alakját, majdnem a normál felnőttkori méretét és alakját. Hamarosan a gyógyulás után az amputált láb disztális régiójában kialakul a blastema (a burjánzó sejtek halmaza). A blastema sejtek proliferálnak és interkaláris folyamatok révén képezik a hiányzó struktúrákat a legdisztálisabb régió és a láb megmaradt része között (French et al., 1976).
A tarsus tovább tagolódik három tarsomerre. Ha a harmadnapos nimfa sípcsontját amputálják, a láb regenerálódik, és a hatodik petefészekre (azaz az amputációt követő 20 napon belül) visszanyeri allometrikus méretét és megfelelő alakját, majdnem a normál felnőttkori méretét és alakját. Hamarosan a gyógyulás után az amputált láb disztális régiójában kialakul a blastema (a burjánzó sejtek halmaza). A blastema sejtek proliferálnak és interkaláris folyamatok révén képezik a hiányzó struktúrákat a legdisztálisabb régió és a láb megmaradt része között (French et al., 1976).
Már korábban összehasonlító transzkriptom-analízist végeztünk tücskök regenerálódó és normál amputált lábain, hogy a láb regenerációjával kapcsolatos mRNS-expressziót profilozzuk (Bando et al., 2013). Először az immunrendszerhez kapcsolódó Jak/Stat útvonal génjeinek felszabályozására összpontosítottunk. Az ezen útvonal génjeinek RNS-interferenciája (RNAi) alaposan megzavarta a láb regenerációját. Ezzel szemben a citokin jelátvitelt elnyomó Socs elleni RNSi a láb megnyúlását okozta. További kísérletek azt mutatták, hogy a Jak/Stat útvonal elősegíti a sejtproliferációt a Ds/Fat útvonal után.
Ezt követően megvizsgáltuk az epigenetikai szabályozást a tücsökláb regenerációja során. Tetsuya Bando, csoportunk vezető kutatója azonosított egy gént a hiszton H3 lizin 27 (H3K27) metiltranszferáz, E(z), és egy gént a hiszton H3K27 demetiláz, Utx, számára a G. bimaculatusban. A Gryllus gének klónozása ma már egyszerű folyamat a tücsök genomjáról rendelkezésre álló információknak köszönhetően (Mito és Noji, személyes közlés). A H3K27 hiszton E(z) általi metilálása a Polycomb-csoport fehérjéinek toborzása révén elnyomja a célgének expresszióját. Ezzel szemben a trimetilált H3K27 hiszton Utx általi demetilációja elősegíti a gének kifejeződését. Tetsuya azt találta, hogy mind az E(z), mind az Utx gének transzkripciója felszabályozott az amputált lábak blastema sejtjeiben (Bando és mtsai., 2013). In situ hibridizációval igazolták, hogy mindkét gén ubiquitikusan átíródik a tücskök regenerálódó lábaiban, és hogy mindkét gén kifejeződik a fejlődő embriókban (Hamada és mtsai., 2015). Yoshimasa Hamada (PhD-hallgató) által az RNSi után amputált apró lábakon végzett immunfestés megerősítette, hogy az E(z) és az Utx hozzájárul a metilációhoz és a demetilációhoz a hiszton H3K27me3-on, illetve a láb regenerációja során.
Mégis Yoshimasa váratlanul azt találta, hogy az E(z) elleni RNSi után extra lábszegmens képződik (1. ábra). Kezdetben nem tudtuk meghatározni a lábszegmens azonosságát. Morfológiailag a lábszegmens sípcsontnak tűnt, mivel olyan tüskékkel és sarkantyúkkal rendelkezett, amelyek egy autentikus sípcsontra jellemzőek. Nyitó hipotézisünk az volt, hogy az RNSi-t követő fenotípusok függhetnek a sípcsont amputációs helyétől. Azonban még akkor is, ha a combcsont disztális részén amputáljuk a lábat, extra tibia-szerű szegmens keletkezik. Az antero-posterior és dorso-ventrális tengely mentén a mintaképződés változatlan maradt, kivéve a PD tengely mentén. Ezután megvizsgáltuk, hogy a sípcsontban a PD tengely mentén az amputáció helye befolyásolja-e a fenotípusos súlyosságot. A kialakuló extra-tibia annál hosszabb lett, minél proximálisabbak voltak az amputációs helyek a sípcsonton (1. ábra). Ezzel szemben az Utx elleni RNAi a tarsomere 1 (Ta1) és Ta2 közötti ízületképződés elvesztését eredményezte (2. ábra). 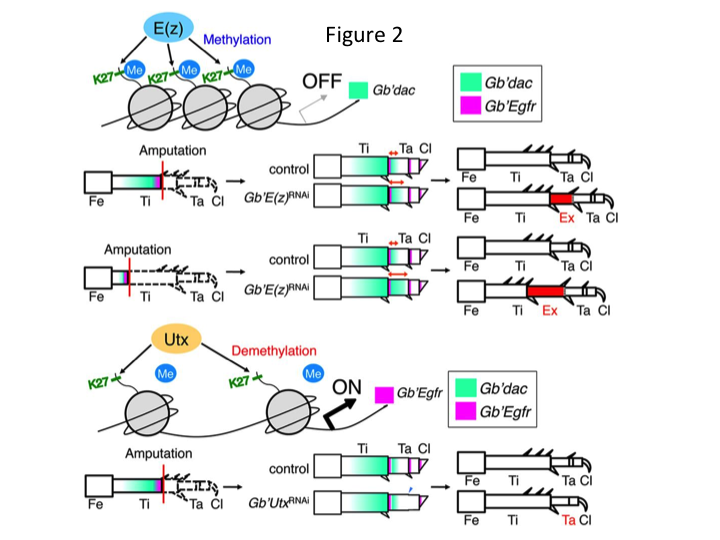 Az in situ hibridizáció kimutatta, hogy a lábak mintázását végző gének expressziója a PD tengely mentén változott. Konkrétan a dac (dac) expressziója bővült az E(z)RNAi regenerálódó lábakban, míg az Egfr expressziója csökkent az UtxRNAi lábakban. Ezért az E(z) elnyomhatja a dac expresszióját a normál lábregeneráció során, míg az Utx az Egfr expresszióját indukálja.
Az in situ hibridizáció kimutatta, hogy a lábak mintázását végző gének expressziója a PD tengely mentén változott. Konkrétan a dac (dac) expressziója bővült az E(z)RNAi regenerálódó lábakban, míg az Egfr expressziója csökkent az UtxRNAi lábakban. Ezért az E(z) elnyomhatja a dac expresszióját a normál lábregeneráció során, míg az Utx az Egfr expresszióját indukálja.
A dac egy transzkripciós ko-represszort kódol, amely a lábszakadás génekben kategorizálódik. dac a láb PD tengelye mentén nyers pozícióértékeket hoz létre, és közvetíti a distalis tibia és a Ta1 (a proximális tarsomere) kialakulását a tücsök láb regenerációja során (a 2. ábrán a dac expressziós doménje zölddel látható) (Ishimaru et al., 2015). Konkrétan a dac elősegíti a sípcsonti sejtek proliferációját. Ezért, mivel az E(z) elleni RNSi felszabályozza a dac-ot, az E(z) expressziója a blasztemasejtekben elnyomhatja a blasztemasejtek túlburjánzását az extra dac expresszió elnyomásával.
Ez az információ felveti a kérdést, hogy az E(z) hogyan szabályozza specifikusan a dac expresszióját. Továbbá, milyen mechanizmus határozza meg az E(z) célgénjeit? Az E(z) a Polycomb represszív komplex 2 (PRC2) tagja, amely egyike a három Polycomb-csoport (PcG) komplexnek (Schuettengruber és mtsai., 2007). A tücsök embriogenezis során az E(z) elnyomja a Hox-gének expressziójának elülső terjeszkedését és biztosítja az embriók megfelelő identitását (Matsuoka et al., 2015). Ezek az információk arra utalnak, hogy az E(z) célgénjei a sejtes kontextustól függően különböznek. Egy DNS-kötő fehérje, a pleiohomeotikus (Pho) más faktorokkal együtt kötődik a célgének Polycomb válaszelemeihez (PRE), ami után az E(z) trimetilálja a H3K27 hisztont. Bár a PRE-ket csak Drosophilában azonosították, a PcG-fehérjék feltételezett célgénjeinek meta-analízise kimutatta, hogy a célgének közül sok közös a légyben, az egérben és az emberben. a dac és az Egfr ezek között a gének között szerepel (Schuettengruber et al., 2007). Így a tücsök dac génjének szabályozó régiója valószínűleg PRE-ket tartalmaz, amelyeken keresztül az E(z) epigenetikusan szabályozza a dac expresszióját a tücsökláb regenerációja során (2. ábra). A folyamatban lévő kutatások a Pho gén és más PcG komplex gének és epigenetikai módosítók funkcióinak jellemzésére összpontosítanak a Gryllus láb regenerációja során.
Végezetül, miért okoz az E(z) RNSi extra-tibia képződést? Az egyik hipotetikus forgatókönyv szerint, amikor a sípcsontot a proximális pozícióban amputálják, ahol a dac expresszió alacsony, az Utx expresszió (amely dominál az E(z) expresszió felett) lehetővé teszi a dac expressziót (3a. ábra) a sípcsont helyreállításához. 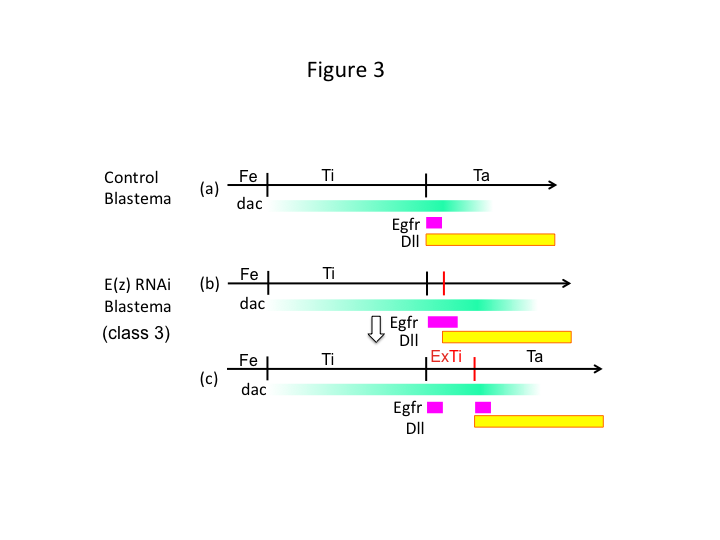 Ezek a hiszton-módosítók tehát érzékelik az amputációs hely PD tengelye mentén elhelyezkedő pozícióértékeket, és finomhangolják a lábak mintázását végző gének, például a dac expressziós szintjét. Az E(z) RNSi esetében közvetlenül a proximális amputáció előtt intenzív dac-expresszió indukálódik és kiterjed a regenerálódó lábban (3b. ábra). A distal-less (Dll) expresszió, amely egy másik lábszakasz-gén, amely a láb disztális tartományát specifikálja (Angelini és Kaufman, 2005), a kiterjedt dac expresszió függvényében distalisabban eltolódhat (3b. ábra). Így az Egfr-expresszáló domén két részre osztható, ahol (1) a Dll expresszió alacsony és (2) a Dll expresszió magas. Az extra-tibia valószínűleg a két különböző Egfr-expresszáló domén között alakul ki az interkalációs sejtproliferáció és a mintázódás révén (3c. ábra).
Ezek a hiszton-módosítók tehát érzékelik az amputációs hely PD tengelye mentén elhelyezkedő pozícióértékeket, és finomhangolják a lábak mintázását végző gének, például a dac expressziós szintjét. Az E(z) RNSi esetében közvetlenül a proximális amputáció előtt intenzív dac-expresszió indukálódik és kiterjed a regenerálódó lábban (3b. ábra). A distal-less (Dll) expresszió, amely egy másik lábszakasz-gén, amely a láb disztális tartományát specifikálja (Angelini és Kaufman, 2005), a kiterjedt dac expresszió függvényében distalisabban eltolódhat (3b. ábra). Így az Egfr-expresszáló domén két részre osztható, ahol (1) a Dll expresszió alacsony és (2) a Dll expresszió magas. Az extra-tibia valószínűleg a két különböző Egfr-expresszáló domén között alakul ki az interkalációs sejtproliferáció és a mintázódás révén (3c. ábra).
A célunk, hogy e vonzó hemimetabolikus rovarmodell segítségével tisztázzuk a “regenerált láb készítésének” tervrajzait. A tervrajzoktól azt várjuk, hogy tisztázzák, hogyan határozzák meg a lábszegmensek számát. Az E(z) elleni RNSi-vel kapcsolatos feltűnő megfigyeléseink, amelyek “extra sípcsontképzéshez” vezetnek, fontos lépést jelentenek e folyamat felderítése felé.
- Mito, T. és Noji, S. (2008). A kétpettyes tücsök Gryllus bimaculatus: An emerging Model for Developmental and Regeneration Studies. Cold Spring Harb Protoc, 331-346.
- Umesono, Y., Tasaki, J., Nishimura, Y., Hrouda, M., Kawaguchi, E., Yazawa, S., Nishimura, O., Hosoda, K., Inoue, T. és Agata, K. (2013). A planáriák regenerációjának molekuláris logikája az elülső-hátsó tengely mentén. Nature 500, 73-76.
- Endo, T., Bryant, S. V. és Gardiner, D. M. (2004). A végtagregeneráció lépésenkénti modellrendszere. Dev Biol 270, 135-145.
- French, V., Bryant, P. J. és Bryant, S. V. (1976). Mintaszabályozás epimorf mezőkben. Science 193, 969-981.
- Bando, T., Ishimaru, Y., Kida, T., Hamada, Y., Matsuoka, Y., Nakamura, T., Ohuchi, H., Noji, S. és Mito, T. (2013). Az RNA-Seq adatok elemzése feltárja a JAK/STAT jelátvitel részvételét a láb regenerációja során a Gryllus bimaculatus tücsökben. Development 140, 959-964.
- Hamada, Y., Bando, T., Nakamura, T., Ishimaru, Y., Mito, T., Noji, S., Tomioka, K. and Ohuchi, H. (2015). A lábregenerációt epigenetikusan szabályozza a hiszton H3K27 metiláció a Gryllus bimaculatus tücsökben. Development 142, 2916-2927.
- Ishimaru, Y., Nakamura, T., Bando, T., Matsuoka, Y., Ohuchi, H., Noji, S. és Mito, T. (2015). A dachshund és a Distal-less részvétele a tücsökláb disztális mintázatának kialakulásában a regeneráció során. Sci Rep 5, 8387.
- Schuettengruber, B., Chourrout, D., Vervoort, M., Leblanc, B. és Cavalli, G. (2007). Genomszabályozás a polycomb és trithorax fehérjék által. Cell 128, 735-745.
- Matsuoka, Y., Bando, T., Watanabe, T., Ishimaru, Y., Noji, S., Popadić, A. és Mito, T. (2015). A rövid csírájú rovarok a Hox-gének Polycomb-csoport által közvetített epigenetikus csendesítésének ősi és származékos módját egyaránt használják. Biol Open 4, 702-709.
- Angelini,R. és Kaufman, T. C. (2005). Rovar függelékek és összehasonlító ontogenetika. Dev Biol 286, 57-77.
Share
- Issue:*
- Your Name:*
- Your Email: Kategóriák: Kromatin és epigenetika, tücsök, regeneráció
Kategóriák: Kromatin és epigenetika, tücsök, regeneráció: Kutatás
kategóriák: Kutatás