Deixe-nos considerar alguns dos factores que fazem tanta química centrar-se num único elemento, o carbono. Uma característica muito importante é que as ligações carbono-carbono são fortes, pelo que são possíveis longas cadeias ou anéis de átomos de carbono ligados uns aos outros. Diamante e grafite são dois exemplos familiares, sendo a malha diamantífera uma rede tridimensional de átomos de carbono, enquanto a grafite na verdade se assemelha mais a uma rede planar. As propriedades lubrificantes da grafite na verdade estão relacionadas à sua estrutura, o que permite que os planos deslizem um por cima do outro.

Mas o carbono não é único na formação de ligações a si mesmo porque outros elementos como o boro, o silício e o fósforo formam fortes ligações no estado elementar. A singularidade do carbono deriva mais do fato de que ele forma fortes ligações carbono-carbono que também são fortes quando em combinação com outros elementos. Por exemplo, a combinação de hidrogênio com carbono proporciona uma notável variedade de hidretos de carbono, ou hidrocarbonetos, como eles geralmente são chamados. Em contraste, nenhum dos outros elementos de segunda linha, exceto o boro, proporciona um sistema muito extenso de hidretos estáveis, e a maioria dos hidretos de boro é muito mais reativa do que os hidrocarbonetos, especialmente à água e ao ar.
O carbono forma ligações não só consigo mesmo e com o hidrogénio, mas também com muitos outros elementos, incluindo elementos fortemente atraentes para os electrões, como o flúor e metais fortemente electropositivos, como o lítio:
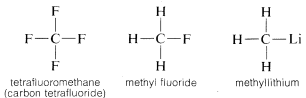
Por que é que o carbono é tão versátil na sua capacidade de se ligar a tipos muito diferentes de elementos? As propriedades especiais do carbono podem ser atribuídas ao fato de ser um átomo relativamente pequeno com quatro valências elétricas. Para formar compostos simples semelhantes ao sal como o cloreto de sódio, (Na^oplus Cl^ominus), o carbono teria que perder os quatro elétrons de valência para um elemento como o flúor e ser convertido em um íon quadripositivo, (C^4oplus), ou adquirir quatro elétrons de um elemento como o lítio e formar um íon quadripositivo, (C^4ominus). O ganho de quatro elétrons seria energeticamente muito desfavorável por causa da repulsão mútua entre os elétrons.
Customaticamente, o carbono completa o seu octeto de valência-shell compartilhando elétrons com outros átomos. Em compostos com ligações elétricas compartilhadas (ou ligações covalentes) como metano, etano ou tetrafluorometano, cada um dos átomos ligados, incluindo o carbono, tem sua casca de valência preenchida, como mostrado nas seguintes estruturas de pares de elétrons ou Lewis
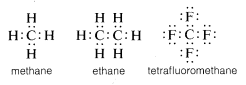
Desta forma, as repulsões entre electrões associadas ao preenchimento da casca de valência do carbono são compensadas pelas potências atractivas dos núcleos de carga positiva dos átomos aos quais o carbono está ligado.
No entanto, os electrões de uma ligação covalente não são necessariamente partilhados igualmente pelos átomos ligados, especialmente quando as afinidades dos átomos para os electrões são muito diferentes. Assim, as ligações carbono-fluorina e carbono-lítio, embora não sejam iônicas, são polarizadas de tal forma que os elétrons estão mais associados ao átomo de maior afinidade dos elétrons. Este é normalmente o átomo com maior carga nuclear efectiva.
(sobre o elta {\delta \oplus}{C} \: \: \: \: \: : \…sobre o Deltaominus… \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \…sobre o Deltaominus… \: \: \: \: \: \…e o Deltaplus… \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \…à esquerda..: \deltaominus: \texto: “Denotem laços iónicos parciais”. \Certo)
Vemos então uma gradação de ligação puramente iónica para puramente covalente em diferentes moléculas, e isto é manifestado nas suas propriedades químicas e físicas. Considere, por exemplo, os hidretos dos elementos da segunda linha horizontal da tabela periódica. Os seus pontos de fusão e ebulição, onde são conhecidos, são dados abaixo.
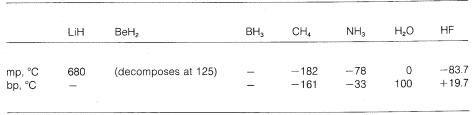
Hidreto de lítio pode ser considerado como um composto iónico salino, (mais do que isso): : : : mais do que isso. Atrações eletrostáticas entre íons com carga oposta na malha de cristal são fortes, fazendo com que o hidreto de lítio seja um sólido de alta fusão, não volátil como o cloreto de sódio, fluoreto de lítio, e assim por diante.
Methane, { CH_4}, está no outro extremo. Ele ferve a 161º/texto, que é cerca de 800º/texto mais baixo do que o ponto de fusão do hidreto de lítio. Como o carbono e o hidrogénio têm aproximadamente o mesmo poder de atracção de electrões, as ligações C-H têm pouco carácter iónico, e o metano pode ser caracterizado como uma substância não-polar. Como resultado, há relativamente pouca atracção electrostática entre as moléculas de metano e isto permite-lhes “escapar” mais facilmente umas das outras como moléculas gasosas – daí o baixo ponto de ebulição.
Flúoruro de hidrogénio tem um ponto de ebulição um pouco mais alto do que o do metano. O par de electrões de ligação do HF é mais atraído para o flúor do que para o hidrogénio, por isso a ligação pode ser formulada como um superdelta mais. —- —-. No fluoreto de hidrogênio líquido, as moléculas tendem a se agregar através do que é chamado de ligação de hidrogênio em cadeias e anéis dispostos de forma que o hidrogênio positivo em uma molécula atrai um flúor negativo na seguinte:
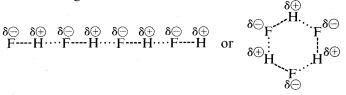
Quando o fluoreto de hidrogênio líquido é vaporizado, a temperatura deve ser elevada o suficiente para superar essas atrações eletrostáticas intermoleculares; portanto, o ponto de ebulição é alto comparado ao metano líquido. O fluoreto de hidrogênio é melhor caracterizado como uma substância polar, mas não iônica. Embora as ligações de água e amônia tenham um pouco menos de caráter iônico do que as ligações de fluoreto de hidrogênio, estas substâncias também são relativamente polares na natureza e também se associam através da ligação de hidrogênio da mesma forma que o flúor de hidrogênio.
As propriedades químicas do hidreto de lítio, metano e fluoreto de hidrogênio estão de acordo com as formulações acima. Assim, quando a ligação com o hidrogênio é quebrada, podemos esperar que ela se rompa no sentido de que o hidrogênio se rompa (begin/array) (c:c) Li^oplus & :H^ominus/end{array}) para o hidreto de lítio, e \e o Delta mais… & :: Definido para o fluoreto de hidrogénio para que o par de electrões vá com o átomo de maior afinidade dos electrões. Este é de facto o caso como a seguinte reacção indica:
(begin{array}{c:c} Li^\oplus & :H^\oominus ^end{array} + H & :underset :end{cdot {cdot }ddot{F} :end{array} Como seria de esperar, os cátions metílicos (CH_3^oplus) e os ânions metílicos (CH_3:^ominus) são muito difíceis de gerar e são extremamente reactivos. Por este motivo, as seguintes reacções não são observadas:

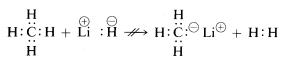
>
Do que precede, pode antecipar que a química dos compostos de carbono será em grande parte a química dos compostos covalentes e não se assemelhará de todo à química dos sais inorgânicos como o cloreto de sódio. Você também pode prever que as principais diferenças nas propriedades químicas e físicas dos compostos orgânicos surgirão a partir da natureza dos outros elementos ligados ao carbono. Assim, não se espera que o metano tenha, nem tem, a mesma química que outros compostos de um carbono como o metilithium (CH_3Li), ou fluoreto de metilo (CH_3F).
(^6\)G. N. Lewis (1876-1946), o renomado químico americano, foi o primeiro a compreender o significado do par de elétrons na estrutura molecular. Ele lançou as bases da teoria moderna da estrutura e da ligação em seu tratado sobre Valência e a Estrutura de Átomos e Moléculas (1923).
(7) Ao longo deste texto todas as temperaturas não designadas de outra forma devem ser entendidas como estando no texto (o) C; temperaturas absolutas serão mostradas como o texto (o) K).
Contribuidores e Atribuições
- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, segunda edição. W. A. Benjamin, Inc. (1977) , Menlo Park, CA. ISBN 0-8053-8329-8. Este conteúdo está protegido por direitos autorais sob as seguintes condições: “Você tem permissão para reprodução, distribuição, exibição e execução individual, educacional, de pesquisa e não-comercial deste trabalho em qualquer formato”