Låt oss fundera över några av de faktorer som gör att en så stor del av kemin är inriktad på ett enda grundämne, kol. En mycket viktig egenskap är att kol-kol-bindningarna är starka, så långa kedjor eller ringar av kolatomer som är bundna till varandra är möjliga. Diamant och grafit är två välkända exempel, där diamantgitteret är ett tredimensionellt nätverk av kolatomer, medan grafit faktiskt mer liknar ett plant nätverk. De smörjande egenskaperna hos grafit är faktiskt relaterade till dess struktur, som tillåter planerna att glida förbi varandra.

Men kol är inte unikt när det gäller att bilda bindningar till sig självt eftersom andra grundämnen som bor, kisel och fosfor bildar starka bindningar i elementärt tillstånd. Kolets unika karaktär beror snarare på att det bildar starka kol-kol-bindningar som också är starka när de kombineras med andra grundämnen. Till exempel ger kombinationen av väte och kol upphov till en anmärkningsvärd mängd kolhydrider, eller kolväten som de vanligtvis kallas. Däremot ger inget av de andra grundämnena på andra raden utom bor ett mycket omfattande system av stabila hydrider, och de flesta borhydriderna är mycket mer reaktiva än kolväten, särskilt i förhållande till vatten och luft.
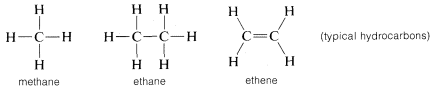
Kol bildar bindningar inte bara med sig själv och med väte utan också med många andra grundämnen, inklusive starkt elektrontilldragande grundämnen som fluor och starkt elektropositiva metaller som litium:
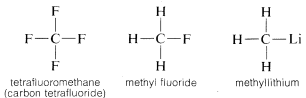
Varför är kolet så mångsidigt när det gäller förmågan att binda till mycket olika slags grundämnen? Kolets speciella egenskaper kan tillskrivas att det är en relativt liten atom med fyra valenselektroner. För att bilda enkla saltliknande föreningar som natriumklorid, \(Na^\oplus Cl^\ominus\), måste kolet antingen förlora de fyra valenselektronerna till ett grundämne som fluor och omvandlas till en fyrpositiv jon, \(C^{4 \oplus}\), eller förvärva fyra elektroner från ett grundämne som litium och bilda en fyrrinegativ jon, \(C^{4 \ominus}\). Att få fyra elektroner skulle vara energimässigt mycket ogynnsamt på grund av den ömsesidiga repulsionen mellan elektronerna.
Sedvanligt sett kompletterar kol sin valensskaloktett genom att dela elektroner med andra atomer. I föreningar med delade elektronbindningar (eller kovalenta bindningar) som metan, etan eller tetrafluormetan har var och en av de bundna atomerna, inklusive kol, sitt valensskal fyllt, vilket visas i följande elektronpar- eller Lewis-strukturer\(^6\):
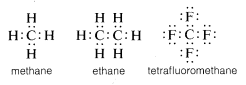
På detta sätt kompenseras repulsioner mellan elektroner i samband med att kolets valensskal fylls av de elektrontilldragande krafterna hos de positivt laddade atomkärnorna hos de atomer som kolet är bundet till.
Hur som helst delas elektronerna i en kovalent bindning inte nödvändigtvis lika mellan de bundna atomerna, särskilt när atomernas affinitet för elektroner är mycket olika. Sålunda är kol-fluor- och kol-litiumbindningar, även om de inte är joniska, polariserade så att elektronerna är mer associerade med den atom som har högre elektronaffinitet. Detta är vanligtvis den atom som har den högre effektiva kärnladdningen.
\(\overset{\delta \oplus}{C} \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{beteckna partiella joniska bindningar} \right)}\)
Vi ser alltså en gradering från rent joniska till rent kovalenta bindningar i olika molekyler, och detta manifesteras i deras kemiska och fysikaliska egenskaper. Tänk till exempel på hydriderna av grundämnena i den andra horisontella raden i det periodiska systemet. Deras smält- och kokpunkter,\(^7\) där de är kända, anges nedan.
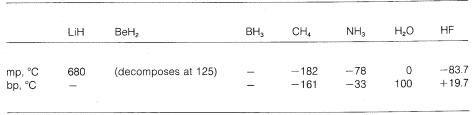
Lithiumhydrid kan betraktas som en saltliknande jonisk förening, \(\overset{\oplus}{Li} \: \: \: \: : \overset{\ominus}{H}\). De elektrostatiska attraktionerna mellan motsatt laddade joner i kristallgitteret är starka, vilket gör att litiumhydrid är ett högsmältande, icke-flyktigt fast ämne som natriumklorid, litiumfluorid och så vidare.
Metan, \(CH_4\), befinner sig i den andra extremen. Det kokar vid \(-161^\text{o}\), vilket är ungefär \(800^\text{o}\) lägre till och med än smältpunkten för litiumhydrid. Eftersom kol och väte har ungefär samma elektrontilldragningskraft har \(C-H\)-bindningar liten jonisk karaktär, och metan kan karakteriseras som ett opolärt ämne. Som ett resultat av detta finns det relativt lite elektrostatisk attraktion mellan metanmolekylerna, vilket gör att de lättare kan ”fly” från varandra som gasformiga molekyler – därav den låga kokpunkten.
Vätefluorid har en kokpunkt som är cirka \(200^\text{o}\) högre än metanens. Det bindande elektronparet i \(HF\) dras mer mot fluor än mot väte så bindningen kan formuleras som \(\overset{\delta \oplus}{H}\\) —- \(\overset{\delta \ominus}{F}\). I flytande vätefluorid tenderar molekylerna att aggregera genom vad som kallas vätebindning i kedjor och ringar som är arrangerade så att det positiva väte på en molekyl drar till sig ett negativt fluor på nästa:
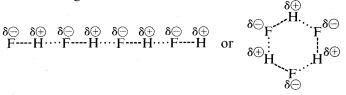
När flytande vätefluorid förångas måste temperaturen höjas tillräckligt för att övervinna dessa elektromolekylära elektrostatiska attraktioner; därför är kokpunkten hög jämfört med flytande metan. Vätefluorid karakteriseras bäst som ett polärt, men inte joniskt, ämne. Även om \(O-H\) och \(N-H\) bindningarna i vatten och ammoniak har något mindre jonisk karaktär än \(H-F\) bindningarna i vätefluorid, är dessa ämnen också relativt polära till sin natur och associeras också genom vätebindning på samma sätt som vätefluorid.
De kemiska egenskaperna hos litiumhydrid, metan och vätefluorid överensstämmer med ovanstående formuleringar. När bindningen till väte bryts kan vi således förvänta oss att den bryts i betydelsen \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) för litiumhydrid, och \(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) för vätefluorid så att elektronparet går till den atom som har högst elektronaffinitet. Detta är verkligen fallet, vilket följande reaktion visar:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Metan, med sina relativt opolära bindningar, är inert mot nästan alla reagenser som skulle kunna avlägsna väte som \(H^\oplus\) eller \(H:^\ominus\) utom under allt annat än extrema förhållanden. Som förväntat är metylkatjoner \(CH_3^\oplus\) och metylanjoner \(CH_3:^\ominus\) mycket svåra att generera och extremt reaktiva. Av denna anledning observeras inte följande reaktioner:

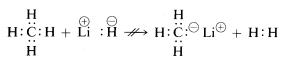
Från ovanstående kan du förutse att kemin hos kolföreningar till stor del kommer att vara kemin hos kovalenta föreningar och inte alls likna kemin hos oorganiska salter som t.ex. natriumklorid. Du kan också förvänta dig att de stora skillnaderna i kemiska och fysiska egenskaper hos organiska föreningar kommer att bero på arten av de andra grundämnena som är bundna till kol. Metan förväntas alltså inte ha samma kemi som andra föreningar med ett kol, t.ex. metyllitium, \(CH_3Li\), eller metylfluorid, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), den berömda amerikanska kemisten, var den förste som först insåg elektronparets betydelse för molekylstrukturen. Han lade grunden för den moderna teorin om struktur och bindning i sin avhandling Valence and the Structure of Atoms and Molecules (1923).
\(^7\)I hela denna text ska alla temperaturer som inte anges på annat sätt förstås som \(^\text{o}C\); absoluta temperaturer kommer att anges som \(^\text{o}K\).
Medarbetare och namn
- John D. Robert och Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, andra upplagan. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Detta innehåll är upphovsrättsligt skyddat enligt följande villkor: ”Du beviljas tillstånd för individuell, pedagogisk, forskningsmässig och icke-kommersiell reproduktion, distribution, visning och framförande av detta verk i vilket format som helst.”