Katsotaanpa joitakin tekijöitä, joiden vuoksi niin suuri osa kemiasta keskittyy yhteen alkuaineeseen, hiileen. Yksi hyvin tärkeä piirre on se, että hiilen ja hiilen väliset sidokset ovat vahvoja, joten pitkät ketjut tai renkaat toisiinsa sidottuja hiiliatomeja ovat mahdollisia. Timantti ja grafiitti ovat kaksi tuttua esimerkkiä, joista timanttiristikko on hiiliatomien kolmiulotteinen verkko, kun taas grafiitti muistuttaa itse asiassa enemmänkin tasomaista verkkoa. Grafiitin voiteluominaisuudet liittyvät itse asiassa sen rakenteeseen, joka sallii tasojen liukua toistensa ohi.

Mutta hiili ei ole ainoa, joka muodostaa sidoksia itseensä, sillä myös muut alkuaineet, kuten boori, pii ja fosfori, muodostavat alkeistilassa vahvoja sidoksia. Hiilen ainutlaatuisuus johtuu pikemminkin siitä, että se muodostaa vahvoja hiilen ja hiilen välisiä sidoksia, jotka ovat vahvoja myös yhdessä muiden alkuaineiden kanssa. Esimerkiksi vedyn ja hiilen yhdistelmästä saadaan huomattavan paljon erilaisia hiilihydridejä tai hiilivetyjä, kuten niitä yleensä kutsutaan. Sitä vastoin mikään muista toisen rivin alkuaineista paitsi boori ei muodosta kovin laajaa stabiilien hydridien järjestelmää, ja useimmat boorihydridit ovat paljon reaktiivisempia kuin hiilivedyt, erityisesti veden ja ilman suhteen.
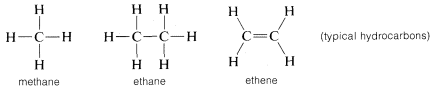
Hiili muodostaa sidoksia paitsi itsensä ja vedyn kanssa myös monien muiden alkuaineiden kanssa, mukaan lukien vahvasti elektroneja puoleensa vetävät alkuaineet, kuten fluori, ja vahvasti sähköpositiiviset metallit, kuten litium:
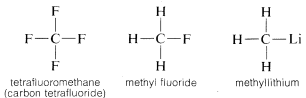
Miksi hiili kykenee niin monipuolisesti sitoutumaan hyvin erilaisiin alkuaineisiin? Hiilen erityisominaisuudet johtuvat siitä, että se on suhteellisen pieni atomi, jolla on neljä valenssielektronia. Muodostaakseen yksinkertaisia suolankaltaisia yhdisteitä, kuten natriumkloridia, \(Na^\oplus Cl^\ominus\), hiilen täytyisi joko menettää neljä valenssielektronia fluorin kaltaiselle alkuaineelle ja muuttua nelipositiiviseksi ioniksi, \(C^{4 \oplus}\), tai hankkia neljä elektronia litiumin kaltaiselta alkuaineelta muodostaen nelipositiivisen ionin, \(C^{4 \ominus}\). Neljän elektronin saaminen olisi energeettisesti hyvin epäedullista elektronien keskinäisen hylkimisen vuoksi.
Tavallisesti hiili täydentää valenssikuorensa kahdeksikon jakamalla elektroneja muiden atomien kanssa. Yhdisteissä, joissa on jaettuja elektronisidoksia (tai kovalenttisia sidoksia), kuten metaanissa, etaanissa tai tetrafluorimetaanissa, jokaisella sidoksissa olevalla atomilla, hiili mukaan lukien, on valenssikuori täynnä, kuten seuraavissa elektronipari- tai Lewis\(^6\)-rakenteissa näkyy:
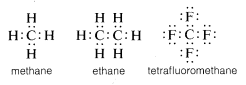
Tällä tavoin hiilen valenssikuoren täyttymiseen liittyvät elektronien väliset vastukset kompensoituvat niiden atomien positiivisesti varautuneiden ytimien, joihin hiili on sitoutunut, elektronien vetovoimalla.
Kovalenttisen sidoksen elektronit eivät kuitenkaan välttämättä jakaudu tasan sidottujen atomien kesken, varsinkaan silloin, kun atomien affiniteetit elektroneja kohtaan ovat hyvin erilaiset. Niinpä hiili-fluori- ja hiili-liitium-sidokset, vaikka ne eivät ole ionisia, ovat polarisoituneita siten, että elektronit liittyvät enemmän siihen atomiin, jolla on suurempi elektroniaffiniteetti. Tämä on yleensä atomi, jolla on korkeampi efektiivinen ydinvaraus.
\(\overset{\delta \oplus}{C}) \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \ overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{merkitse osittaiset ionisidokset} \right)}\)
Näemme siis eri molekyyleissä asteittaista vaihtelua puhtaasti ionisidoksista puhtaasti kovalenttisiin sidoksiin, ja tämä näkyy niiden kemiallisissa ja fysikaalisissa ominaisuuksissa. Tarkastellaan esimerkiksi jaksollisen järjestelmän toisella vaakarivillä olevien alkuaineiden hydridejä. Niiden sulamis- ja kiehumispisteet,\(^7\), jos ne ovat tiedossa, on annettu alla.
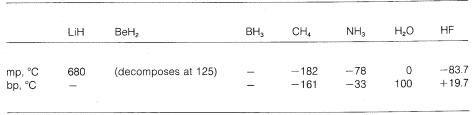
Lithiumhydridiä voidaan pitää suolankaltaisena ioniyhdisteenä, \(\overset{\oplus}{Li} \: \: \: \: \: : \overset{\ominus}{H}\). Vastakkaisesti varattujen ionien väliset sähköstaattiset vetovoimat kideristikossa ovat voimakkaat, jolloin litiumhydridi on natriumkloridin, litiumfluoridin ja niin edelleen kaltainen korkeasti sulava, haihtumaton kiinteä aine.
Toisessa ääripäässä on metaani, \(CH_4\). Se kiehuu \(-161^\text{o}\), mikä on noin \(800^\text{o}\) alempi jopa kuin litiumhydridin sulamispiste. Koska hiilen ja vedyn elektronien vetovoima on suunnilleen sama, \(C-H\)-sidoksilla on vähän ionista luonnetta, ja metaania voidaan luonnehtia poolittomaksi aineeksi. Tämän seurauksena metaanimolekyylien välillä on suhteellisen vähän sähköstaattista vetovoimaa, minkä ansiosta metaanimolekyylit ”karkaavat” helpommin toisistaan kaasumaisina molekyyleinä – tästä johtuu matala kiehumispiste.
Vetyfluoridin kiehumispiste on jonkin verran metaanin kiehumispistettä korkeampi. Sidoksen \(HF\) elektronipari vetää enemmän fluoriin kuin vetyyn, joten sidos voidaan muotoilla \(\overset{\delta \oplus}{H}\) —- \(\overset{\delta \ominus}{F}\). Nestemäisessä vetyfluoridissa molekyylit pyrkivät yhdistymään niin sanotun vetysidoksen avulla ketjuihin ja renkaisiin, jotka on järjestetty siten, että yhden molekyylin positiivinen vety vetää puoleensa seuraavan molekyylin negatiivista fluoria:
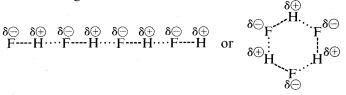
Kun nestemäistä vetyfluoridia höyrystetään, lämpötilaa on nostettava riittävästi, jotta nämä molekyylien väliset elektrostaattiset vetovoimat saadaan kumottua; siksi kiehumispiste on korkea verrattuna nestemäiseen metaaniin. Vetyfluoridia voidaan parhaiten luonnehtia polaariseksi, mutta ei ioniseksi aineeksi. Vaikka veden ja ammoniakin \(O-H\)- ja \(N-H\)-sidoksilla on jonkin verran vähemmän ionista luonnetta kuin fluorivedyn \(H-F\)-sidoksilla, myös nämä aineet ovat luonteeltaan suhteellisen polaarisia, ja ne assosioituvat myös vetysidosten kautta samalla tavalla kuin fluorivety.
Lithiumhydridin, metaanin ja fluorivedyn kemialliset ominaisuudet ovat edellä esitetyn mukaiset. Näin ollen, kun vetysidos katkeaa, voimme odottaa sen katkeavan merkityksessä \(\begin{array}{c:c} Li^\\oplus & :H^\ominus \end{array}\) litiumhydridin kohdalla ja \(\begin{array}{c:c}} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) vetyfluoridille siten, että elektronipari menee siihen atomiin, jolla on suurin elektroniaffiniteetti. Näin todellakin on, kuten seuraava reaktio osoittaa:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Metaani on suhteellisen poolittomine sidoksineen inertti lähes kaikille reagensseille, jotka voisivat poistaa vetyä \(H^\oplus\) tai \(H:^ ^\ominus\), paitsi missä tahansa muussa kuin äärimmäisissä olosuhteissa. Odotetusti metyylikationit \(CH_3^\oplus\) ja metyylianionit \(CH_3:^\ominus\) ovat hyvin vaikeita tuottaa ja erittäin reaktiivisia. Tästä syystä seuraavia reaktioita ei havaita:

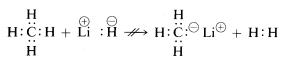
Edellisen perusteella voitte ennakoida, että hiiliyhdisteiden kemia on suurelta osin kovalenttisten yhdisteiden kemiaa eikä lainkaan muistuta epäorgaanisten suolojen, kuten natriumkloridin, kemiaa. Voit myös olettaa, että orgaanisten yhdisteiden kemiallisten ja fysikaalisten ominaisuuksien suuret erot johtuvat hiileen sitoutuneiden muiden alkuaineiden luonteesta. Näin ollen metaanin ei odoteta, eikä sillä ole samanlaista kemiaa kuin muilla yhden hiilen yhdisteillä, kuten metyylitiumilla, \(CH_3Li\), tai metyylifluoridilla, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), tunnettu yhdysvaltalainen kemisti, oivalsi ensimmäisenä elektroniparin merkityksen molekyylien rakenteessa. Hän loi perustan nykyaikaiselle rakenne- ja sidosteorialle teoksessaan Valenssi ja atomien ja molekyylien rakenne (1923).
\(^7\)Tässä tekstissä kaikki lämpötilat, joita ei ole toisin merkitty, on ymmärrettävä \(^(^\text{o}C\)-lämpötiloina; absoluuttiset lämpötilat ilmoitetaan \(^\text{o}K\)-lämpötiloina.
Tekijät ja nimitykset
- John D. Robert ja Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, toinen painos. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Tämä sisältö on tekijänoikeudellisesti suojattu seuraavin ehdoin: ”Teille myönnetään lupa tämän teoksen yksilölliseen, opetukselliseen, tutkimukselliseen ja ei-kaupalliseen kopiointiin, levittämiseen, näyttämiseen ja esittämiseen missä tahansa muodossa.”