Uvažujme o některých faktorech, díky nimž se velká část chemie soustředí na jediný prvek, uhlík. Jednou z velmi důležitých vlastností je, že vazby mezi uhlíkem a uhlíkem jsou pevné, takže je možné vytvářet dlouhé řetězce nebo prstence vzájemně vázaných atomů uhlíku. Diamant a grafit jsou dva známé příklady, přičemž diamantová mřížka je trojrozměrná síť atomů uhlíku, zatímco grafit se ve skutečnosti více podobá plošné síti. Mazací vlastnosti grafitu ve skutečnosti souvisejí s jeho strukturou, která umožňuje, aby se roviny posouvaly jedna vedle druhé.

Uhlík však není ve vytváření vazeb sám se sebou jedinečný, protože silné vazby v elementárním stavu vytvářejí i jiné prvky, například bór, křemík a fosfor. Jedinečnost uhlíku vyplývá spíše z toho, že tvoří silné vazby uhlík-uhlík, které jsou silné i v kombinaci s jinými prvky. Například kombinací vodíku s uhlíkem vzniká pozoruhodná řada hydridů uhlíku nebo uhlovodíků, jak se obvykle nazývají. Naproti tomu žádný z ostatních prvků druhé řady kromě bóru nedává příliš rozsáhlý systém stabilních hydridů a většina hydridů bóru je mnohem reaktivnější než uhlovodíky, zejména vůči vodě a vzduchu.
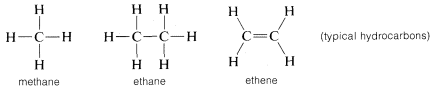
Uhlík tvoří vazby nejen sám se sebou a s vodíkem, ale také s mnoha dalšími prvky, včetně silně elektronově přitažlivých prvků, jako je fluor, a silně elektropozitivních kovů, jako je lithium:
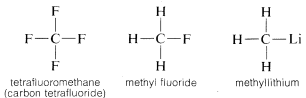
Proč je uhlík tak všestranný ve své schopnosti vázat se na velmi různé druhy prvků? Zvláštní vlastnosti uhlíku lze přičíst tomu, že se jedná o relativně malý atom se čtyřmi valenčními elektrony. Aby se vytvořily jednoduché sloučeniny podobné solím, jako je chlorid sodný, \(Na^\oplus Cl^\ominus\), musel by uhlík buď ztratit čtyři valenční elektrony ve prospěch prvku, jako je fluor, a přeměnit se na kvadripozitivní ion, \(C^{4 \oplus}\), nebo získat čtyři elektrony od prvku, jako je lithium, a vytvořit kvadrinegativní ion, \(C^{4 \ominus}\). Získání čtyř elektronů by bylo energeticky velmi nevýhodné kvůli vzájemnému odpuzování mezi elektrony.
Uhlík obvykle doplňuje svůj oktet valenčního obalu sdílením elektronů s jinými atomy. Ve sloučeninách se sdílenými elektronovými vazbami (nebo kovalentními vazbami), jako je metan, etan nebo tetrafluormetan, má každý z vázaných atomů včetně uhlíku zaplněnou valenční slupku, jak ukazují následující elektronové párové nebo Lewisovy\(^6\) struktury:
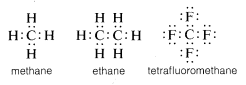
Takto jsou odpuzující síly mezi elektrony spojené s vyplněním valenční slupky uhlíku kompenzovány elektronově přitažlivými silami kladně nabitých jader atomů, k nimž je uhlík vázán.
Elektrony kovalentní vazby však nemusí být nutně sdíleny vázanými atomy rovnoměrně, zejména pokud jsou afinity atomů k elektronům velmi rozdílné. Proto jsou vazby uhlík-fluor a uhlík-lithium, přestože nejsou iontové, polarizovány tak, že elektrony jsou více spojeny s atomem s vyšší elektronovou afinitou. Obvykle je to atom s vyšším efektivním jaderným nábojem.
\(\overset{\delta \oplus}{C}) \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{označte částečné iontové vazby} \vpravo)}\)
V různých molekulách pak vidíme odstupňování od čistě iontové vazby k čistě kovalentní, což se projevuje v jejich chemických a fyzikálních vlastnostech. Vezměme si například hydridy prvků ve druhém vodorovném řádku periodické tabulky. Jejich teploty tání a varu,\(^7\) pokud jsou známy, jsou uvedeny níže.
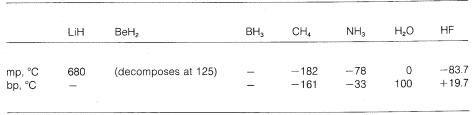
Hydrid lithia lze považovat za iontovou sloučeninu podobnou soli, \(\overset{\oplus}{Li} \: \: \: : \overset{\ominus}{H}). Elektrostatická přitažlivost mezi opačně nabitými ionty v krystalové mřížce je silná, což způsobuje, že hydrid lithný je vysoce tavná, netěkavá pevná látka jako chlorid sodný, fluorid lithný atd.
Metan, \(CH_4\), je na druhém konci. Jeho teplota varu je \(-161^\text{o}\), což je přibližně o \(800^\text{o}\) nižší dokonce než teplota tání hydridu lithného. Protože uhlík a vodík mají přibližně stejnou schopnost přitahovat elektrony, mají vazby \(C-H\) malý iontový charakter a metan lze charakterizovat jako nepolární látku. V důsledku toho je mezi molekulami methanu relativně malá elektrostatická přitažlivost, což jim umožňuje snadněji od sebe „unikat“ jako plynné molekuly – odtud nízký bod varu.
Fluorovodík má bod varu o \(200^\text{o}\) vyšší než methan. Vazbový elektronový pár \(HF\) je přitahován více k fluoru než k vodíku, takže vazbu lze formulovat jako \(\overset{\delta \oplus}{H}\) —- \(\overset{\delta \ominus}{F}\). V kapalném fluorovodíku mají molekuly tendenci agregovat se prostřednictvím tzv. vodíkové vazby do řetězců a kruhů uspořádaných tak, že kladný vodík na jedné molekule přitahuje záporný fluor na další:
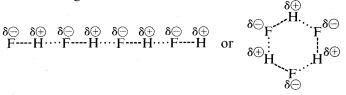
Při odpařování kapalného fluorovodíku musí být teplota dostatečně zvýšena, aby se překonaly tyto mezimolekulární elektrostatické přitažlivosti; proto je teplota varu ve srovnání s kapalným metanem vysoká. Fluorovodík je nejlépe charakterizován jako polární, nikoli však iontová látka. Ačkoli vazby \(O-H\) a \(N-H\) vody a amoniaku mají poněkud méně iontový charakter než vazby \(H-F\) fluorovodíku, jsou tyto látky také relativně polární a také se spojují vodíkovou vazbou stejným způsobem jako fluorovodík.
Chemické vlastnosti hydridu lithia, methanu a fluorovodíku jsou v souladu s výše uvedenými formulacemi. Když se tedy přeruší vazba na vodík, můžeme očekávat, že se přeruší ve smyslu \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) pro hydrid lithia a \(\begin{array}{c:c}) pro fluorid lithný. \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) pro fluorovodík tak, aby elektronový pár připadl atomu s nejvyšší elektronovou afinitou. To skutečně platí, jak ukazuje následující reakce:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Metan se svými relativně nepolárními vazbami je inertní vůči téměř všem činidlům, která by mohla odstranit vodík jako \(H^\oplus\) nebo \(H:^\ominus\), kromě extrémních podmínek. Jak se dalo očekávat, methylové kationty \(CH_3^\oplus\) a methylové anionty \(CH_3:^\ominus\) se vytvářejí velmi obtížně a jsou extrémně reaktivní. Z tohoto důvodu nejsou pozorovány následující reakce:

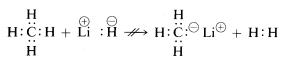
Z výše uvedeného můžete předpokládat, že chemie sloučenin uhlíku bude z velké části chemií kovalentních sloučenin a nebude se vůbec podobat chemii anorganických solí, jako je chlorid sodný. Můžete také předpokládat, že hlavní rozdíly v chemických a fyzikálních vlastnostech organických sloučenin budou vyplývat z povahy ostatních prvků vázaných na uhlík. Proto se neočekává, že metan bude mít a ani nemá stejnou chemii jako jiné jednouhlíkaté sloučeniny, jako je metyllit, \(CH_3Li\), nebo methylfluorid, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), významný americký chemik, jako první pochopil význam elektronového páru v molekulární struktuře. Ve svém pojednání Valence and the Structure of Atoms and Molecules (1923) položil základy moderní teorie struktury a vazby.
\(^7\)V celém textu je třeba všechny teploty, které nejsou označeny jinak, chápat jako teploty v \(^\text{o}C\); absolutní teploty budou uvedeny jako \(^\text{o}K\).
Přispěvatelé a atributy
- John D. Robert a Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, druhé vydání. W. A. Benjamin, Inc. , Menlo Park, Kalifornie. ISBN 0-8053-8329-8. Tento obsah je chráněn autorskými právy za následujících podmínek: „Je vám uděleno povolení k individuálnímu, vzdělávacímu, výzkumnému a nekomerčnímu rozmnožování, šíření, zobrazování a předvádění tohoto díla v jakémkoli formátu.“