Lad os overveje nogle af de faktorer, der gør, at så meget af kemien er centreret om et enkelt grundstof, nemlig kulstof. En meget vigtig egenskab er, at kulstof-kulstof-bindinger er stærke, så lange kæder eller ringe af kulstofatomer, der er bundet til hinanden, er mulige. Diamant og grafit er to velkendte eksempler, idet diamantgitteret er et tredimensionelt netværk af kulstofatomer, hvorimod grafit faktisk mere ligner et plant netværk. Grafittens smøreegenskaber hænger faktisk sammen med dens struktur, som gør det muligt for planerne at glide forbi hinanden.

Men kulstof er ikke enestående med hensyn til at danne bindinger til sig selv, fordi andre grundstoffer som bor, silicium og fosfor danner stærke bindinger i elementær tilstand. Kulstofs enestående egenskab stammer mere fra det faktum, at det danner stærke kulstof-kulstof-bindinger, som også er stærke, når de kombineres med andre grundstoffer. For eksempel giver kombinationen af hydrogen med kulstof en bemærkelsesværdig variation af kulhydrider, eller kulbrinter, som de normalt kaldes. Derimod giver ingen af de andre grundstoffer i anden række, undtagen bor, et meget omfattende system af stabile hydrider, og de fleste af borhydriderne er meget mere reaktive end kulbrinter, især over for vand og luft.
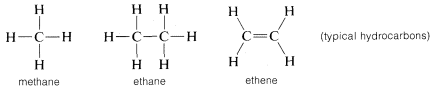
Kulstof danner bindinger ikke kun med sig selv og med brint, men også med mange andre grundstoffer, herunder stærkt elektrontiltrækkende grundstoffer som fluor og stærkt elektropositive metaller som lithium:
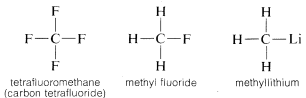
Hvorfor er kulstof så alsidigt i sin evne til at binde sig til meget forskellige slags grundstoffer? Kulstofs særlige egenskaber kan tilskrives, at det er et relativt lille atom med fire valenselektroner. For at danne simple saltlignende forbindelser som natriumklorid, \(Na^\oplus Cl^\ominus\), skulle kulstof enten miste de fire valenselektroner til et grundstof som fluor og blive omdannet til en quadripositiv ion, \(C^{4 \oplus}\), eller erhverve fire elektroner fra et grundstof som lithium og danne en quadrinegativ ion, \(C^{4 \ominus}\). Det ville være energimæssigt meget ugunstigt at få fire elektroner på grund af den gensidige frastødning mellem elektronerne.
Sædvanligvis fuldender kulstof sin valensskal-oktet ved at dele elektroner med andre atomer. I forbindelser med delte elektronbindinger (eller kovalente bindinger) som f.eks. methan, ethan eller tetrafluormethan har hvert af de bundne atomer, herunder kulstof, sin valensskal fyldt, som vist i de følgende elektronpar- eller Lewis-strukturer\(^6\):
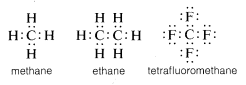
På denne måde kompenseres frastødninger mellem elektroner i forbindelse med udfyldelse af kulstoffets valensskal af de elektrontiltrækkende kræfter hos de positivt ladede atomkerner i de atomer, som kulstoffet er bundet til.
Derimod deles elektronerne i en kovalent binding ikke nødvendigvis ligeligt mellem de bundne atomer, især når atomernes affiniteter for elektroner er meget forskellige. Således er kulstof-fluor- og kulstof-lithium-bindinger, selv om de ikke er ioniske, polariseret således, at elektronerne er associeret mere med det atom, der har den højeste elektronaffinitet. Dette er normalt det atom med den højere effektive kerneladning.
\(\overset{\delta \oplus}{C} \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{angiv delvis ioniske bindinger} \right)}\)
Vi ser altså en graduering fra rent ioniske til rent kovalente bindinger i forskellige molekyler, og dette er tydeligt i deres kemiske og fysiske egenskaber. Tænk f.eks. på hydriderne af grundstofferne i den anden vandrette række i det periodiske system. Deres smelte- og kogepunkter,\(^7\) hvor de er kendt, er angivet nedenfor.
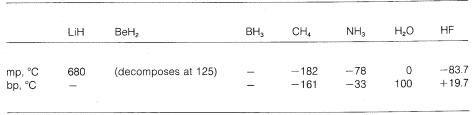
Lithiumhydrid kan betragtes som en saltlignende ionisk forbindelse, \(\overset{\oplus}{Li} \: \: \: \: : \overset{\ominus}{H}}\). De elektrostatiske tiltrækninger mellem modsat ladede ioner i krystalgitteret er stærke, hvilket bevirker, at lithiumhydrid er et højt smeltende, ikke-flygtigt fast stof ligesom natriumchlorid, lithiumfluorid osv.
Methan, \(CH_4\), er i den anden yderlighed. Det koger ved \(-161^\text{o}\), hvilket er omkring \(800^\text{o}\) lavere end selv smeltepunktet for lithiumhydrid. Da kulstof og brint har nogenlunde samme elektrontiltrækningskraft, har \(C-H\) bindinger kun ringe ionisk karakter, og methan kan karakteriseres som et upolært stof. Som følge heraf er der relativt lidt elektrostatisk tiltrækning mellem metanmolekylerne, og dette gør det muligt for dem at “slippe” lettere fra hinanden som gasformige molekyler – deraf det lave kogepunkt.
Hydrogenfluorid har et kogepunkt, der er ca. \(200^\text{o}\) højere end metanens. Det bindende elektronpar i \(HF\) er mere trukket mod fluor end mod hydrogen, så bindingen kan formuleres som \(\overset{\\delta \oplus}{H}}\) —- \(\overset{\delta \ominus}{F}}\). I flydende hydrogenfluorid har molekylerne en tendens til at aggregere gennem det, der kaldes hydrogenbinding i kæder og ringe, der er arrangeret således, at det positive hydrogen på et molekyle tiltrækker et negativt fluor på det næste:
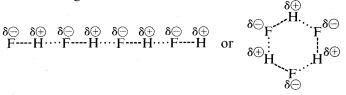
Når flydende hydrogenfluorid fordamper, skal temperaturen hæves tilstrækkeligt for at overvinde disse intermolekylære elektrostatiske tiltrækninger; derfor er kogepunktet højt sammenlignet med flydende metan. Hydrogenfluorid er bedst karakteriseret som et polært, men ikke ionisk, stof. Selv om \(O-H\) og \(N-H\) bindingerne i vand og ammoniak har noget mindre ionisk karakter end \(H-F\) bindingerne i hydrogenfluorid, er disse stoffer også relativt polære af natur og forbinder sig også gennem hydrogenbindinger på samme måde som hydrogenfluorid.
De kemiske egenskaber af lithiumhydrid, metan og hydrogenfluorid er i overensstemmelse med ovenstående formuleringer. Når bindingen til hydrogenet brydes, kan vi således forvente, at den brydes i betydningen \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) for lithiumhydrid, og \(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) for hydrogenfluorid, således at elektronparret går til det atom, der har den højeste elektronaffinitet. Dette er faktisk tilfældet, som den følgende reaktion viser:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Methan er med sine relativt upolære bindinger inert over for næsten alle reagenser, der kan fjerne brint som \(H^\oplus\) eller \(H:^\ominus\), undtagen under alt andet end ekstreme forhold. Som forventet er methylkationer \(CH_3^\oplus\) og methylanioner \(CH_3:^\ominus\) meget vanskelige at danne og ekstremt reaktive. Af denne grund observeres følgende reaktioner ikke:

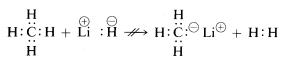
Fra ovenstående kan man forvente, at kemien af kulstofforbindelser i vid udstrækning vil være kemi af kovalente forbindelser og slet ikke vil ligne kemien af uorganiske salte som f.eks. natriumchlorid. Du kan også forvente, at de største forskelle i de kemiske og fysiske egenskaber ved organiske forbindelser vil skyldes arten af de andre grundstoffer, der er bundet til kulstof. Methan forventes således ikke at have den samme kemi som andre forbindelser med ét kulstof, f.eks. methyllithium, \(CH_3Li\), eller methylfluorid, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), den berømte amerikanske kemiker, var den første til at forstå elektronparrets betydning for den molekylære struktur. Han lagde grunden til den moderne teori om struktur og binding i sin afhandling om valens og atomers og molekylers struktur (1923).
(^7\)I hele denne tekst skal alle temperaturer, der ikke er angivet på anden måde, forstås som værende i \(^\text{o}C\); absolutte temperaturer vil blive vist som \(^\text{o}K\).
Medvirkende og bidragsydere
- John D. Robert og Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, anden udgave. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dette indhold er ophavsretligt beskyttet på følgende betingelser: “Der gives tilladelse til individuel, uddannelsesmæssig, forskningsmæssig og ikke-kommerciel reproduktion, distribution, visning og fremførelse af dette værk i ethvert format.”