Să luăm în considerare câțiva dintre factorii care fac ca o mare parte din chimie să fie centrată pe un singur element, carbonul. O caracteristică foarte importantă este faptul că legăturile carbon-carbon sunt puternice, astfel încât sunt posibile lanțuri sau inele lungi de atomi de carbon legați unul de altul. Diamantul și grafitul sunt două exemple familiare, rețeaua de diamant fiind o rețea tridimensională de atomi de carbon, în timp ce grafitul seamănă de fapt mai mult cu o rețea plană. Proprietățile lubrifiante ale grafitului sunt de fapt legate de structura sa, care permite planurilor să alunece unele pe lângă altele.

Dar carbonul nu este singurul care formează legături între el însuși, deoarece și alte elemente, cum ar fi borul, siliciul și fosforul, formează legături puternice în stare elementară. Unicitatea carbonului provine mai mult din faptul că formează legături puternice carbon-carbon care sunt puternice și atunci când sunt în combinație cu alte elemente. De exemplu, combinarea hidrogenului cu carbonul oferă o varietate remarcabilă de hidruri de carbon, sau hidrocarburi, așa cum sunt numite de obicei. În schimb, niciunul dintre celelalte elemente din al doilea rând, cu excepția borului, nu oferă un sistem foarte extins de hidruri stabile, iar cele mai multe dintre hidrurile de bor sunt mult mai reactive decât hidrocarburile, în special față de apă și aer.
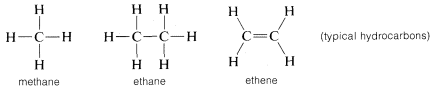
Carbonul formează legături nu numai cu el însuși și cu hidrogenul, ci și cu multe alte elemente, inclusiv cu elemente puternic atrăgătoare de electroni, cum ar fi fluorul, și cu metale puternic electropozitive, cum ar fi litiul:
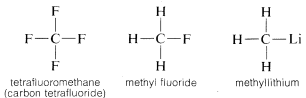
De ce este carbonul atât de versatil în capacitatea sa de a se lega de tipuri foarte diferite de elemente? Proprietățile speciale ale carbonului pot fi atribuite faptului că este un atom relativ mic, cu patru electroni de valență. Pentru a forma compuși simpli asemănători unei săruri, cum ar fi clorura de sodiu, \(Na^\oplus Cl^\ominus\\), carbonul ar trebui fie să piardă cei patru electroni de valență în favoarea unui element cum ar fi fluorul și să fie transformat într-un ion cvadripozitiv, \(C^{4 \oplus}\), fie să dobândească patru electroni de la un element cum ar fi litiul și să formeze un ion cvadrinegativ, \(C^{4 \ominus}\). Câștigarea a patru electroni ar fi foarte nefavorabilă din punct de vedere energetic din cauza repulsiei reciproce dintre electroni.
În mod obișnuit, carbonul își completează octetul de valență prin împărțirea electronilor cu alți atomi. În compușii cu legături electronice partajate (sau legături covalente), cum ar fi metanul, etanul sau tetrafluorometanul, fiecare dintre atomii legați, inclusiv carbonul, are cochilia de valență completată, așa cum se arată în următoarele structuri cu perechi de electroni sau Lewis\(^6\):
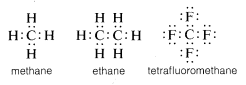
În acest fel, respingerile dintre electroni asociate cu completarea învelișului de valență al carbonului sunt compensate de puterea de atragere a electronilor de către nucleele încărcate pozitiv ale atomilor de care este legat carbonul.
Cu toate acestea, electronii unei legături covalente nu sunt neapărat împărțiți în mod egal de către atomii legați, mai ales atunci când afinitățile atomilor pentru electroni sunt foarte diferite. Astfel, legăturile carbon-fluor și carbon-litiu, deși nu sunt ionice, sunt polarizate astfel încât electronii sunt asociați mai mult cu atomul cu afinitate electronică mai mare. Acesta este, de obicei, atomul cu sarcina nucleară efectivă mai mare.
\(\overset{\delta \oplus}{C} \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{semnează legături ionice parțiale} \right)}\)
Vezi deci o gradație de la legături pur ionice la legături pur covalente în diferite molecule, iar acest lucru se manifestă în proprietățile lor chimice și fizice. Luați în considerare, de exemplu, hidrurile elementelor din al doilea rând orizontal al tabelului periodic. Punctele lor de topire și de fierbere,\(^7\) atunci când sunt cunoscute, sunt date mai jos.
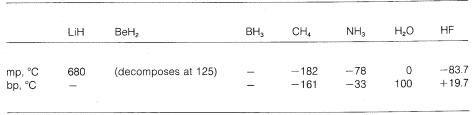
Hidrida de litiu poate fi privită ca un compus ionic asemănător unei săruri, \(\overset{\oplus}{Li} \: \: \: : \overset{\ominus}{H}\). Atracțiile electrostatice dintre ionii cu sarcini opuse din rețeaua cristalină sunt puternice, ceea ce face ca hidrura de litiu să fie un solid cu punct de topire ridicat, nevolatil, ca și clorura de sodiu, fluorura de litiu și așa mai departe.
Metanul, \(CH_4\), se află la cealaltă extremă. Acesta fierbe la \(-161^\text{o}\\, ceea ce este cu aproximativ \(800^\text{o}\) mai mic chiar și decât punctul de topire al hidrurii de litiu. Deoarece carbonul și hidrogenul au aproximativ aceeași putere de atragere a electronilor, legăturile \(C-H\\) au un caracter puțin ionic, iar metanul poate fi caracterizat ca o substanță nepolară. Ca urmare, există relativ puțină atracție electrostatică între moleculele de metan, ceea ce le permite să „evadeze” mai ușor una de cealaltă ca molecule gazoase – de aici și punctul de fierbere scăzut.
Fluorura de hidrogen are un punct de fierbere cu aproximativ \(200^^\text{o}\) mai mare decât cel al metanului. Perechea de electroni de legătură a \(HF\) este atrasă mai mult spre fluor decât spre hidrogen, astfel încât legătura poate fi formulată ca \(\overset{\delta \oplus}{H}\) —- \(\overset{\delta \ominus}{F}\). În fluorura de hidrogen lichidă, moleculele au tendința de a se agrega prin ceea ce se numește legătură de hidrogen în lanțuri și inele dispuse astfel încât hidrogenul pozitiv de pe o moleculă să atragă un fluor negativ de pe următoarea:
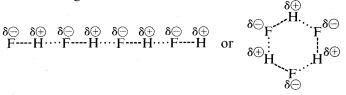
Când fluorura de hidrogen lichidă este vaporizată, temperatura trebuie să fie suficient de ridicată pentru a depăși aceste atracții electrostatice intermoleculare; de aceea punctul de fierbere este ridicat în comparație cu metanul lichid. Fluorura de hidrogen este cel mai bine caracterizată ca fiind o substanță polară, dar nu ionică. Deși legăturile \(O-H\) și \(N-H\) ale apei și amoniacului au un caracter oarecum mai puțin ionic decât legăturile \(H-F\) ale fluorurii de hidrogen, aceste substanțe sunt, de asemenea, de natură relativ polară și se asociază prin legături de hidrogen în același mod ca și fluorura de hidrogen.
Proprietățile chimice ale hidrurii de litiu, metanului și fluorurii de hidrogen sunt în concordanță cu formulările de mai sus. Astfel, atunci când legătura cu hidrogenul este ruptă, ne-am putea aștepta ca aceasta să se rupă în sensul \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) pentru hidrură de litiu, și \(\begin{array}{c:c}} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) pentru fluorura de hidrogen, astfel încât perechea de electroni să meargă cu atomul cu cea mai mare afinitate electronică. Acesta este într-adevăr cazul, după cum indică următoarea reacție:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Metanul, cu legăturile sale relativ nepolare, este inert față de aproape toți reactivii care ar putea elimina hidrogenul sub formă de \(H^\oplus\) sau \(H:^\ominus\), cu excepția unor condiții extreme. Așa cum era de așteptat, cationii de metil \(CH_3^\oplus\) și anionii de metil \(CH_3:^\ominus\) sunt foarte greu de generat și sunt extrem de reactivi. Din acest motiv, următoarele reacții nu sunt observate:

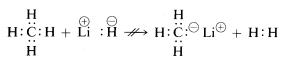
Din cele de mai sus puteți anticipa că chimia compușilor de carbon va fi în mare parte chimia compușilor covalenți și nu va semăna deloc cu chimia sărurilor anorganice, cum ar fi clorura de sodiu. De asemenea, puteți anticipa că diferențele majore în ceea ce privește proprietățile chimice și fizice ale compușilor organici vor rezulta din natura celorlalte elemente legate de carbon. Astfel, nu este de așteptat ca metanul să aibă și nici nu are aceeași chimie ca alți compuși cu un singur carbon, cum ar fi metillitiul, \(CH_3Li\), sau fluorura de metil, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), renumitul chimist american, a fost primul care a înțeles semnificația perechii de electroni în structura moleculară. El a pus bazele teoriei moderne a structurii și legăturii în tratatul său intitulat Valence and the Structure of Atoms and Molecules (1923).
\(^7\)În tot acest text, toate temperaturile care nu sunt desemnate altfel trebuie să se înțeleagă ca fiind în \(^\text{o}C\); temperaturile absolute vor fi indicate ca \(^\text{o}K\).
Contribuții și atribuții
- John D. Robert și Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, ediția a doua. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Acest conținut este protejat prin drepturi de autor în următoarele condiții: „Vi se acordă permisiunea pentru reproducerea, distribuirea, afișarea și interpretarea individuală, educațională, de cercetare și necomercială a acestei lucrări în orice format.”
.