Rozważmy niektóre z czynników, które sprawiają, że tak wiele z chemii centrum na jednym elemencie, węgla. Jedną z bardzo ważnych cech jest to, że węgiel-węgiel wiązania są silne, więc długie łańcuchy lub pierścienie atomów węgla związanych ze sobą są możliwe. Diament i grafit są dwoma znanymi przykładami, siatka diamentowa jest trójwymiarową siecią atomów węgla, podczas gdy grafit w rzeczywistości bardziej przypomina sieć planarną. Właściwości smarujące grafitu są w rzeczywistości związane z jego strukturą, która pozwala płaszczyznom przesuwać się jedna za drugą.

Ale węgiel nie jest wyjątkowy w tworzeniu wiązań z samym sobą, ponieważ inne elementy, takie jak bor, krzem i fosfor tworzą silne wiązania w stanie elementarnym. Unikalność węgla wynika bardziej z faktu, że tworzy silne wiązania węgiel-węgiel, które są również silne, gdy w połączeniu z innymi elementami. Na przykład, połączenie wodoru z węglem daje niezwykłą różnorodność wodorków węgla, lub węglowodorów, jak zwykle są nazywane. Natomiast żaden z pozostałych pierwiastków drugiego rzędu, z wyjątkiem boru, nie daje bardzo rozbudowanego systemu stabilnych wodorków, a większość wodorków boru jest znacznie bardziej reaktywna niż węglowodory, zwłaszcza w stosunku do wody i powietrza.
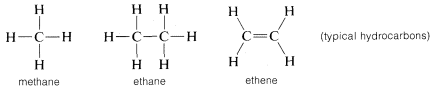
Węgiel tworzy wiązania nie tylko z samym sobą i z wodorem, ale także z wieloma innymi pierwiastkami, w tym z pierwiastkami silnie przyciągającymi elektrony, takimi jak fluor i silnie elektroujemnymi metalami, takimi jak lit:
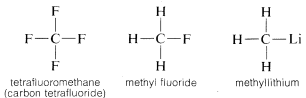
Dlaczego węgiel jest tak wszechstronny w swojej zdolności do łączenia się z bardzo różnymi rodzajami pierwiastków? Szczególne właściwości węgla można przypisać temu, że jest on stosunkowo małym atomem z czterema elektronami walencyjnymi. Aby utworzyć proste związki podobne do soli, takie jak chlorek sodu, węgiel musiałby albo stracić cztery elektrony walencyjne na rzecz pierwiastka takiego jak fluor i przekształcić się w jon czterododatni, albo pozyskać cztery elektrony od pierwiastka takiego jak lit i utworzyć jon czterododatni, C^{4 ^oplus}}. Zyskanie czterech elektronów byłoby energetycznie bardzo niekorzystne z powodu wzajemnego odpychania między elektronami.
Zwyczajowo, węgiel uzupełnia swój oktet powłoki walencyjnej dzieląc elektrony z innymi atomami. W związkach z dzielonymi wiązaniami elektronowymi (lub wiązaniami kowalencyjnymi), takich jak metan, etan lub tetrafluorometan, każdy z połączonych atomów, w tym węgiel, ma wypełnioną swoją powłokę walencyjną, jak pokazano w następujących strukturach pary elektronowej lub Lewisa:
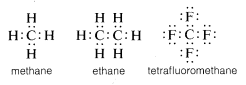
W ten sposób odpychania między elektronami związane z wypełnieniem powłoki walencyjnej węgla są kompensowane przez siły przyciągania elektronów przez dodatnio naładowane jądra atomów, z którymi węgiel jest związany.
Jednakże, elektrony wiązania kowalencyjnego niekoniecznie są dzielone równo przez związane atomy, zwłaszcza gdy powinowactwa atomów do elektronów są bardzo różne. Tak więc, wiązania węgiel-fluor i węgiel-lit, chociaż nie są jonowe, są spolaryzowane tak, że elektrony są związane bardziej z atomem o wyższym powinowactwie elektronowym. Zwykle jest to atom o wyższym efektywnym ładunku jądrowym.
(\overset{delta \oplus}{C} \: \: \: \: \: : \overset{delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \\overset{\delta \ominus}{C:} \: \: \: \: \: \overset{delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{ \left( \delta \oplus, \: \delta \ominus \: \tekst {zaznaczyć częściowe wiązania jonowe} \Widzimy więc gradację od wiązania czysto jonowego do czysto kowalencyjnego w różnych cząsteczkach, co przejawia się w ich właściwościach chemicznych i fizycznych. Rozważmy, na przykład, wodorki pierwiastków w drugim rzędzie poziomym układu okresowego. Ich temperatury topnienia i wrzenia, o ile są znane, podano poniżej.
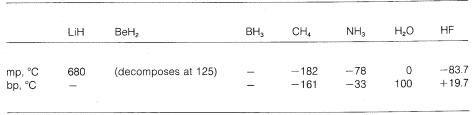
Wodorek litu może być uważany za związek jonowy podobny do soli, ‖(‖overset{oplus}{Li} ‖). Elektrostatyczne przyciąganie pomiędzy przeciwnie naładowanymi jonami w sieci krystalicznej jest silne, co powoduje, że wodorek litu jest wysokotopliwym, nielotnym ciałem stałym, takim jak chlorek sodu, fluorek litu, i tak dalej.
Metan, \(CH_4\), jest na drugim biegunie. Wrze on w temperaturze -161 ^text{o}}, która jest około ^800 ^text{o}} niższa nawet od temperatury topnienia wodorku litu. Ponieważ węgiel i wodór mają mniej więcej taką samą siłę przyciągania elektronów, wiązania C-H mają niewielki charakter jonowy, a metan można scharakteryzować jako substancję niepolarną. W rezultacie, istnieje stosunkowo niewielkie przyciąganie elektrostatyczne między cząsteczkami metanu, co pozwala im łatwiej „uciec” od siebie jako cząsteczki gazowe – stąd niska temperatura wrzenia.
Fluorowodór ma temperaturę wrzenia o około ‖ (200^text{o}}) wyższą niż metan. Wiążąca para elektronowa fluoru jest skierowana bardziej w stronę fluoru niż wodoru, więc wiązanie może być sformułowane jako \(\overset{delta \oplus}{H}}} —- \(\overset{delta \ominus}{F}}}. W ciekłym fluorowodorze cząsteczki mają tendencję do łączenia się w łańcuchy i pierścienie poprzez tzw. wiązanie wodorowe, tak że dodatni wodór na jednej cząsteczce przyciąga ujemny fluor na następnej:
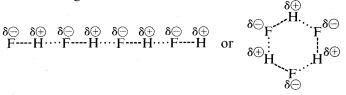
Gdy ciekły fluorowodór jest parowany, temperatura musi być wystarczająco podwyższona, aby pokonać te międzycząsteczkowe przyciąganie elektrostatyczne; stąd temperatura wrzenia jest wysoka w porównaniu z ciekłym metanem. Fluorowodór jest najlepiej scharakteryzowany jako substancja polarna, ale nie jonowa. Chociaż wiązania (O-H) i (N-H) wody i amoniaku mają nieco mniejszy charakter jonowy niż wiązania (H-F) fluorowodoru, substancje te są również stosunkowo polarne i łączą się poprzez wiązanie wodorowe w taki sam sposób jak fluorowodór.
Właściwości chemiczne wodorku litu, metanu i fluorowodoru są zgodne z powyższymi sformułowaniami. Tak więc, kiedy wiązanie z wodorem zostaje przerwane, możemy oczekiwać, że zostanie ono przerwane w sensie \(^begin{array}{c:c} Li^oplus & :H^ominus \end{array}) dla wodorku litu, i \(\begin{array}{c:c} \overset{delta \oplus}{H} & : ^underset{{dot}{F}}:^{delta \ominus} ^end{array}}) dla fluorowodoru tak, że para elektronowa trafia do atomu o najwyższym powinowactwie elektronowym. Tak rzeczywiście jest, na co wskazuje poniższa reakcja:
(^begin{array}{c:c} Li^oplus & :H^ominus ^end{array} + \begin{array}{c:c} H & : \underset{cdot}{\dot{F}} : \end{array} Jak można się spodziewać, kationy metylowe \(CH_3^^oplus\) i aniony metylowe \(CH_3:^ominus\) są bardzo trudne do wytworzenia i są niezwykle reaktywne. Z tego powodu nie obserwuje się następujących reakcji:

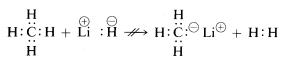
Z powyższego można przewidzieć, że chemia związków węgla będzie w dużej mierze chemią związków kowalencyjnych i nie będzie w ogóle przypominać chemii soli nieorganicznych, takich jak chlorek sodu. Można również przewidzieć, że główne różnice we właściwościach chemicznych i fizycznych związków organicznych będą wynikać z charakteru innych pierwiastków związanych z węglem. Tak więc metan nie powinien, ani nie ma, takiej samej chemii jak inne związki jednowęglowe, takie jak metylolit, \(CH_3Li\), lub fluorek metylu, \(CH_3F\).
G. N. Lewis (1876-1946), znany chemik amerykański, był pierwszym, który uchwycił znaczenie pary elektronowej w strukturze molekularnej. Położył on podwaliny pod nowoczesną teorię struktury i wiązania w swoim traktacie Valence and the Structure of Atoms and Molecules (1923).
W całym tekście wszystkie temperatury, które nie są oznaczone inaczej, powinny być rozumiane jako temperatury w ∗C; temperatury bezwzględne będą przedstawiane jako ∗K.
Contributors and Attributions
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Ta treść jest chroniona prawami autorskimi na następujących warunkach: „Udziela się zezwolenia na indywidualną, edukacyjną, badawczą i niekomercyjną reprodukcję, dystrybucję, wyświetlanie i wykonywanie tej pracy w dowolnym formacie.”
.