Prenons en considération certains des facteurs qui font qu’une si grande partie de la chimie est centrée sur un seul élément, le carbone. Une caractéristique très importante est que les liaisons carbone-carbone sont fortes, de sorte que de longues chaînes ou anneaux d’atomes de carbone liés les uns aux autres sont possibles. Le diamant et le graphite sont deux exemples familiers, le réseau du diamant étant un réseau tridimensionnel d’atomes de carbone, alors que le graphite ressemble davantage à un réseau plan. Les propriétés lubrifiantes du graphite sont en fait liées à sa structure, qui permet aux plans de glisser les uns derrière les autres.

Mais le carbone n’est pas unique à former des liaisons avec lui-même car d’autres éléments comme le bore, le silicium et le phosphore forment des liaisons fortes à l’état élémentaire. Le caractère unique du carbone provient plutôt du fait qu’il forme des liaisons carbone-carbone fortes qui le sont également lorsqu’il est combiné à d’autres éléments. Par exemple, la combinaison de l’hydrogène avec le carbone donne une variété remarquable d’hydrures de carbone, ou d’hydrocarbures comme on les appelle habituellement. En revanche, aucun des autres éléments de deuxième rang, à l’exception du bore, ne donne un système très étendu d’hydrures stables, et la plupart des hydrures de bore sont beaucoup plus réactifs que les hydrocarbures, notamment vis-à-vis de l’eau et de l’air.
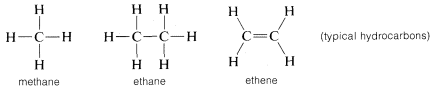
Le carbone forme des liaisons non seulement avec lui-même et avec l’hydrogène mais aussi avec de nombreux autres éléments, y compris des éléments fortement attracteurs d’électrons comme le fluor et des métaux fortement électropositifs comme le lithium :
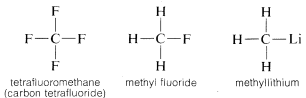
Pourquoi le carbone est-il si polyvalent dans sa capacité à se lier à des types d’éléments très différents ? Les propriétés particulières du carbone peuvent être attribuées au fait qu’il s’agit d’un atome relativement petit avec quatre électrons de valence. Pour former des composés simples ressemblant à des sels, tels que le chlorure de sodium, \(Na^\oplus Cl^\ominus\), le carbone doit soit perdre ses quatre électrons de valence au profit d’un élément tel que le fluor et se transformer en un ion quadripositif, \(C^{4 \oplus}\), soit acquérir quatre électrons d’un élément tel que le lithium et former un ion quadrinégatif, \(C^{4 \ominus}\). Le gain de quatre électrons serait énergétiquement très défavorable en raison de la répulsion mutuelle entre les électrons.
D’habitude, le carbone complète son octet de la coquille de valence en partageant des électrons avec d’autres atomes. Dans les composés avec des liaisons à électrons partagés (ou liaisons covalentes) comme le méthane, l’éthane ou le tétrafluorométhane, chacun des atomes liés, y compris le carbone, a sa coquille de valence remplie, comme le montrent les structures à paires d’électrons ou Lewis\(^6\) suivantes :
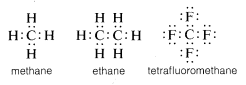
De cette façon, les répulsions entre électrons associées à l’achèvement de la coquille de valence du carbone sont compensées par les pouvoirs d’attraction des électrons des noyaux chargés positivement des atomes auxquels le carbone est lié.
Cependant, les électrons d’une liaison covalente ne sont pas nécessairement partagés de façon égale par les atomes liés, surtout lorsque les affinités des atomes pour les électrons sont très différentes. Ainsi, les liaisons carbone-fluor et carbone-lithium, bien qu’elles ne soient pas ioniques, sont polarisées de telle sorte que les électrons sont davantage associés à l’atome ayant la plus grande affinité électronique. Il s’agit généralement de l’atome dont la charge nucléaire effective est la plus élevée.
\(\overset{\delta \oplus}{C} \ : \ : \ : \ : \ : : \overset{\delta \ominus}{F} \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \overset{\c} \delta \ominus}{C:} \ : \ : \ : \ : \ : \overset{\delta \oplus}{Li} \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \ : \scriptsize{\c} gauche ( \delta \oplus, \ : \delta \ominus \ : \text{contre les liaisons ioniques partielles} \droite)}\)
Nous voyons donc une gradation de la liaison purement ionique à la liaison purement covalente dans différentes molécules, et cela se manifeste dans leurs propriétés chimiques et physiques. Considérons, par exemple, les hydrures des éléments de la deuxième ligne horizontale du tableau périodique. Leurs points de fusion et d’ébullition, \(^7\) lorsqu’ils sont connus, sont donnés ci-dessous.
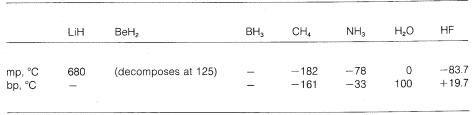
L’hydrure de lithium peut être considéré comme un composé ionique semblable à un sel, \(\overset{\oplus}{Li} \ : \ : \ : : \overset{\ominus}{H}\). Les attractions électrostatiques entre les ions de charge opposée dans le réseau cristallin sont fortes, ce qui fait que l’hydrure de lithium est un solide à haut point de fusion et non volatil comme le chlorure de sodium, le fluorure de lithium et ainsi de suite.
Le méthane, \(CH_4\), est à l’autre extrême. Il bout à \(-161^\text{o}\), ce qui est environ \(800^\text{o}\) inférieur même au point de fusion de l’hydrure de lithium. Le carbone et l’hydrogène ayant à peu près le même pouvoir d’attraction des électrons, les liaisons C-H ont peu de caractère ionique, et le méthane peut être considéré comme une substance non polaire. En conséquence, il y a relativement peu d’attraction électrostatique entre les molécules de méthane, ce qui leur permet de » s’échapper » plus facilement les unes des autres sous forme de molécules gazeuses – d’où le faible point d’ébullition.
Le fluorure d’hydrogène a un point d’ébullition quelque \(200^\text{o}\) plus élevé que celui du méthane. Le couple d’électrons de liaison du fluorure d’hydrogène est davantage attiré par le fluor que par l’hydrogène, de sorte que la liaison peut être formulée comme suit : \(\overset{\delta \oplus}{H}\) —- \(\overset{\delta \ominus}{F}\). Dans le fluorure d’hydrogène liquide, les molécules ont tendance à s’agréger par ce qu’on appelle la liaison hydrogène en chaînes et en anneaux disposés de telle sorte que l’hydrogène positif d’une molécule attire un fluor négatif sur la suivante :
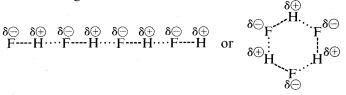
Lorsque le fluorure d’hydrogène liquide est vaporisé, la température doit être suffisamment élevée pour surmonter ces attractions électrostatiques intermoléculaires ; c’est pourquoi le point d’ébullition est élevé par rapport au méthane liquide. Le fluorure d’hydrogène est le mieux caractérisé comme une substance polaire, mais non ionique. Bien que les liaisons \(O-H\) et \(N-H\) de l’eau et de l’ammoniac aient un peu moins de caractère ionique que les liaisons \(H-F\) du fluorure d’hydrogène, ces substances sont également relativement polaires par nature et s’associent également par liaison hydrogène de la même manière que le fluorure d’hydrogène.
Les propriétés chimiques de l’hydrure de lithium, du méthane et du fluorure d’hydrogène sont en accord avec les formulations ci-dessus. Ainsi, lorsque la liaison avec l’hydrogène est rompue, on peut s’attendre à ce qu’elle se rompe dans le sens \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) pour l’hydrure de lithium, et \(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) pour le fluorure d’hydrogène afin que le doublet d’électrons aille avec l’atome de plus grande affinité électronique. C’est effectivement le cas comme l’indique la réaction suivante:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longueur-flèche Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \ : H : H\)
Le méthane, avec ses liaisons relativement non polaires, est inerte à presque tous les réactifs qui pourraient enlever l’hydrogène sous forme de \(H^\oplus\) ou \(H:^\us\) sauf dans des conditions extrêmes. Comme on pouvait s’y attendre, les cations méthyle \(CH_3^\oplus\) et les anions méthyle \(CH_3:^\ominus\) sont très difficiles à générer et sont extrêmement réactifs. Pour cette raison, les réactions suivantes ne sont pas observées :

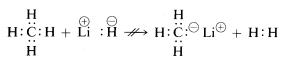
D’après ce qui précède, vous pouvez prévoir que la chimie des composés carbonés sera en grande partie la chimie des composés covalents et ne ressemblera pas du tout à la chimie des sels inorganiques tels que le chlorure de sodium. Vous pouvez également prévoir que les principales différences dans les propriétés chimiques et physiques des composés organiques découleront de la nature des autres éléments liés au carbone. Ainsi, le méthane ne devrait pas avoir, et n’a pas, la même chimie que d’autres composés à un seul carbone tels que le méthyllithium, \(CH_3Li\), ou le fluorure de méthyle, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), le célèbre chimiste américain, a été le premier à saisir l’importance de la paire d’électrons dans la structure moléculaire. Il a jeté les bases de la théorie moderne de la structure et de la liaison dans son traité intitulé Valence and the Structure of Atoms and Molecules (1923).
(^7\)Dans ce texte, toutes les températures qui ne sont pas indiquées autrement doivent être comprises comme étant en \(^\text{o}C\) ; les températures absolues seront indiquées en \(^\text{o}K\).
Contributeurs et attributions
- John D. Robert et Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, deuxième édition. W. A. Benjamin, Inc. Menlo Park, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes : » Vous êtes autorisé à reproduire, distribuer, afficher et exécuter cette œuvre à titre individuel, à des fins éducatives, de recherche et à des fins non commerciales, sous quelque format que ce soit. «