Betrachten wir einige der Faktoren, die dazu führen, dass sich ein Großteil der Chemie um ein einziges Element dreht, nämlich Kohlenstoff. Ein sehr wichtiges Merkmal ist, dass die Kohlenstoff-Kohlenstoff-Bindungen sehr stark sind, so dass lange Ketten oder Ringe aus miteinander verbundenen Kohlenstoffatomen möglich sind. Diamant und Graphit sind zwei bekannte Beispiele, wobei das Diamantgitter ein dreidimensionales Netzwerk aus Kohlenstoffatomen ist, während Graphit eher einem flächigen Netzwerk ähnelt. Die Schmiereigenschaften von Graphit hängen mit seiner Struktur zusammen, die es den Ebenen ermöglicht, aneinander vorbeizugleiten.

Kohlenstoff ist jedoch nicht der einzige Stoff, der mit sich selbst Bindungen eingeht, denn auch andere Elemente wie Bor, Silizium und Phosphor bilden im elementaren Zustand starke Bindungen. Die Einzigartigkeit des Kohlenstoffs ergibt sich vielmehr aus der Tatsache, dass er starke Kohlenstoff-Kohlenstoff-Bindungen bildet, die auch in Kombination mit anderen Elementen stark sind. Die Verbindung von Wasserstoff mit Kohlenstoff führt beispielsweise zu einer bemerkenswerten Vielfalt von Kohlenstoffhydriden, oder Kohlenwasserstoffen, wie sie üblicherweise genannt werden. Im Gegensatz dazu liefert keines der anderen Elemente der zweiten Reihe außer Bor ein sehr umfangreiches System stabiler Hydride, und die meisten Borhydride sind viel reaktiver als Kohlenwasserstoffe, insbesondere gegenüber Wasser und Luft.
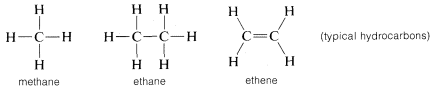
Kohlenstoff geht nicht nur mit sich selbst und mit Wasserstoff Bindungen ein, sondern auch mit vielen anderen Elementen, darunter stark elektronenanziehende Elemente wie Fluor und stark elektropositive Metalle wie Lithium:
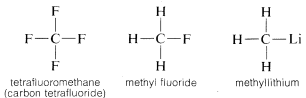
Warum ist Kohlenstoff so vielseitig in seiner Fähigkeit, sich mit sehr unterschiedlichen Arten von Elementen zu verbinden? Die besonderen Eigenschaften von Kohlenstoff lassen sich darauf zurückführen, dass er ein relativ kleines Atom mit vier Valenzelektronen ist. Um einfache salzartige Verbindungen wie Natriumchlorid, \(Na^\oplus Cl^\ominus\), zu bilden, müsste Kohlenstoff entweder die vier Valenzelektronen an ein Element wie Fluor verlieren und in ein quadripositives Ion, \(C^{4 \oplus}\), umgewandelt werden oder vier Elektronen von einem Element wie Lithium aufnehmen und ein quadripositives Ion, \(C^{4 \ominus}\), bilden. Die Aufnahme von vier Elektronen wäre aufgrund der gegenseitigen Abstoßung der Elektronen energetisch sehr ungünstig.
Normalerweise vervollständigt Kohlenstoff sein Valenzschalenoktett, indem er Elektronen mit anderen Atomen teilt. In Verbindungen mit geteilten Elektronenbindungen (oder kovalenten Bindungen) wie Methan, Ethan oder Tetrafluormethan hat jedes der gebundenen Atome, einschließlich Kohlenstoff, seine Valenzschale gefüllt, wie in den folgenden Elektronenpaar- oder Lewis\(^6\)-Strukturen gezeigt:
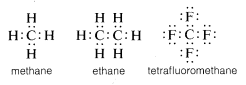
Auf diese Weise werden die Abstoßungen zwischen den Elektronen, die mit der Auffüllung der Valenzschale des Kohlenstoffs verbunden sind, durch die elektronenanziehenden Kräfte der positiv geladenen Kerne der Atome, an die der Kohlenstoff gebunden ist, ausgeglichen.
Die Elektronen einer kovalenten Bindung werden jedoch nicht notwendigerweise gleichmäßig von den gebundenen Atomen geteilt, insbesondere wenn die Affinitäten der Atome für Elektronen sehr unterschiedlich sind. So sind Kohlenstoff-Fluor- und Kohlenstoff-Lithium-Bindungen, obwohl sie nicht ionisch sind, so polarisiert, dass die Elektronen eher mit dem Atom mit der höheren Elektronenaffinität verbunden sind. Dies ist normalerweise das Atom mit der höheren effektiven Kernladung.
(\overset{\delta \oplus}{C} \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{denote partial ionic bonds} \right)}\)
Wir sehen also eine Abstufung von rein ionischen zu rein kovalenten Bindungen in verschiedenen Molekülen, und dies zeigt sich in ihren chemischen und physikalischen Eigenschaften. Betrachten wir zum Beispiel die Hydride der Elemente in der zweiten horizontalen Reihe des Periodensystems. Ihre Schmelz- und Siedepunkte,\(^7\) soweit bekannt, sind nachstehend angegeben.
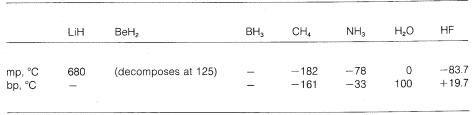
Lithiumhydrid kann als salzartige ionische Verbindung angesehen werden, \(\overset{\oplus}{Li} \: \: \: : \overset{\ominus}{H}\). Die elektrostatische Anziehungskraft zwischen entgegengesetzt geladenen Ionen im Kristallgitter ist stark, was dazu führt, dass Lithiumhydrid ein hochschmelzender, nicht flüchtiger Feststoff wie Natriumchlorid, Lithiumfluorid usw. ist.
Methan, \(CH_4\), liegt im anderen Extrem. Es siedet bei \(-161^\text{o}\), was sogar etwa \(800^\text{o}\) niedriger ist als der Schmelzpunkt von Lithiumhydrid. Da Kohlenstoff und Wasserstoff in etwa die gleiche Elektronenanziehungskraft besitzen, haben \(C-H\)-Bindungen kaum ionischen Charakter, und Methan kann als unpolare Substanz bezeichnet werden. Infolgedessen ist die elektrostatische Anziehungskraft zwischen den Methanmolekülen relativ gering, so dass sie als gasförmige Moleküle leichter voneinander „entweichen“ können – daher der niedrige Siedepunkt.
Fluorwasserstoff hat einen Siedepunkt, der einige \(200^\text{o}\) höher liegt als der von Methan. Das Bindungselektronenpaar von \(HF\) wird mehr zu Fluor als zu Wasserstoff gezogen, so dass die Bindung als \(\overset{\delta \oplus}{H}\) —- \(\overset{\delta \ominus}{F}\) formuliert werden kann. In flüssigem Fluorwasserstoff neigen die Moleküle dazu, sich durch so genannte Wasserstoffbrückenbindungen in Ketten und Ringen zusammenzuschließen, die so angeordnet sind, dass der positive Wasserstoff eines Moleküls das negative Fluor des nächsten anzieht:
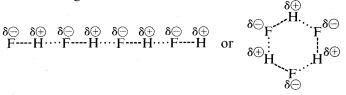
Wenn flüssiger Fluorwasserstoff verdampft, muss die Temperatur ausreichend erhöht werden, um diese intermolekularen elektrostatischen Anziehungen zu überwinden; daher ist der Siedepunkt im Vergleich zu flüssigem Methan hoch. Fluorwasserstoff lässt sich am besten als polare, aber nicht ionische Substanz charakterisieren. Obwohl die \(O-H\)- und \(N-H\)-Bindungen von Wasser und Ammoniak etwas weniger ionischen Charakter haben als die \(H-F\)-Bindungen von Fluorwasserstoff, sind auch diese Stoffe relativ polar und verbinden sich durch Wasserstoffbrückenbindungen auf die gleiche Weise wie Fluorwasserstoff.
Die chemischen Eigenschaften von Lithiumhydrid, Methan und Fluorwasserstoff stimmen mit den oben genannten Formulierungen überein. Wenn also die Bindung an den Wasserstoff gebrochen wird, könnte man erwarten, dass sie im Sinne von \(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) für Lithiumhydrid bricht, und \(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) für Fluorwasserstoff, so dass das Elektronenpaar zu dem Atom mit der höchsten Elektronenaffinität geht. Dies ist tatsächlich der Fall, wie die folgende Reaktion zeigt:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
Methan mit seinen relativ unpolaren Bindungen ist inert gegenüber fast allen Reagenzien, die Wasserstoff als \(H^\oplus\) oder \(H:^\ominus\) entfernen könnten, außer unter extremen Bedingungen. Wie zu erwarten, sind Methylkationen \(CH_3^\oplus\) und Methylanionen \(CH_3:^\ominus\) sehr schwer zu erzeugen und äußerst reaktiv. Aus diesem Grund werden die folgenden Reaktionen nicht beobachtet:

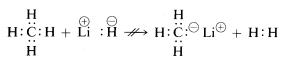
Aus dem oben Gesagten können Sie erahnen, dass die Chemie der Kohlenstoffverbindungen weitgehend die Chemie der kovalenten Verbindungen ist und überhaupt nicht der Chemie der anorganischen Salze wie Natriumchlorid ähneln wird. Sie können auch davon ausgehen, dass die größten Unterschiede in den chemischen und physikalischen Eigenschaften organischer Verbindungen auf die Art der anderen an Kohlenstoff gebundenen Elemente zurückzuführen sind. So ist nicht zu erwarten, dass Methan die gleiche Chemie hat wie andere Ein-Kohlenstoff-Verbindungen wie Methyllithium, \(CH_3Li\), oder Methylfluorid, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), der renommierte US-amerikanische Chemiker, war der erste, der die Bedeutung des Elektronenpaares in der Molekülstruktur erkannte. In seiner Abhandlung Valence and the Structure of Atoms and Molecules (1923) legte er den Grundstein für die moderne Struktur- und Bindungstheorie.
\(^7\)In diesem Text sind alle nicht anders bezeichneten Temperaturen in \(^\text{o}C\) angegeben; absolute Temperaturen werden als \(^\text{o}K\) angegeben.
Beiträger und Zuschreibungen
- John D. Robert und Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dieser Inhalt ist unter folgenden Bedingungen urheberrechtlich geschützt: „Sie erhalten die Erlaubnis zur individuellen, bildungsbezogenen, forschungsbezogenen und nicht kommerziellen Vervielfältigung, Verteilung, Anzeige und Aufführung dieses Werks in jedem Format.“