Laten we eens kijken naar enkele factoren die maken dat een groot deel van de chemie zich concentreert op één enkel element, koolstof. Een zeer belangrijk kenmerk is dat de koolstof-koolstofverbindingen sterk zijn, zodat lange ketens of ringen van aan elkaar gebonden koolstofatomen mogelijk zijn. Diamant en grafiet zijn twee bekende voorbeelden, waarbij het diamantrooster een driedimensionaal netwerk van koolstofatomen is, terwijl grafiet eigenlijk meer lijkt op een plat netwerk. De smerende eigenschappen van grafiet houden verband met de structuur, waardoor de vlakken langs elkaar kunnen schuiven.

Maar koolstof is niet uniek in het vormen van bindingen met zichzelf, omdat andere elementen zoals boor, silicium en fosfor sterke bindingen vormen in de elementaire toestand. Het unieke van koolstof komt meer voort uit het feit dat het sterke koolstof-koolstof bindingen vormt die ook sterk zijn in combinatie met andere elementen. Zo levert de combinatie van waterstof met koolstof een opmerkelijke verscheidenheid op van koolstofhydriden, of koolwaterstoffen zoals ze gewoonlijk worden genoemd. Daarentegen levert geen van de andere elementen van de tweede rij, behalve boor, een zeer uitgebreid systeem van stabiele hydriden op, en de meeste boriumhydriden zijn veel reactiever dan koolwaterstoffen, vooral tegenover water en lucht.
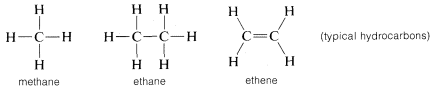
Koolstof vormt niet alleen bindingen met zichzelf en met waterstof, maar ook met vele andere elementen, waaronder sterk elektron-aantrekkende elementen zoals fluor en sterk elektropositieve metalen zoals lithium:
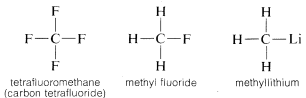
Waarom is koolstof zo veelzijdig in zijn vermogen om zich te binden aan zeer verschillende soorten elementen? De speciale eigenschappen van koolstof kunnen worden toegeschreven aan het feit dat het een relatief klein atoom is met vier valentie-elektronen. Om eenvoudige zoutachtige verbindingen te vormen, zoals natriumchloride, moet koolstof ofwel de vier valentie-elektronen verliezen aan een element zoals fluor en worden omgezet in een vier-positief ion, C^{4 \oplus}, of vier elektronen verwerven van een element zoals lithium en een vier-ernegatief ion vormen, C^{4 \ominus}. Het verkrijgen van vier elektronen zou energetisch zeer ongunstig zijn vanwege de onderlinge afstoting tussen de elektronen.
Normaal vervolledigt koolstof zijn valentieschaaloctet door elektronen te delen met andere atomen. In verbindingen met gedeelde elektronenbindingen (of covalente bindingen), zoals methaan, ethaan of tetrafluormethaan, heeft elk van de gebonden atomen, inclusief koolstof, zijn valentieschil gevuld, zoals te zien is in de volgende elektronenpaar- of Lewis(^6)-structuren:
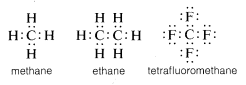
Op deze wijze worden de afstotingen tussen de elektronen die samenhangen met de voltooiing van de valentieschil van koolstof, gecompenseerd door de elektron-aantrekkende krachten van de positief geladen kernen van de atomen waaraan de koolstof is gebonden.
De elektronen van een covalente binding worden echter niet noodzakelijk gelijkelijk gedeeld door de gebonden atomen, vooral wanneer de affiniteiten van de atomen voor elektronen zeer verschillend zijn. Zo zijn de koolstof-fluor- en koolstof-lithiumverbindingen, hoewel zij niet ionisch zijn, zodanig gepolariseerd dat de elektronen meer geassocieerd zijn met het atoom met de hogere affiniteit voor elektronen. Dit is meestal het atoom met de hogere effectieve kernlading.
(\overset{\delta \oplus}{C} \: \: \: \: \: : \Overset {delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \Overset: delta:ominus \: \: \: \: \: \Overset \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \…links, links, links, links, links..: \…\delta \ominus..: \tekst: gedeeltelijke ionische bindingen. \We zien dan een gradatie van zuiver ionische tot zuiver covalente bindingen in verschillende moleculen, en dit komt tot uiting in hun chemische en fysische eigenschappen. Beschouw bijvoorbeeld de hydriden van de elementen in de tweede horizontale rij van het periodiek systeem. Hun smelt- en kookpunten, voor zover bekend, zijn hieronder gegeven.
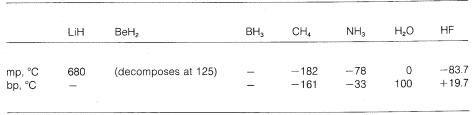
Lithiumhydride kan worden beschouwd als een zoutachtige ionische verbinding, \(\overset{\oplus}{Li} \: : \overset{\ominus}{H}\). De elektrostatische aantrekkingskracht tussen ionen met tegengestelde lading in het kristalrooster is sterk, waardoor lithiumhydride een goed smeltende, niet-vluchtige vaste stof is, zoals natriumchloride, lithiumfluoride, enzovoort.
Methaan, CH_4, bevindt zich in het andere uiterste. Het kookt bij -161, wat nog ongeveer 800 lager is dan het smeltpunt van lithiumhydride. Omdat koolstof en waterstof ongeveer dezelfde elektron-aantrekkende kracht hebben, hebben de C-H-bindingen weinig ionisch karakter en kan methaan worden gekarakteriseerd als een apolaire stof. Als gevolg daarvan is er relatief weinig elektrostatische aantrekkingskracht tussen methaanmoleculen, waardoor ze gemakkelijker als gasmoleculen aan elkaar kunnen “ontsnappen” – vandaar het lage kookpunt.
Waterstoffluoride heeft een kookpunt dat ongeveer 200 keer hoger ligt dan dat van methaan. Het bindende elektronenpaar van HF wordt meer naar fluor getrokken dan naar waterstof, zodat de binding kan worden geformuleerd als H —-. In vloeibaar waterstoffluoride hebben de moleculen de neiging zich te groeperen door wat men waterstofbinding noemt in ketens en ringen die zo zijn gerangschikt dat de positieve waterstof op het ene molecuul een negatieve fluor op het volgende molecuul aantrekt:
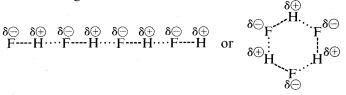
Wanneer vloeibaar waterstoffluoride wordt verdampt, moet de temperatuur voldoende worden verhoogd om deze intermoleculaire elektrostatische aantrekkingen te overwinnen; vandaar dat het kookpunt hoog is vergeleken met vloeibaar methaan. Waterstoffluoride kan het best worden gekarakteriseerd als een polaire, maar niet ionische stof. Hoewel de O-H en N-H bindingen van water en ammoniak iets minder ionisch van aard zijn dan de H-F bindingen van waterstoffluoride, zijn deze stoffen ook relatief polair van aard en associëren ze zich ook door waterstofbruggen op dezelfde manier als waterstoffluoride.
De chemische eigenschappen van lithiumhydride, methaan en waterstoffluoride zijn in overeenstemming met bovenstaande formuleringen. Wanneer de binding aan de waterstof wordt verbroken, mag men dus verwachten dat deze breekt in de zin van Li^oplus & :H^ominus ^eind{array}) voor lithiumhydride, en in de zin van H^oplus & :H^ominus ^eind{array}) voor lithiumhydride, en in de zin van H^oplus & :H^ominus ^eind{array} \^overset{\delta ^oplus}{H} & : \underset{c:c} \overset{c:c} \overdelta \oplus}{H}:^{array}} voor waterstoffluoride, zodat het elektronenpaar naar het atoom met de hoogste elektronenaffiniteit gaat. Dit is inderdaad het geval zoals blijkt uit de volgende reactie:
(\begin{array}{c:c} Li^oplus & :H^ominus \eind{array} + \begin{array}{c:c} H & : \underset}{{F}} : \eind{array} \Li^oplus : \underset{\dot{F}}:^oplus + : H : H3845>
Methaan, met zijn relatief apolaire bindingen, is inert voor bijna alle reagentia die waterstof zouden kunnen verwijderen als \(H^oplus) of \(H:^ominus), behalve onder extreme omstandigheden. Zoals te verwachten is, zijn methylkationen (CH_3^oplus) en methylanionen (CH_3:^ominus) zeer moeilijk te maken en zeer reactief. Daarom worden de volgende reacties niet waargenomen:

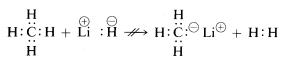
Vanaf het voorgaande kun je verwachten dat de chemie van koolstofverbindingen grotendeels de chemie van covalente verbindingen zal zijn en in het geheel niet zal lijken op de chemie van anorganische zouten zoals natriumchloride. U kunt ook verwachten dat de belangrijkste verschillen in chemische en fysische eigenschappen van organische verbindingen zullen voortvloeien uit de aard van de andere elementen die aan koolstof zijn gebonden. Zo is het niet te verwachten dat methaan dezelfde chemische eigenschappen heeft als andere één-koolstofverbindingen zoals methyllithium (CH_3Li) of methylfluoride (CH_3F). G. N. Lewis (1876-1946), de beroemde Amerikaanse scheikundige, was de eerste die de betekenis van het elektronenpaar in de moleculaire structuur begreep. Hij legde de basis voor de moderne theorie van structuur en binding in zijn verhandeling over Valence and the Structure of Atoms and Molecules (1923).
(^7})In deze tekst moeten alle temperaturen die niet anders zijn aangegeven, worden opgevat in ^(^text{o}C); absolute temperaturen zullen worden weergegeven als ^(^text{o}K).
Bijdragers en toeschrijvingen
- John D. Robert en Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Deze inhoud is auteursrechtelijk beschermd onder de volgende voorwaarden: “You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format.”