化学の多くが炭素という単一の元素を中心にしている要因について考えてみましょう。 非常に重要な特徴の1つは、炭素-炭素結合が強いので、炭素原子が互いに結合した長い鎖や環が可能なことです。 ダイヤモンドとグラファイトがその例で、ダイヤモンドは炭素原子の3次元ネットワークであるのに対し、グラファイトは平面ネットワークに近い。

しかし、ホウ素、ケイ素、リンなど他の元素も素粒子状態で強い結合を形成しているので、炭素がそれ自体への結合を形成するのは特殊なことではないのです。 炭素のユニークさは、むしろそれが強い炭素-炭素結合を形成し、それが他の元素と組み合わされたときにも強いという事実に起因している。 例えば、水素と炭素を組み合わせると、驚くほど多様な炭素水素化物(通常、炭化水素と呼ばれる)ができる。 これに対して、ホウ素以外の第2列の元素は安定な水素化物をあまり作らず、ホウ素の水素化物は炭化水素よりもはるかに反応性が高く、特に水や空気に対して反応しやすい。
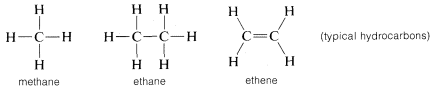
炭素はそれ自身や水素と結合するだけでなく、フッ素のような強く電子を引きつける元素やリチウムのような強く電気陽性の金属など、多くの他の元素とも結合する:
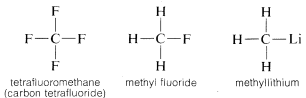
なぜ炭素が非常に多様な種類の元素に結合できるのか。 炭素の特殊な性質は、4価の電子を持つ比較的小さな原子であることに起因しています。 塩化ナトリウムのような単純な塩化合物( \(Na^oplus Cl^ominus)) を作るには、炭素は4つの価電子をフッ素などの元素に奪われて4価イオン(C^{4 \oplus}) になるか、リチウムなどの元素から4つの電子を得て4価イオン (C^{4 \ominus}) にならなければならないのである。
通常、炭素は他の原子と電子を共有することで価電子帯の8重項を完成させる。 メタン、エタン、テトラフルオロメタンなどの共有電子結合(または共有結合)を持つ化合物では、以下の電子対構造(ルイス構造)のように、炭素を含む結合した原子がそれぞれ価電子殻を満たした状態となる。
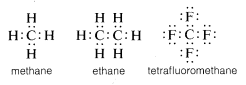
このように、炭素の価電子殻の完成に伴う電子間の反発は、炭素が結合している原子の正電荷の原子核の電子吸引力によって埋め合わされる。
しかし、共有結合の電子は、特に原子の電子に対する親和力が非常に異なる場合、結合した原子によって必ずしも均等に共有されるとは限りません。 したがって、炭素-フッ素および炭素-リチウム結合は、イオン結合ではないが、電子がより高い電子親和力を持つ原子に多く関連するように分極される。 これは通常、より高い有効核電荷を持つ原子である。
(\overset{delta \oplus}{C}) \: \: \: \: \: : \평평평평평 \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \팔팔팔팔 \: \: \: \: \: \평평평평 \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \┣︎┣︎┣︎┣︎┣︎┣︎┣︎ଘ \┣︎┣︎┣︎┣︎┣︎ଘ \평평평평평 \right)})
このように、さまざまな分子において、純粋なイオン結合から純粋な共有結合へのグラデーションが見られ、これはその化学的および物理的性質に現れている。 たとえば、周期表の横2列目の元素の水素化物を考えてみよう。 その融点と沸点は次のとおりです。 結晶格子中の反対荷電イオン間の静電引力が強いので、水素化リチウムは塩化ナトリウムやフッ化リチウムなどと同様に高融点不揮発性固体となる。 これは水素化リチウムの融点よりもさらに低く、約800℃である。 炭素と水素の電子吸引力はほぼ同じであるため、イオン的な結合はほとんどなく、メタンは非極性物質といえる。 その結果、メタン分子間の静電引力は比較的小さく、気体分子として互いに逃げやすく、沸点が低い。
フッ化水素の沸点はメタンより幾分高い。 フッ化水素の結合電子対は水素よりもフッ素の方に引き寄せられるので、結合の形は \(voerset{delta \oplus}{H}) —- \(voerset{delta \ominus}{F}) と表現できます。 液体のフッ化水素では、分子は水素結合と呼ばれる鎖や環の配列によって凝集する傾向があり、ある分子の正の水素が次の分子の負のフッ素を引き寄せる:
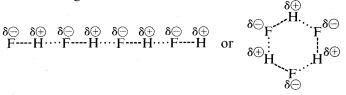
液体のフッ化水素が気化するとき、この分子間静電引力を克服するには温度を十分に上げる必要があり、そのため沸点は液体メタンと比較して高くなります。 フッ化水素はイオン性ではなく極性物質として最もよく特徴づけられています。 水やアンモニアは、フッ化水素に比べればイオン性は低いが、比較的極性が高く、フッ化水素と同じように水素結合で結ばれている。 従って、水素との結合が切れるとき、水素化リチウムでは \(begin{array}{c:c} Li^oplus & :H^ominus \end{array}} の意味で切れると予想され、またメタンでは \(begin{array}{c:c}) の意味で切れると予想される。 \Ίτανα για για για για για για & : Ⓐdddot{F}}:^{delta Ⓐend{array}} フッ化水素では電子対が最も電子親和力の高い原子に行くようにします。 これは次の反応が示すように、確かにそうです:
6911 Li^oplus & :H^ominus \end{array}. + \begin{array}{c:c} H & : \underset{Thinkdot}{ddot{F}} : \end{array}. \longrightarrow Li^oplus : \underset{Thinkdot}{ddot{F}}:^oplus + \: H : H)
Methane, with its relatively nonpolar bonds, is inert to almost all reagents that could remove hydrogen as \(H^anthusoplus やはり、メチルカチオン \(CH_3^) とメチルアニオン \(CH_3:^) は生成しにくく、反応性が非常に高いです。 このため、次のような反応は見られない:

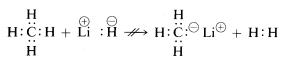
以上から、炭素化合物の化学は大部分が共有結合の化学で、塩化ナトリウムなどの無機塩の化学とは全く似ていないことが予測されるであろう。 また、有機化合物の化学的、物理的性質の大きな違いは、炭素に結合している他の元素の性質に起因すると考えてもよいだろう。 したがって、メタンは、メチルリチウムやフッ化メチルのような炭素1つの化合物と同じ化学的性質を持つことは期待できないし、持っていない。
This text throughout all temperatures not otherwise designated is understanded as in \(^text{o}C); absolute temperatures will show as \(^text{o}K).All the temperatures not otherwise designated is in the \(^text{o}C).
Contributors and Attributions
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition.(邦訳:有機化学の基礎)。 W. A. Benjamin, Inc. , カリフォルニア州メンロパーク. ISBN 0-8053-8329-8。 このコンテンツは、「個人、教育、研究、非商業目的で、この作品をいかなる形式でも複製、配布、表示、実演することを許可する」
という条件の下で著作権保護されています。