Lássunk néhány tényezőt, amelyek miatt a kémia oly nagy része egyetlen elemre, a szénre összpontosul. Az egyik nagyon fontos jellemző, hogy a szén-szén kötések erősek, így egymáshoz kötött szénatomok hosszú láncai vagy gyűrűi lehetségesek. A gyémánt és a grafit két ismert példa, a gyémántrács a szénatomok háromdimenziós hálózata, míg a grafit valójában inkább egy síkbeli hálózatra hasonlít. A grafit kenési tulajdonságai valójában a szerkezetével függnek össze, amely lehetővé teszi, hogy a síkok egymás mellett elcsússzanak.

A szén azonban nem egyedülálló az önmagához való kötések kialakításában, mert más elemek, például a bór, a szilícium és a foszfor elemi állapotban is erős kötéseket képeznek. A szén egyedisége inkább abból ered, hogy erős szén-szén kötéseket képez, amelyek más elemekkel kombinálva is erősek. Például a hidrogén és a szén kombinációja a szénhidridek, vagy ahogy általában nevezik, a szénhidrogének figyelemre méltó változatosságát eredményezi. Ezzel szemben a bór kivételével a többi másodrendű elem egyike sem ad stabil hidridek igen kiterjedt rendszerét, és a bórhidridek többsége sokkal reaktívabb, mint a szénhidrogének, különösen a vízzel és a levegővel szemben.
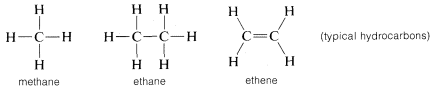
A szén nemcsak önmagával és a hidrogénnel, hanem sok más elemmel is kötéseket képez, köztük erősen elektronvonzó elemekkel, például a fluorral és erősen elektro-pozitív fémekkel, például a lítiummal:
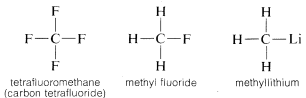
Miért olyan sokoldalú a szén, hogy nagyon sokféle elemhez képes kötődni? A szén különleges tulajdonságai annak tulajdoníthatók, hogy viszonylag kis atom, négy valenciaelektronnal. Ahhoz, hogy egyszerű sószerű vegyületeket, például nátrium-kloridot, \(Na^\oplus Cl^\ominus\) alkosson, a szénnek vagy el kell veszítenie négy valenciaelektronját egy olyan elemhez, mint a fluor, és négypozitív ionná, \(C^{4 \oplus}\) kell alakulnia, vagy négy elektront kell szereznie egy olyan elemtől, mint a lítium, és négynegatív iont, \(C^{4 \ominus}\) kell alkotnia. A négy elektron megszerzése energetikailag nagyon kedvezőtlen lenne az elektronok közötti kölcsönös taszítás miatt.
A szén általában úgy egészíti ki a valenciahéj-oktettjét, hogy elektronokat oszt meg más atomokkal. A megosztott elektronkötésekkel (vagy kovalens kötésekkel) rendelkező vegyületekben, mint például a metán, az etán vagy a tetrafluorometán, a kötött atomok mindegyikének, beleértve a szenet is, tele van a valenciahéja, amint azt az alábbi elektronpáros vagy Lewis\(^6\) szerkezetek mutatják:
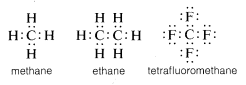
Ily módon a szén valenciahéjának kitöltésével járó elektronok közötti taszítást kompenzálják azon atomok pozitív töltésű atommagjainak elektronvonzó ereje, amelyekhez a szén kötődik.
A kovalens kötés elektronjai azonban nem feltétlenül egyenlően oszlanak meg a kapcsolt atomok között, különösen akkor, ha az atomok elektronokhoz való affinitása nagyon eltérő. Így a szén-fluor és a szén-lítium kötések, bár nem ionos kötések, úgy polarizálódnak, hogy az elektronok inkább a nagyobb elektronaffinitású atomhoz kapcsolódnak. Ez általában a nagyobb effektív magtöltéssel rendelkező atom.
\(\overset{\delta \oplusz}{C}) \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{jelöljük a részleges ionos kötéseket} \right)}\)
A különböző molekulákban tehát a tisztán ionos kötéstől a tisztán kovalens kötésig terjedő fokozatot látunk, és ez a kémiai és fizikai tulajdonságaikban is megmutatkozik. Vegyük például a periódusos rendszer második vízszintes sorában lévő elemek hidridjeit. Olvadás- és forráspontjukat,\(^7\) ahol ismert, az alábbiakban adjuk meg.
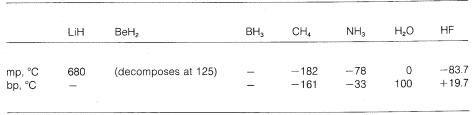
A lítiumhidridet sószerű ionos vegyületnek tekinthetjük, \(\overset{\oplus}{Li} \: \: \: \: : \overset{\ominus}{H}\). A kristályrácsban az ellentétes töltésű ionok közötti elektrosztatikus vonzások erősek, ezáltal a lítium-hidrid magas olvadékonyságú, nem illékony szilárd anyag, mint a nátrium-klorid, lítium-fluorid stb.
A metán, \(CH_4\), a másik véglet. Forrása \(-161^\text{o}\), ami még a lítium-hidrid olvadáspontjánál is körülbelül \(800^\text{o}\) alacsonyabb. Mivel a szén és a hidrogén nagyjából azonos elektronvonzó képességgel rendelkezik, a \(C-H\) kötések kevéssé ionos jellegűek, és a metán nem poláris anyagként jellemezhető. Ennek következtében a metánmolekulák között viszonylag kevés az elektrosztatikus vonzás, és ez lehetővé teszi, hogy gáznemű molekulákként könnyebben “elszakadjanak” egymástól – innen az alacsony forráspont.
A hidrogén-fluorid forráspontja néhány \(200^\\text{o}\) ponttal magasabb, mint a metáné. A \(HF\) kötő elektronpárja jobban vonzódik a fluorhoz, mint a hidrogénhez, így a kötés \(\overset{\delta \oplusz}{H}\) —- \(\overset{\delta \ominus}{F}\) formában fogalmazható meg. A folyékony hidrogén-fluoridban a molekulák az úgynevezett hidrogénkötés révén hajlamosak láncokba és gyűrűkbe rendeződve aggregálódni, így az egyik molekula pozitív hidrogénje vonzza a következő molekula negatív fluorját:
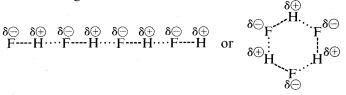
A folyékony hidrogén-fluorid elpárolgásakor a hőmérsékletet kellően meg kell emelni ahhoz, hogy ezeket a molekulák közötti elektrosztatikus vonzásokat legyőzzük; ezért a forráspont a folyékony metánhoz képest magas. A hidrogén-fluoridot leginkább poláris, de nem ionos anyagként jellemezhetjük. Bár a víz és az ammónia \(O-H\) és \(N-H\) kötései valamivel kevésbé ionos jellegűek, mint a hidrogén-fluorid \(H-F\) kötései, ezek az anyagok is viszonylag poláris természetűek, és hidrogénkötésen keresztül ugyanúgy kapcsolódnak, mint a hidrogén-fluorid.
A lítium-hidrid, a metán és a hidrogén-fluorid kémiai tulajdonságai összhangban vannak a fenti megfogalmazásokkal. Így a hidrogénkötés felszakadásakor a lítium-hidrid esetében \(\begin{array}{c:c} Li^\oplusz & :H^\ominus \end{array}\), a lítium-hidrid esetében pedig \(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) hidrogén-fluoridra úgy, hogy az elektronpár a legnagyobb elektronaffinitású atomhoz kerül. Ez valóban így van, ahogy a következő reakció mutatja:
\(\begin{array}{c:c} Li^\\oplusz & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplusz : \underset{\cdot \cdot}{\ddot{F}}:^\oplusz + \: H : H\)
A metán, viszonylag nem poláris kötéseivel, szinte minden olyan reagenssel szemben inert, amely \(H^\oplusz\) vagy \(H:^\ominus\) formájában hidrogént tudna eltávolítani, kivéve minden, csak nem extrém körülmények között. Ahogy az várható volt, a metil-kationokat \(CH_3^\oplus\) és a metil-anionokat \(CH_3:^\ominus\) nagyon nehéz előállítani, és rendkívül reaktívak. Emiatt a következő reakciókat nem figyelhetjük meg:

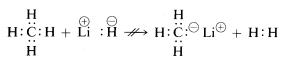
A fentiekből előre láthatjuk, hogy a szénvegyületek kémiája nagyrészt a kovalens vegyületek kémiája lesz, és egyáltalán nem fog hasonlítani a szervetlen sók, például a nátrium-klorid kémiájára. Azt is előre láthatjuk, hogy a szerves vegyületek kémiai és fizikai tulajdonságainak fő különbségei a szénhez kötött egyéb elemek természetéből adódnak. Így a metánnak nem várható, és nem is olyan a kémiája, mint más egy szénatomos vegyületeknek, például a metillítiumnak, \(CH_3Li\), vagy a metilfluoridnak, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), a neves amerikai kémikus volt az első, aki felismerte az elektronpár jelentőségét a molekulaszerkezetben. A Valencia és az atomok és molekulák szerkezete (1923) című értekezésében megalapozta a szerkezet és a kötés modern elméletét.
\(^7\)A szövegben minden másként nem jelölt hőmérséklet \(^\text{o}C\)-ben értendő; az abszolút hőmérsékleteket \(^\text{o}K\)-ben jelöljük.
Megosztók és hozzászólások
- John D. Robert és Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, második kiadás. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Ez a tartalom szerzői jogvédelem alatt áll a következő feltételekkel: “Engedélyt adunk a mű egyéni, oktatási, kutatási és nem kereskedelmi célú sokszorosítására, terjesztésére, bemutatására és előadására bármilyen formátumban.”