Consideriamo alcuni dei fattori che fanno sì che gran parte della chimica sia incentrata su un singolo elemento, il carbonio. Una caratteristica molto importante è che i legami carbonio-carbonio sono forti, quindi sono possibili lunghe catene o anelli di atomi di carbonio legati tra loro. Il diamante e la grafite sono due esempi familiari: il reticolo del diamante è una rete tridimensionale di atomi di carbonio, mentre la grafite assomiglia di più a una rete planare. Le proprietà lubrificanti della grafite sono in realtà legate alla sua struttura, che permette ai piani di scorrere uno dopo l’altro.

Ma il carbonio non è unico nel formare legami con se stesso perché altri elementi come boro, silicio e fosforo formano forti legami allo stato elementare. L’unicità del carbonio deriva più dal fatto che forma forti legami carbonio-carbonio che sono forti anche quando sono combinati con altri elementi. Per esempio, la combinazione dell’idrogeno con il carbonio permette una notevole varietà di idruri di carbonio, o idrocarburi, come sono solitamente chiamati. Al contrario, nessuno degli altri elementi di seconda fila, tranne il boro, dà un sistema molto esteso di idruri stabili, e la maggior parte degli idruri di boro sono molto più reattivi degli idrocarburi, specialmente con l’acqua e l’aria.
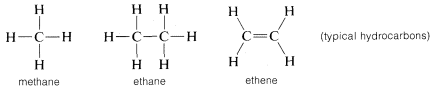
Il carbonio forma legami non solo con se stesso e con l’idrogeno ma anche con molti altri elementi, inclusi elementi fortemente attrattivi di elettroni come il fluoro e metalli fortemente elettropositivi come il litio:
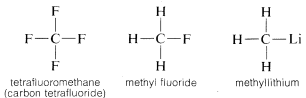
Perché il carbonio è così versatile nella sua capacità di legarsi a tipi di elementi molto diversi? Le speciali proprietà del carbonio possono essere attribuite al suo essere un atomo relativamente piccolo con quattro elettroni di valenza. Per formare semplici composti simili a sali come il cloruro di sodio, \(Na^\plus Cl^ominus\), il carbonio dovrebbe perdere i quattro elettroni di valenza per un elemento come il fluoro ed essere convertito in uno ione quadripositivo, \(C^{4 \plus}), o acquisire quattro elettroni da un elemento come il litio e formare uno ione quadrinegativo, \(C^{4 \ominus}). L’acquisizione di quattro elettroni sarebbe energeticamente molto sfavorevole a causa della repulsione reciproca tra gli elettroni.
In genere, il carbonio completa il suo ottetto di valenza condividendo elettroni con altri atomi. Nei composti con legami condivisi di elettroni (o legami covalenti) come il metano, l’etano o il tetrafluorometano, ognuno degli atomi legati, incluso il carbonio, ha il suo guscio di valenza riempito, come mostrato nelle seguenti strutture di coppia di elettroni o Lewis\(^6\):
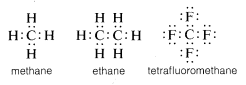
In questo modo, le repulsioni tra gli elettroni associate al completamento del guscio di valenza del carbonio sono compensate dal potere di attrazione degli elettroni dei nuclei positivamente carichi degli atomi a cui il carbonio è legato.
Tuttavia, gli elettroni di un legame covalente non sono necessariamente condivisi equamente dagli atomi legati, soprattutto quando le affinità degli atomi per gli elettroni sono molto diverse. Così, i legami carbonio-fluoro e carbonio-litio, anche se non sono ionici, sono polarizzati in modo tale che gli elettroni sono associati maggiormente all’atomo con maggiore affinità elettronica. Questo è di solito l’atomo con la carica nucleare effettiva più alta.
(\overset{delta \oplus}{C} \: \: \: \: \: : \delta \ominus} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C:C \: \: \: \: \: \delta \”Pioppo\”. \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \delta \plus, delta \plus, \plus, \plus: \delta \ominus \: \continua a indicare i legami ionici parziali
Vediamo quindi una gradazione dal legame puramente ionico a quello puramente covalente in diverse molecole, e questo si manifesta nelle loro proprietà chimiche e fisiche. Consideriamo, per esempio, gli idruri degli elementi nella seconda fila orizzontale della tavola periodica. I loro punti di fusione e di ebollizione, \(^7\) se noti, sono dati qui sotto.
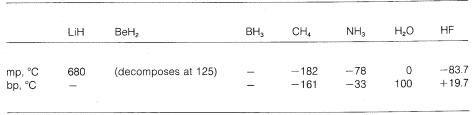
L’idruro di litio può essere considerato come un composto ionico simile ad un sale, \(\overset{oplus}{Li} \: \: \: : \overset{ominus}{H}). Le attrazioni elettrostatiche tra ioni di carica opposta nel reticolo cristallino sono forti, causando così che l’idruro di litio sia un solido ad alta fusione e non volatile come il cloruro di sodio, il fluoruro di litio, e così via.
Il metano, \(CH_4\), è all’altro estremo. Bolle a \161^testo{o}, che è circa \800^testo{o} più basso persino del punto di fusione dell’idruro di litio. Poiché il carbonio e l’idrogeno hanno circa lo stesso potere di attrazione degli elettroni, i legami \C-H\ hanno poco carattere ionico, e il metano può essere caratterizzato come una sostanza non polare. Come risultato, c’è relativamente poca attrazione elettrostatica tra le molecole di metano e questo permette loro di “scappare” più facilmente l’una dall’altra come molecole gassose – da qui il basso punto di ebollizione.
Il fluoruro di idrogeno ha un punto di ebollizione circa \200^testo{o}} più alto di quello del metano. La coppia di elettroni di legame del fluoro (HF) è attratta più verso il fluoro che verso l’idrogeno, così il legame può essere formulato come \overset \delta \oplus}{H}) —- \overset \ominus \F}. Nel fluoruro di idrogeno liquido, le molecole tendono ad aggregarsi attraverso quello che è chiamato legame idrogeno in catene e anelli disposti in modo che l’idrogeno positivo su una molecola attrae un fluoro negativo sulla successiva:
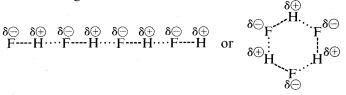
Quando il fluoruro di idrogeno liquido viene vaporizzato, la temperatura deve essere aumentata sufficientemente per superare queste attrazioni elettrostatiche intermolecolari; quindi il punto di ebollizione è alto rispetto al metano liquido. Il fluoruro di idrogeno è meglio caratterizzato come una sostanza polare, ma non ionica. Sebbene i legami \(O-H\) e \(N-H\) dell’acqua e dell’ammoniaca abbiano un po’ meno carattere ionico dei legami \(H-F\) del fluoruro di idrogeno, queste sostanze sono anche relativamente polari in natura e si associano anche attraverso il legame a idrogeno nello stesso modo del fluoruro di idrogeno.
Le proprietà chimiche dell’idruro di litio, del metano e del fluoruro di idrogeno sono in accordo con le formulazioni di cui sopra. Così, quando il legame con l’idrogeno è rotto, potremmo aspettarci che si rompa nel senso \(\begin{array}{c:c} Li^\plus & :H^\ominus \end{array}) per l’idruro di litio, e \(\begin{array}{c:c} \overset{delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{delta \ominus} \end{array}) per l’idrogeno fluoruro in modo che la coppia di elettroni vada con l’atomo di maggiore affinità elettronica. Questo è effettivamente il caso come indica la seguente reazione:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F} : \end{array} \Il metano, con i suoi legami relativamente non polari, è inerte a quasi tutti i reagenti che potrebbero rimuovere l’idrogeno come \(H^\plus\) o \(H:^\ominus\) tranne che in condizioni estreme. Come ci si aspetterebbe, i cationi di metile \(CH_3^\oplus\) e gli anioni di metile \(CH_3:^ominus\) sono molto difficili da generare e sono estremamente reattivi. Per questo motivo, non si osservano le seguenti reazioni:

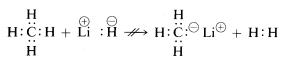
Da quanto sopra si può anticipare che la chimica dei composti di carbonio sarà in gran parte la chimica dei composti covalenti e non assomiglierà affatto alla chimica dei sali inorganici come il cloruro di sodio. Si può anche prevedere che le maggiori differenze nelle proprietà chimiche e fisiche dei composti organici deriveranno dalla natura degli altri elementi legati al carbonio. Così il metano non dovrebbe avere, né ha, la stessa chimica di altri composti monocarbonio come il metilitio, \(CH_3Li\), o il fluoruro di metile, \(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), il famoso chimico statunitense, fu il primo ad afferrare il significato della coppia di elettroni nella struttura molecolare. Egli pose le basi per la moderna teoria della struttura e del legame nel suo trattato sulla valenza e la struttura degli atomi e delle molecole (1923).
\(^7\)In tutto questo testo tutte le temperature non altrimenti designate devono essere intese in \(^testo{o}C); le temperature assolute saranno indicate come \(^testo{o}K).
Contribuenti e attribuzioni
- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, seconda edizione. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Questo contenuto è protetto da copyright alle seguenti condizioni: “È concesso il permesso per la riproduzione individuale, educativa, di ricerca e non commerciale, la distribuzione, la visualizzazione e l’esecuzione di questo lavoro in qualsiasi formato.”