Úvod
Původní pyridinový nukleotid, nikotinamidadenindinukleotid (NAD+), je přítomen ve všech buňkách těla a je nezbytný pro životaschopnost a funkci buněk.
Jako kofaktor zodpovědný za přenos elektronů do dýchacího řetězce má NAD+ a jeho redoxní pár NADH zásadní význam pro produkci energie (ATP) v mitochondriích prostřednictvím oxidativní fosforylace. Fosforylovaný metabolit NAD+, NADP+ s jeho redoxním párem NADPH, také poskytuje redukční sílu k řízení řady anabolických reakcí, včetně syntézy cholesterolu a nukleových kyselin, prodlužování mastných kyselin a regenerace glutathionu (GSH), jednoho z hlavních tělesných antioxidantů. Celkově se tato skupina pyridinových nukleotidů podílí na redoxní výměně více než 400 enzymových reakcí. Důležité je, že když působí jako redoxní pár, NAD+ se nespotřebovává. NAD+ však slouží také jako substrát pro řadu dalších důležitých metabolických procesů, a proto je v důsledku jejich chemických reakcí spotřebováván, což může vést k vyčerpání NAD+ ve tkáni. Do tohoto počtu jsou zahrnuty reakce řízené rodinou enzymů polyadenosinfosforibóza-ribóza (ADPR) (PARP 1-17) řídící opravy DNA a jadernou stabilitu, enzymy epigenetické kontroly (Sirt1-7), mezibuněčnou imunitní komunikaci (CD38/CD157) a regeneraci neuronů (SARM1; Essuman et al., 2017). Existuje tedy potenciál pro narušení buněčného metabolismu na mnoha úrovních za podmínek, kdy spotřeba NAD+ těmito enzymy převyšuje jeho přísun nebo syntézu.
Klinický význam udržování buněčných hladin NAD+ byl stanoven na počátku minulého století zjištěním, že pelagru, onemocnění charakterizované průjmy, dermatitidou, demencí a smrtí, lze léčit potravinami obsahujícími prekurzor NAD+ niacin (známý také jako vitamin B3; Goldberger, 1914). Ačkoli je pelagra v rozvinutých zemích vzácná, bylo prokázáno, že buněčné koncentrace NAD+ se snižují za podmínek zvýšeného oxidačního poškození, k němuž dochází například během stárnutí (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Bylo zjištěno, že změněné hladiny NAD+ doprovázejí několik poruch spojených se zvýšeným oxidačním poškozením/poškozením volnými radikály, včetně diabetu (Wu et al., 2016), srdečních onemocnění (Pillai et al., 2005), s věkem související cévní dysfunkce (Csiszar et al., 2019), ischemického poškození mozku (Ying a Xiong, 2010), chybně složených neuronálních proteinů (Zhou et al., 2015) a Alzheimerovu demenci (Abeti a Duchen, 2012).
Kromě patologických znaků Aβ plaků a neurofibrilárních tau tanglů je u Alzheimerovy choroby konzistentním nálezem oxidační poškození, které je všeobecně uznáváno jako časná událost v patogenetickém procesu, dokonce předcházející ukládání Aβ (Su et al., 2008). I když reaktivní formy kyslíku (ROS) způsobující toto poškození pravděpodobně pocházejí z více zdrojů, předpokládá se, že dominantní roli hrají nefunkční mitochondrie a dostupnost redoxně aktivních kovů, jako jsou Fe++ a Cu+ (Zhua et al., 2007).
Hlavním důsledkem buněčného oxidačního stresu v mozku i jinde jsou jedno- nebo dvouřetězcové zlomy DNA. V reakci na poškození DNA PARP1 hydrolyzuje NAD+ za vzniku polymerů ADP-ribózy (Ying, 2013). Již dříve jsme ukázali, že hladiny NAD+ nepřímo úměrně korelují s mírami oxidačního stresu v lidské tkáni (Massudi et al., 2012) a v mozku potkanů (Braidy et al., 2014). Zatímco tedy snížené hladiny NAD+ v mozku žijících osob trpících Alzheimerovou chorobou čekají na potvrzení neinvazivními technikami, konzistentní nálezy oxidačního poškození v mozku post mortem silně podporují názor, že zrychlený obrat a vyčerpání NAD+ přispívají k neurologické dysfunkci u tohoto onemocnění. Vzhledem k tomu, že na zvířecích modelech bylo prokázáno, že zásahy zaměřené na obnovu NAD+ podporují zdravé stárnutí a zlepšují metabolické funkce (Yoshino et al., 2011; Mills et al., 2016) a demenci (Long et al., 2015), aktivně se zkoumají strategie pro zvýšení hladiny NAD+ u člověka.
Nejpřímější metodou zvýšení hladiny NAD+ je intravenózní (IV) podání. Ačkoli údajů z experimentálního výzkumu je minimum, byl již dříve zaznamenán významný klinický přínos IV infuze NAD+ při odvykání alkoholu (O’Holleran, 1961; Mestayer, 2019). Překvapivě, zatímco perorální podávání prekurzorů NAD+, jako je nikotinamid ribosid (NR) nebo nikotinamid mononukleotid (NMN), je nadšeně zkoumáno z hlediska jejich vlivu na hladiny NAD+ (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), metabolický osud a farmakokinetické vlastnosti intravenózního podávání NAD+ u lidí dosud nebyly popsány. Tato studie proto poprvé představuje změny koncentrací NAD+ a jeho metabolitů během intravenózní infuze NAD+ u skupiny zdravých účastníků mužského pohlaví.
Materiál a metody
Účastníci
Jedenáct (testovacích n = 8, kontrolních n = 3) účastníků mužského pohlaví ve věku 30-55 let bylo rekrutováno prostřednictvím reklamy v rádiu, televizi a sociálních médiích. Všichni účastníci měli BMI nižší než 30 kg/m2 (testovací průměrný BMI = 27,5 ± 2,5 kg/m2; kontrolní průměrný BMI = 24,6 ± 6,5 kg/m2), nebyli diabetici, kouřili méně než 1 cigaretu a konzumovali méně než 2 standardní alkoholické nápoje denně. Ze studie byli vyloučeni jedinci užívající léky snižující hladinu lipidů nebo protizánětlivé léky, kteří měli v anamnéze selhání jater nebo ledvin nebo v nedávné době prodělali mikrobiální infekci, úraz nebo jiné závažné či neléčené zdravotní potíže. Účastníci obdrželi za svůj čas a účast ve studii peněžitou náhradu bez ohledu na to, zda experiment dokončili. Účastníci nesměli během 14 dnů před zahájením studie a v jejím průběhu užívat přírodní léčivé přípravky obsahující NAD+, NR nebo nikotinamid.
Standardizace stravy
Den před intravenózní infuzí NAD+ účastníci konzumovali identickou stravu se sníženým obsahem niacinu a pili pouze vodu.
V den studie nebylo konzumováno žádné jídlo, dokud nebyl odebrán poslední 8hodinový vzorek krve/močoviny. Účastníci byli vyzváni k pití vody, aby zůstali normálně hydratovaní. Žádné jiné druhy nápojů nebyly povoleny.
Pro zajištění dostatečného energetického příjmu účastníků během 6 h infuze obsahoval infuzní roztok také 0,1 % dextrózy, která poskytovala přibližně 2 000 kalorií po dobu 6 h infuze.
Infuzní protokol
Účastníci byli randomizováni do testovací (n = 8) nebo kontrolní (n = 3) skupiny. Účastníkům v Testovací skupině bylo intravenózně podáváno 750 mg NAD+ ve fyziologickém roztoku (Archway Apothecary, Covington, LA, USA) po dobu 6 h (rychlost infuze = ~2 mg/min ≡ 3 μmol/min). Tato dávka NAD+ byla odvozena empiricky a odráží běžný dávkovací režim na klinikách (např. Springfield Wellness Clinic, Springfield, LA, USA), které v klinické praxi pravidelně poskytují infuze NAD+. Účastníkům v kontrolní skupině byl intravenózně podáván normální fyziologický roztok po dobu 6 h.
Klinické podávání a dohled nad intravenózními infuzemi a odběrem vzorků byly prováděny ve Springfield Wellness Center, Springfield, LA, USA.
Odběr krevních vzorků
Všem účastníkům byly odebrány základní (TO) krevní vzorky po nočním 12hodinovém lačnění načasovaném tak, aby k němu došlo bezprostředně před zahájením infuze. Další vzorky pak byly odebrány za 30, 60, 120 (2 h), 360 (6 h) a 480 (8 h) minut po zahájení infuze.
Celá krev byla odebrána standardní venepunkcí (opačná paže než místo infuze) do 5ml negelové heparinizované zkumavky. Ihned po odběru byla krev centrifugována při 4 °C po dobu 10 minut při 1 409× g.
Frakce plazmy a červených krvinek byly okamžitě odděleny a rozděleny vždy do 5 × 500 μl alikvotů. Všechny alikvoty byly poté okamžitě zmraženy a až do analýzy uchovávány při teplotě -80 °C.
Odběr vzorků moči
Po odběru základního vzorku moči ve středním proudu byli účastníci požádáni, aby 30 min, 2 h, 6 h a 8 h po zahájení infuze NAD+ vymočili veškerou moč do nádoby (nádob) k tomu určené. Pokud účastníci potřebovali vymočit moč přerušovaně mezi těmito časovými body, byli požádáni, aby tak učinili do další následující nádobky. Všechny vzorky byly ihned po obdržení alikvotovány a uloženy při -80 °C.
Analytická metoda
Chromatografická separace NAD+ a souvisejících metabolitů a MS detekce Kapalinová chromatografie spojená s tandemovou hmotnostní spektrometrií (LC/MS/MS) byla provedena pomocí hmotnostního spektrometru Sciex QTRAP 5500 (Sciex, Redwood City, CA, USA), jak bylo popsáno dříve (Clement et al., 2018). Stručně řečeno, 100 μl lidské plazmy nebo moči bylo extrahováno ve 400 μl ledově chladného methanolu, odstředěno při 4 °C po dobu 10 min a přefiltrováno přes membránové kazety 3 kDa. Extrakty vzorků byly vysušeny ve vakuu, rekonstituovány ve 200 μl 100 mM NH4OAc pufru a převedeny do 200 μl skleněných lahviček a uzavřeny před LC/MS/ MS analýzou. Standardy a vzorky (20 μl) byly nastříknuty na kolonu Phenomenex NH2 (150 mm- 2 mm- 3 mm), jak bylo popsáno dříve. Byl použit gradient binárního rozpouštědla sestávající z 5 mM NH4OAc pH 9,5 upraveného amoniakem (mobilní fáze A) a acetonitrilu (mobilní fáze B) s průtokem 250 μl/min. Počáteční složení rozpouštědla při nástřiku bylo 25 % A, následoval 2minutový gradient na 45 % A a rychlý gradientový náběh na 80 % A (0,1 min), který byl udržován po dobu 5,9 min, A byl opět zvýšen na 95 % (2 min), udržován po dobu 13 min a poté se vrátil na počáteční podmínky (0,1 min) pro ekvilibraci, přičemž celková doba běhu byla 30 min. Průtok kolonou byl veden do MS detektoru. Kalibrační křivky jednotlivých metabolitů byly sestrojeny pomocí poměrů plochy píku (plocha píku metabolitu dělená plochou píku vybraného IS) každého kalibrátoru v závislosti na jeho koncentraci.
Vnitřní standardy se skládaly z 2H2NAM (pro NAM, methylNAM a ADPR) a 13C5;-Cyklického AMP (pro NMN a NAD+). Všimněte si, že vzhledem k tomu, že izotopové značky nejsou komerčně dostupné pro všechny metabolity NAD, lze použít také blízce příbuznou molekulu (strukturní analog) (Yamada et al., 2006) za předpokladu, že je považována za podobně stabilní a ionizačně účinnou během analýzy. Vnitřní standardy vybrané v této studii byly dříve optimalizovány pro příbuzný metabolit (Bustamante et al., 2017).
Bezpečnost
Bezpečnost IV NAD+ byla hodnocena pomocí testů jaterních funkcí a klinického pozorování případných nežádoucích účinků. Jaterní funkční testy se skládaly ze sérového, celkového bilirubinu (bili), alkalické fosfatázy (ALP), alaninaminotransferázy (ALT), gama glutamyltransferázy (GGT), laktátdehydrogenázy (LD) a aspartátaminotransferázy (AST).
Statistická analýza
Statistická analýza byla dokončena pomocí SPSS verze 24 a GraphPad Prism verze 8 pro Windows. Nevážené průměry, dvoucestná ANOVA s Bonferroniho testem mnohonásobného porovnání post hoc byla použita ke zjištění, zda se průměrné koncentrace pro testované analytiky lišily v průběhu 8 h a mezi testovanou a kontrolní skupinou. Wilcoxon Signed Ranks test byl použit ke zjištění, zda rozdíly v průměrných koncentracích testů jaterních funkcí byly významné mezi výchozími a 8hodinovými časovými body. Rozdíly byly považovány za statisticky významné, pokud p < 0,05.
Etika
Tato studie byla provedena v souladu s Etickým kodexem Světové lékařské asociace (Helsinská deklarace) pro pokusy na lidech. Etické schválení bylo získáno od Institutional Review Board William Carey University, Hattiesburg, MS (protokol č. 2017-12). Od všech účastníků byl získán informovaný souhlas.
Výsledky
Bezpečnost
Během 6hodinové infuze u placeba (fyziologický roztok) ani u testovaných kohort (NAD+) nebyly pozorovány žádné nežádoucí příhody.
V 8 h po zahájení infuze NAD+ byl pozorován významný pokles aktivity (1,3, 57, 3,6 jednotek/l) jaterních enzymů GGT, LD a AST (tabulka 1). U vzorků léčených placebem (fyziologickým roztokem) nebyla po 8 h patrná významná změna aktivity žádného markeru jaterních funkcí, avšak nízký počet vzorků může snižovat diskriminační citlivost. Bylo také pozorováno významné zvýšení plazmatického bilirubinu o 2,75 μmol/l. Žádná ze změn však nebyla považována za klinicky významnou.

Tabulka 1. Wilcoxon Signed Ranks test byl použit ke zjištění, zda rozdíly v průměrných koncentracích testů jaterních funkcí byly významné mezi výchozím a 8hodinovým časovým bodem.
Plasma
Kontinuální infuze NAD+ rychlostí 3 μmol/min vedla k významnému (398%) zvýšení plazmatických hladin NAD+ pouze v 6hodinovém časovém bodě (tj. na konci infuze) oproti výchozímu stavu (p < 0,0001). To se významně lišilo od kontrolní skupiny léčené 6 h fyziologickým roztokem (p < 0,001).
Hladiny NAD+ zůstaly zvýšené i po 8 h (tj. po skončení infuze), 2 h po infuzi) oproti výchozímu stavu a kontrolním vzorkům ošetřeným fyziologickým roztokem.
Hladiny NAD+ v plazmě se v průběhu 8 h hodnoceného období u kontrolních vzorků ošetřených fyziologickým roztokem významně nezměnily oproti výchozímu stavu (Obrázek 1A).
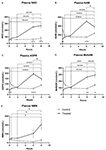
Obrázek 1. Změny plazmatického nikotinamidadenindinukleotidu (NAD+) a metabolitů v průběhu 8 h . (A) NAD+, (B) nikotinamid (NAM), (C) adenosinfosforibóza (ADPR), (D) methylnikotinamid (meNAM), (E) nikotinamidmononukleotid (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, jak je uvedeno. Dvoucestná ANOVA s Bonferroniho testem mnohonásobného porovnání post hoc byla použita ke zjištění, zda se průměrné koncentrace pro testované analytiky lišily v průběhu 8 h a mezi Testovací (n = 8) a Kontrolní (n = 3) skupinou.
Podobně jako změny pozorované u NAD+ se plazmatické hladiny metabolitu NAD+ nikotinamidu (NAM) na konci infuze NAD+ významně zvýšily o 409 % (tj. o 5 %), 6 hodin) oproti výchozí hodnotě (p < 0,0001). Stejně tak se významně lišil od kontrolního vzorku ošetřeného 6 h fyziologickým roztokem (p < 0,001).
V časovém bodě 8 h (tj. 2 h po ukončení infuze) se hladiny NAM mezi kontrolní a ošetřenou skupinou již významně nelišily (p > 0,05).
Hladiny NAM u kontrolních vzorků ošetřených fyziologickým roztokem se v průběhu 8 h významně nezměnily (p > 0,05, obr. 1B).
V souladu se změnami pozorovanými u NAM se plazmatické hladiny metabolitu NAD+ ADPR na konci infuze NAD+ (tj. 6 h) významně zvýšily o 393 % oproti výchozí hodnotě (p < 0,0001). To se významně lišilo od kontrolní skupiny léčené 6 h fyziologickým roztokem (p < 0,0001).
V časovém bodě 8 h (tj. 2 h po ukončení infuze) zůstaly hladiny ADPR o 305 % vyšší než výchozí (p < 0,0001). Nebyla však významně vyšší než hladiny ADPR u kontrolních vzorků ošetřených fyziologickým roztokem ve stejném časovém bodě (p > 0,05).
Hladiny ADPR u kontrolních vzorků ošetřených fyziologickým roztokem se po dobu 8 h významně nezměnily (p > 0,05, obrázek 1C).
Spearmanova korelační analýza mezi průměry skupin v časovém úseku 8 h pro dva katabolické metabolity NAD+, NAM a ADPR, poskytla korelační koeficient 1,00 (p < 0.001).
V souladu se změnami pozorovanými u NAM se plazmatické hladiny metabolitu NAM, methyl-nikotinamidu (meNAM), na konci infuze NAD+ významně zvýšily na 350 % (tj, 6 h) ve srovnání s výchozím stavem (p < 0,0001) i s kontrolní skupinou léčenou po 6 h fyziologickým roztokem (p < 0,01).
V časovém bodě 8 h (tj, 2 h po ukončení infuze) zůstaly hladiny meNAM o 393 % vyšší než výchozí hodnoty (p < 0,0001) a významně vyšší než u kontrolních vzorků ošetřených fyziologickým roztokem ve stejném časovém bodě (p < 0,05).
Hladiny meNAM u kontrolních vzorků ošetřených fyziologickým roztokem se po dobu 8 h významně nezměnily (p > 0,05, obr. 1D).
Plazmatické hladiny NMN, metabolitu NAM cestou anabolického záchytu, byly významně zvýšeny (472 %) pouze v časovém bodě 8 h (tj, 2 h po ukončení infuze, p < 0,05).
Hladiny NMN u kontrolních vzorků ošetřených fyziologickým roztokem se po dobu 8 h významně neměnily (p > 0,05, obr. 1E).
Moč
Kontinuální intravenózní infuze NAD+ rychlostí 3 μmol/min vedla k významnému (538%) zvýšení míry vylučování NAD+ močí v časovém bodě 6 h (tj, na konci infuze) ve srovnání s vylučováním po 30 min (p < 0,001). To se také významně lišilo od množství NAD+ vyloučeného močí v 6 h u kontrol léčených fyziologickým roztokem (p < 0,05).
Množství NAD+ vyloučeného močí se snížilo o 43 % (p < 0,05) v 8 h (tj. po ukončení infuze), 2 h po infuzi) vzhledem k vrcholu vylučování v časovém bodě 6 h.
Míra vylučování NAD+ močí se v kontrolních vzorcích ošetřených fyziologickým roztokem v průběhu 8 h hodnocení významně nezměnila (Obrázek 2A).

Obrázek 2. Změny NAD+ a metabolitů v moči v průběhu 8 h (1. 6 h sestávajících z kontinuální intravenózní infuze NAD+ o koncentraci 3 μmol/min). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, jak je uvedeno. Dvoucestná ANOVA s Bonferroniho testem mnohonásobného porovnání post hoc byla použita ke zjištění, zda se průměrné koncentrace pro testované analytiky lišily v průběhu 8 h a mezi Testovací (n = 8) a Kontrolní (n = 3) skupinou.
Rychlost vylučování metabolitu NAD+ NAM se během 8 h testovacího období významně nezměnila a nelišila se od pozorované rychlosti vylučování NAM u kontrol léčených fyziologickým roztokem (obrázek 2B).
Rychlost vylučování metabolitu NAM meNAM močí byla významně zvýšena (403 %) v časovém bodě 6 h (tj. 1 %), konci infuze, ve srovnání s hodnotou pozorovanou po 30 min (p < 0,01). Množství meNAM vyloučeného močí se snížilo o 43 % (p < 0,05) po 8 h (tj. po ukončení léčby), 2 h po infuzi) vzhledem k vrcholu vylučování v časovém bodě 6 h.
Míra vylučování meNAM močí se v průběhu 8 h hodnoceného období u kontrol léčených fyziologickým roztokem významně nezměnila (obr. 2C).
Diskuse
Zvyšující se zájem o terapie založené na NAD+ včetně infuzí NAD+ zdůraznil potřebu jasnějšího pochopení osudu NAD+ a jeho metabolitů po intravenózním podání. Současná studie dokumentuje změny hladin NAD+ a klíčových metabolitů v plazmě i moči v průběhu 8 hodin při použití typického klinického dávkovacího režimu 750 mg NAD+ podávaného intravenózně po dobu 6 hodin.
Důležité je, že infuze NAD+ nevyvolala u testované skupiny žádné pozorovatelné nežádoucí účinky, ale naopak snížila plazmatické aktivity enzymů svědčících o jaterním stresu, jako jsou intrahepatální LD a AST a posthepatální (žlučové cesty) enzym GGT, což naznačuje, že integrita intrahepatální i posthepatální tkáně byla posílena i v relativně krátkém 8hodinovém časovém rámci. Vzestup bilirubinu, degradačního produktu červených krvinek, po 8 hodinách může odrážet buď velmi malé zvýšení obratu červených krvinek, k němuž může dojít v důsledku infuzí indukované hemolýzy, nebo snížený metabolismus hemu (tabulka 1). Vzhledem k velmi nízkému rozsahu této změny však nebyla považována za klinicky relevantní.
Podle očekávání zůstaly u účastníků léčených fyziologickým roztokem (tj. kontrolních účastníků) plazmatické hladiny NAD+ a metabolitů NAM a ADPR a metabolitů NAM, NMN a meNAM po dobu 8 h v podstatě nezměněny. Mezi 30 min a 6 h však byl pozorován zjevný pokles NAM, meNAM a ADPR, pravděpodobně v důsledku efektu ředění fyziologickým roztokem. V souladu s touto představou byl pozorován návrat hodnot těchto analytů k výchozím hodnotám po 8 h (tj, 2 h po ukončení infuze fyziologického roztoku).
Neočekávaně se však u účastníků, kterým byl podáván NAD+, plazmatické hladiny NAD+ nezvyšovaly až do doby po 2 h, kdy dosáhly maxima ~400 % nad výchozí hodnotou pro NAD+ a metabolity NAM, meNAM a ADPR (398 %, 409 %, 393 %, v tomto pořadí) až v době 6 h (obr. 1A-E). To bylo vnitřně konzistentní s vrcholem vylučování moči pro NAD+ i meNAM, který se rovněž objevil v 6 h a poté rychle klesal po ukončení infuze (obr. 2A-C).
NAD+ byl infundován konstantní rychlostí 3 μmol/min. Proto bylo každých 30 min infundováno 90 μmolů NAD+ přímo do cévního kompartmentu, což na konci infuze v 6 h přineslo celkem 1 080 μmolů. K intravaskulárnímu promíchání z jakéhokoli místa infuze dochází během ~ 2 min; za předpokladu průměrného objemu krve 5 by přidaný NAD+ při absenci významného metabolismu nebo absorpce odpovídal dodatečnému nárůstu (NAD+) nejméně o 18 μm, a to každých 30 min v průběhu 6 h infuze. Ačkoli nárůst tohoto rozsahu je v rámci analytických detekčních limitů této studie, nebyl pozorován žádný nárůst NAD+ ani jeho metabolitů až po 2 hodinách (tj. v časovém bodě 6 hodin) ani v plazmě, ani v moči. Toto neočekávané pozorování svědčí o rychlém a přinejmenším v prvních 2 hodinách úplném vychytávání a/nebo metabolismu NAD+ a/nebo jeho metabolitů ve tkáních.
Účinného katabolismu NAD+ může dosáhnout řada enzymů, včetně sirtuinů (SIRT 1-7) adenosin difosfát (ADP)-ribosa transferáz (ART) a poly(ADP-ribosa) polymeráz (PARP 1-17) a cyklických ADP-ribosa (cADPR) syntáz (CD38, CD157). Extracelulární NAD+ pyrofosfatázy přítomné v lidském séru mohou rovněž degradovat NAD+ na AMP a NMN (Schmidt-Brauns et al., 2001). Protein CD73 na buněčném povrchu také přeměňuje NMN na NR, který snadno prochází buněčnými membránami pro potenciální resyntézu na NAD+. Důležité je, že glykohydrolázy katabolizující NAD+, CD38 a CD157, ektonukleotid pyrofosfatáza (CD203a) a katabolizátor NMN CD73 jsou ektoenzymy, které se nacházejí na široké škále buněk včetně lymfoidních, granulocytárních, neuronálních a endoteliálních buněk (Wei et al., 2014) a mohou být přítomny i plazmatické rozpustné NAD glykohydrolázy (obr. 3; Funaro et al., 2009). Paralelní vzestup plazmatických NAM a ADPR (korelační koeficient 1,000, p < 0,001, údaje nejsou uvedeny) silně naznačuje, že přinejmenším do 6 h je hlavním osudem NAD+ metabolismus prostřednictvím štěpení glykosidické vazby ADPribóza-nikotinamid na NAM a ADPR, vedlejší produkty příznačné pro aktivitu NAD glykohydrolázy (např. CD38). To je v souladu s důkazy jiných autorů, kde bylo prokázáno, že zejména CD38 má primární úlohu při kontrole extracelulárních hladin NAD+ (Wei et al., 2014). Dospělé lidské erytrocyty jsou CD38 pozitivní a exprimují vysoké hladiny aktivity NAD+ glykohydrolázy, která štěpí exogenní NAD+ a dodává erytrocytům ADP ribózu, která může být účinně přijata do buňky (Kim et al., 1993; Albeniz et al., 2004). Absence jakéhokoli vzestupu NAD+ nebo metabolitů v plazmě nebo moči až po prvních 2 hodinách infuze naznačuje, že NAD+ a/nebo jeho metabolity jsou v tomto časovém období transportovány z extracelulárního cévního prostoru a účinně sekvestrovány do tkání nebo extravaskulárních kompartmentů jako NAD+ a/nebo jeho metabolity.

Obrázek 3. Potenciální extracelulární katabolismus exogenně dodaného NAD+ prostřednictvím aktivity ektoenzymů CD38 (ADP-ribóza (ADPR) syntáza), CD203a (NAD+ pyrofosfatáza), CD 73 (5′-nukleotidáza), CD157-ADP-ribosylcykláza 2. Zkratky: NAM, nikotinamid; NMN, nikotinamid mononukleotid; ADPR, adenosin difosfát ribosid; meNAM, methyl nikotinamid; 4PY, N-methyl-4-pyridon-3-karboxamid; 2PY, methyl-2-pyridon-5-karboxamid; ARPP, ADP ribóza pyrofosfatáza; RPPK, ribosylpyrofosfokináza; NAmpt, nikotinamidfosforibosyltransferáza; NMNAT, nikotinamidmononukleotidadenyltransferáza; CX-43, konexin 43.
Přestože se PARP a sirtuiny podílejí na katabolismu NAD+, jako intracelulární enzymy se zástupci v cytoplazmě, jádře a mitochondriích pravděpodobně přímo neovlivňují extracelulární hladiny NAD+. Lze však očekávat, že tyto enzymy budou reagovat na změny intracelulárních koncentrací NAD+, NAM a NR, které mohou vzniknout v důsledku exogenně dodávaného NAD+. Obrázek 4 schematicky shrnuje možné osudy exogenního NAD+.
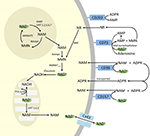
Obrázek 4. Potenciální nitrobuněčný a mimobuněčný osud exogenně dodaného NAD+. Zkratky: CD38 , CD203a (NAD+ pyrofosfatáza), CD 73 (5′-nukleotidáza). NAM, nikotinamid; NMN, nikotinamid mononukleotid; ADPR, adenosindifosfát ribosid; meNAM, methylnikotinamid; 4PY, N-methyl-4-pyridon-3-karboxamid; 2PY, methyl-2-pyridon-5-karboxamid; ARPP, ADP ribose pyrophosphatase; RPPK, ribosyl pyrophosphokinase; NAmpt, nicotinamide phosphoribosyltransferrase; NMNAT, nicotinamide mononucleotideadenyltransferase; PARP ; NRK .
Přestože existuje značná kapacita pro rychlou degradaci exogenně dodaného IV NAD+ na složkové metabolity, je třeba také poznamenat, že může docházet také k vychytávání extracelulárního NAD+. Protože NAD+ má celkově záporný náboj, nemůže pasivně procházet buněčnými membránami, a proto musí být přes membránu aktivně transportován. To, že k tomu dochází, prokázala řada výzkumníků, kteří uvedli, že exogenní NAD+ aplikovaný na různé typy lidských buněk skutečně vede k významnému zvýšení intracelulárního NAD+ (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Ačkoli mechanismus (mechanismy), které se na tom podílejí, nejsou dosud plně charakterizovány, Alano et al. (2010) uvedli, že exogenní NAD+ může vstupovat do neuronů prostřednictvím kanálů s branami P2X7, a jiní důsledně pozorovali transport NAD+ přes membrány pomocí hemikanálů connexinu 43 (CX43), a to i při koncentracích pouhých 250 pM (Billington et al., 2008). Vzhledem k tomu, že konexiny jsou široce rozšířeny v lidských tkáních a CX43 se zdá být nejrozšířenějším konexinem v mnoha typech buněk, nelze vyloučit možnost rychlého příjmu NAD+.
Zdá se tedy, že buněčný příjem a/nebo metabolismus NAD+ a metabolitů NAM a ADPR a sekundárních metabolitů meNAM a NMN probíhá rychlostí infuze NAD+ 3 μmol/min po dobu nejméně prvních 2 h. Buď je NAD+ a/nebo testované primární metabolity během tohoto prvního období 2-6 h účinně sekvestrovány, nebo se tvoří i sekundární metabolity. ADPR může být recyklován za účelem výroby NAD+ z NAM (obr. 4) nebo dále metabolizován prostřednictvím ektoenzymů, jako je CD203a (NAD+ pyrofosfatáza), za vzniku AMP, který může být dále rychle metabolizován na adenosin pomocí CD73 a 5′-nukleotidázy (Bogan a Brenner, 2010; Horenstein a kol., 2016; Morandi a kol., 2018). Na podporu této hypotézy bylo jinými subjekty rozpoznáno zvýšení hladiny adenosinu v krvi jako důsledek extracelulární infuze NAD+ (Szczepañska-Konkel et al., 2003). NAM může být také metabolizován na NMN cestou salvage před resyntézou na NAD+ (obr. 3, 4) nebo na něj působí jaterní methyltransferázy za vzniku N1-methylnikotinamidu, který může být buď přímo vyloučen, nebo dále přeměněn na N-methyl-2-pyridon-5-karboxamid (2PY, +99 % meNAM) a N-methyl-4-pyridon-3-karboxamid (4PY, ~0.25 % meNAM) před vylučováním (Shibata a Matsuo, 1989; Okamoto et al.,
Je zřejmé, že při použitém dávkovacím režimu dosáhly mechanismy podílející se na metabolismu a sekvestraci NAD+ a metabolitů nasycení někdy po 2 hodinách, což vedlo k významnému zvýšení plazmatického NAD+ a akumulaci všech testovaných metabolitů (NMA, ADPR, meNAM a NMN) po 6 hodinách. Jak již bylo uvedeno, tyto údaje podporují názor, že jednou z hlavních cest metabolismu NAD+ za těchto podmínek je štěpení glykosidické vazby ektoenzymy, jako je CD38, za vzniku NAM a ADPR. Vzestup NMN v plazmě po 2 hodinách však také naznačuje, že na exogenní NAD+ pravděpodobně působí extracelulární NAD+ pyrofosfatázy, které zvyšují NMN v plazmě a uvolňují AMP jako další metabolit.
Shrnem tato studie poprvé odhalila, že: (a) při průtoku 3 μmol/min byl veškerý exogenně podaný NAD+ rychle a úplně odstraněn z plazmy nejméně po dobu prvních 2 hodin; (b) zvýšení analyzovaných metabolických bioproduktů odpovídá aktivitě NAD+ glykohydroláz a NAD+ pyrofosfatáz; a (c) produkty vylučování močí vznikající při infuzi NAD+ zahrnují nativní NAD+ a meNAM, ale nikoli NAM.
Ačkoli jsou výsledky tohoto šetření nové a do jisté míry přispívají k lepšímu pochopení časového osudu exogenního NAD+ u lidí, byla zjištěna omezení. Pro zlepšení celkového metabolického přepočtu by budoucí studie měly zkoumat změny NAD+ a metabolitů v červených krvinkách a vylučování sekundárních metabolitů meNAM, 2PY a 4PY, močí. Kromě toho bude pravděpodobně užitečné posoudit vliv exogenního NAD+ na změny purinového metabolismu, což by mělo zahrnovat alespoň posouzení AMP a adenosinu v plazmě a červených krvinkách. Použití zvířecích modelů může také pomoci objasnit relativní zapojení různých metabolických drah pomocí vhodných farmakologických inhibitorů a odběru vzorků tkání.
Závěrem lze říci, že tato studie poprvé odhalila některé velmi užitečné, dříve neznámé informace o osudu exogenního IV NAD+ u lidí, včetně celkové bezpečnosti a snášenlivosti IV infuze NAD+ rychlostí 3 μmol/min, rychlé sekvestraci NAD+ z plazmy, pravděpodobném podílu NAD+ glykohydrolázy i NAD+ pyrofosfátové aktivity na metabolismu NAD+ a zjevně účinné renální tubulární reabsorpci NAM. K úplnému odhalení složitého metabolického osudu této důležité molekuly je však zapotřebí dalšího výzkumu. Charakterizace těchto změn dále pomůže pokročit ve vývoji a zdokonalení léčebných režimů založených na NAD+ u poruch, u nichž je pravděpodobné, že jim zvýšená dostupnost NAD+ prospěje, včetně stavů vyžadujících zvýšenou buněčnou regeneraci a opravu, jako je Alzheimerova choroba a další neurodegenerativní demence.
Dostupnost dat
Soubory dat vytvořené pro tuto studii jsou k dispozici na vyžádání u odpovídajícího autora.
Etické prohlášení
Studie zahrnující lidské účastníky byly přezkoumány a schváleny Institucionální kontrolní radou William Carey University, Hattiesburg, MS (protokol č. 2017-12). Pacienti/účastníci poskytli písemný informovaný souhlas s účastí v této studii.
Příspěvky autorů
RG se podílel na návrhu a dohledu nad studií, kritické diskusi a autorství rukopisu. JBer se podílel na návrhu studie, kritické diskusi, sběru dat, statistické analýze, přípravě rukopisu a recenzi rukopisu. RM se podílel na návrhu studie, kritické diskusi, klinickém dohledu a recenzi rukopisu. NB se podílel na biochemické analýze a recenzi rukopisu. JW se podílel na návrhu studie, kritické diskusi a recenzi rukopisu. JBen se podílel na sběru dat a recenzi rukopisu. SB se podílel na návrhu studie a recenzi rukopisu. Všichni autoři zkontrolovali, přečetli a schválili konečnou verzi rukopisu a souhlasí s pořadím prezentace autorů.
Financování
Tato studie byla společně financována společností NAD+ Research Inc, (LA, USA) a Australasian Research Institute Incorporation (Sydney, Austrálie) a byla provedena ve Springfield Wellness Center, Springfield, LA, USA.
Prohlášení o střetu zájmů
RM je ředitelem společnosti NAD+ Research Inc. a lékařským ředitelem Springfield Wellness Center, které používá IV NAD jako klinickou terapii. SB obdržel od společnosti NAD+ Research Inc. honorář za konzultace.
Ostatní autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Chceme poděkovat společnosti Archway Apothecary Pty Limited, LA, USA za bezplatné dodání IV NAD+ pro tento projekt.
Abeti, R., a Duchen, M. R. (2012). Aktivace PARP oxidačním stresem vyvolaným β-amyloidem: důsledky pro Alzheimerovu chorobu. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Otevřená nerandomizovaná studie farmakokinetiky doplňku stravy nikotinamid ribosid (NR) a jeho vlivu na hladiny NAD+ v krvi u zdravých dobrovolníků. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). Vyčerpání NAD+ je nezbytné a postačující pro smrt neuronů zprostředkovanou PARP-1. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). Aktivity NAD glykohydrolázy a vychytávání adp-ribózy v erytrocytech normálních jedinců a pacientů s rakovinou. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Charakterizace příjmu NAD+ v savčích buňkách. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nukleotidázy a jejich nové role v metabolismu NAD+ a fosfátů. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Změny metabolismu NAD+ související s věkem, oxidační stres a aktivita sirt1 u potkanů wistar. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Mapování metabolismu NAD+ v mozku stárnoucích potkanů Wistar: potenciální cíle pro ovlivnění stárnutí mozku. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Kvantifikace buněčného metabolomu NAD+ pomocí přístupu tandemové kapalinové chromatografie s hmotnostní spektrometrií. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). Plazmatický metabolom NAD+ je při „normálním“ stárnutí dysregulován. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Role endoteliálního nedostatku NAD+ v cévní dysfunkci související s věkem. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., and Milbrandt, J. (2017). Doména receptoru SARM1 toll/interleukin-1 má vnitřní aktivitu štěpení NAD+, která podporuje patologickou axonální degeneraci. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., and Chiarugi, A. (2013). Nahlédnutí do molekulárních a funkčních vlastností NMNAT3 odhaluje nové náznaky homeostázy NAD v lidských mitochondriích. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ektoenzymy a vrozená imunita: úloha lidského CD157 v pohybu leukocytů. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). The etiology of Pellagra: the significance of certain epidemiological observations with respect to them. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Změny oxidačního poškození, zánětu a s věkem v mozkomíšním moku. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenosin generovaný v nice kostní dřeně cestou zprostředkovanou CD38 koreluje s progresí lidského myelomu. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). Účinek nikotinamidmononukleotidu na deficity mozkové mitochondriální respirace u myšího modelu odpovídajícího Alzheimerově chorobě. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Věkem podmíněné změny oxidačního stresu a metabolismu NAD+ v lidské tkáni. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Závislost Temná noc duše, NAD+ světlo naděje. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Dlouhodobé podávání nikotinamidmononukleotidu zmírňuje fyziologický úpadek spojený s věkem u myší. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). Úloha tvorby extracelulárního adenosinu v rozvoji autoimunitních onemocnění. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN v prevenci, diagnostice a léčbě drogových závislostí. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Diurnální variace vylučování katabolitů nikotinamidu močí u lidí: vliv stresu na metabolismus nikotinamidu. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., and Gupta, M. P. (2005). Poly(ADP-ribóza) polymeráza-1-dependentní smrt buněk srdečních myocytů během srdečního selhání je zprostředkována vyčerpáním NAD+ a sníženou aktivitou Sir2α deacetylázy. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Farmakologické účinky exogenního NAD na mitochondriální bioenergetiku, opravu DNA a apoptózu. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., and Reidl, J. (2001). Je pyrofosfatázová aktivita NAD nezbytná pro množení Haemophilus influenzae typu b v krevním řečišti? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., and Matsuo, H. (1989). Korelace mezi příjmem niacinového ekvivalentu a vylučováním jeho metabolitů, N‘-methylnikotinamidu, N‘-methyl-2-pyridon-5-karboxamidu a N‘-methyl-4-pyridon-3-karboxamidu, močí u lidí konzumujících samovolně vybrané potraviny. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Signalizace oxidativního stresu u Alzheimerovy choroby. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). Renální hemodynamika a natriuretické reakce na intravenózní podání diadenosintetrafosfátu (ap4a) a nikotinamidadenindinukleotidu (NAD) u potkanů. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). Role a mechanismy signální dráhy CD38/cyklická adenosindifosfátová ribóza/Ca2+. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). Zdroje a důsledky redoxní nerovnováhy NADH/NAD+ u diabetu a jeho komplikací. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., and Tsuchiya, M. (2006). Současné měření nikotinamidadenindinukleotidu a příbuzných sloučenin pomocí kapalinové chromatografie/elektrosprejové ionizační tandemové hmotnostní spektrometrie. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Role NAD+, PARP-1 a sirtuinů v buněčné smrti, ischemickém poškození mozku a poškození tkání vyvolaném synchrotronovým zářením. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). Doplnění NAD+ zabraňuje glykolytické blokádě vyvolané PARP-1 a buněčné smrti v kultivovaných myších astrocytech. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Oxidační stres a NAD+ při ischemickém poškození mozku: současný pokrok a budoucí perspektivy. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). Meziprodukty NAD+: biologie a terapeutický potenciál NMN a NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). Nikotinamid mononukleotid, klíčový meziprodukt NAD+, léčí patofyziologii diabetu vyvolaného dietou a věkem u myší. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Neuronální smrt vyvolaná chybně složeným prionovým proteinem je způsobena vyčerpáním NAD+ a může být zmírněna in vitro a in vivo doplněním NAD+. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). NADH může vstupovat do astrocytů a blokovat smrt astrocytů zprostředkovanou PARP-1. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., and Perry, G. (2007). Příčiny oxidačního stresu u Alzheimerovy choroby. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar
.