- Introduction
- Matériels et méthodes
- Participants
- Normalisation du régime
- Protocole de perfusion
- Collecte d’échantillons sanguins
- Collecte d’échantillons d’urine
- Méthode analytique
- Sécurité
- Analyse statistique
- Ethique
- Résultats
- Sécurité
- Plasma
- Urine
- Discussion
- Data Availability
- Ethics Statement
- Contributions des auteurs
- Financement
- Déclaration de conflit d’intérêts
- Remerciements
Introduction
Le nucléotide pyridine parent, le nicotinamide adénine dinucléotide (NAD+) est présent dans toutes les cellules du corps et est essentiel pour la viabilité et la fonction cellulaire.
En tant que cofacteur responsable du transport des électrons dans la chaîne respiratoire, le NAD+ et son couple redox NADH sont au cœur de la production d’énergie (ATP) dans la mitochondrie via la phosphorylation oxydative. Le métabolite phosphorylé du NAD+, le NADP+, avec son couple redox NADPH, fournit également le pouvoir réducteur nécessaire à un certain nombre de réactions anaboliques, notamment la synthèse du cholestérol et des acides nucléiques, l’élongation des acides gras et la régénération du glutathion (GSH), l’un des principaux antioxydants de l’organisme. Dans l’ensemble, cette famille de nucléotides pyridine contribue à l’échange redox de plus de 400 réactions enzymatiques. Il est important de noter que lorsqu’il agit comme un couple redox, le NAD+ n’est pas consommé. Cependant, le NAD+ sert également de substrat pour un certain nombre d’autres processus métaboliques importants et est donc consommé à la suite de leurs réactions chimiques, ce qui peut épuiser le tissu en NAD+. Parmi ces processus figurent les réactions pilotées par la famille d’enzymes poly adénosine phosphoribose-ribose (ADPR) (PARP 1-17) qui contrôlent la réparation de l’ADN et la stabilité nucléaire, les enzymes de contrôle épigénétique (Sirt1-7), la communication immunitaire intercellulaire (CD38/CD157) et la régénération neuronale (SARM1 ; Essuman et al., 2017). Il existe donc un potentiel de perturbation du métabolisme cellulaire à de multiples niveaux dans des conditions où la consommation de NAD+ par ces enzymes dépasse l’approvisionnement ou la synthèse de NAD+.
L’importance clinique du maintien des niveaux de NAD+ cellulaires a été établie au début du siècle dernier avec la découverte que la pellagre, une maladie caractérisée par la diarrhée, la dermatite, la démence et la mort, pouvait être guérie avec des aliments contenant le précurseur du NAD+, la niacine (également connue sous le nom de vitamine B3 ; Goldberger, 1914). Bien que la pellagre soit rare dans les pays développés, il a été démontré que les concentrations cellulaires de NAD+ diminuent dans des conditions de dommages oxydatifs accrus, comme c’est le cas lors du vieillissement (Braidy et al., 2011 ; Massudi et al., 2012 ; Guest et al., 2014). On a constaté que des niveaux altérés de NAD+ accompagnent plusieurs troubles associés à des dommages oxydatifs/radicalaires accrus, notamment le diabète (Wu et al., 2016), les maladies cardiaques (Pillai et al., 2005), le dysfonctionnement vasculaire lié à l’âge (Csiszar et al., 2019), les lésions cérébrales ischémiques (Ying et Xiong, 2010), les protéines neuronales mal repliées (Zhou et al, 2015) et la démence d’Alzheimer (Abeti et Duchen, 2012).
En plus des caractéristiques pathologiques des plaques Aβ et des enchevêtrements neurofibrillaires de tau, les dommages oxydatifs sont une constatation constante dans la maladie d’Alzheimer et sont largement reconnus comme un événement précoce dans le processus pathogène, précédant même le dépôt d’Aβ (Su et al., 2008). Bien que les espèces réactives de l’oxygène (ROS) à l’origine de ces dommages proviennent probablement de sources multiples, on pense que les mitochondries dysfonctionnelles et la disponibilité de métaux redox actifs tels que Fe++ et Cu+ jouent un rôle dominant (Zhua et al., 2007).
Une conséquence majeure du stress oxydatif cellulaire, dans le cerveau et ailleurs, sont les cassures simple ou double brin de l’ADN. En réponse aux lésions de l’ADN, PARP1 hydrolyse le NAD+ pour produire des polymères d’ADP-ribose (Ying, 2013). Nous avons montré précédemment que les niveaux de NAD+ étaient inversement corrélés aux mesures du stress oxydatif dans les tissus humains (Massudi et al., 2012) et dans le cerveau du rat (Braidy et al., 2014). Ainsi, alors que les niveaux réduits de NAD+ dans le cerveau des personnes atteintes de la maladie d’Alzheimer attendent d’être confirmés par des techniques non invasives, les résultats cohérents de dommages oxydatifs dans le cerveau post-mortem soutiennent fortement l’idée que le renouvellement accéléré et l’épuisement du NAD+ contribuent au dysfonctionnement neurologique de cette maladie. Étant donné que les interventions visant à restaurer le NAD+ se sont avérées, dans des modèles animaux, favorables à un vieillissement sain et à une amélioration de la fonction métabolique (Yoshino et al., 2011 ; Mills et al., 2016) et de la démence (Long et al., 2015), les stratégies visant à augmenter les niveaux de NAD+ chez l’homme sont activement explorées.
La méthode la plus directe pour augmenter les niveaux de NAD+ est l’administration intraveineuse (IV). Bien que les données issues de la recherche expérimentale soient minimes, le bénéfice clinique significatif de la perfusion IV de NAD+ dans le cadre du sevrage alcoolique a été précédemment rapporté (O’Holleran, 1961 ; Mestayer, 2019). Étonnamment, alors que l’administration orale de précurseurs du NAD+ tels que le riboside de nicotinamide (NR) ou le mononucléotide de nicotinamide (NMN) est étudiée avec enthousiasme pour son impact sur les niveaux de NAD+ (Yoshino et al., 2011, 2018 ; Mills et al., 2016 ; Airhart et al., 2017), le devenir métabolique et les propriétés pharmacocinétiques de l’administration IV de NAD+ n’ont pas encore été rapportés chez l’homme. Cette étude présente donc pour la première fois les changements dans les concentrations de NAD+ et de ses métabolites au cours d’une perfusion IV de NAD+ dans une cohorte de participants masculins en bonne santé.
Matériels et méthodes
Participants
Onze (Test n = 8, Contrôle n = 3) participants masculins âgés de 30 à 55 ans ont été recrutés via des publicités à la radio, à la télévision et dans les médias sociaux. Tous les participants avaient un IMC inférieur à 30 kg/m2 (IMC moyen du groupe test = 27,5 ± 2,5 kg/m2 ; IMC moyen du groupe témoin = 24,6 ± 6,5 kg/m2), n’étaient pas diabétiques, fumaient moins d’une cigarette et consommaient moins de deux boissons alcoolisées standard par jour. Les personnes prenant des médicaments hypolipidémiants ou anti-inflammatoires, ayant des antécédents d’insuffisance hépatique ou rénale ou ayant récemment subi une infection microbienne, un traumatisme ou tout autre trouble médical important ou non traité étaient exclues de l’étude. Les sujets ont reçu une compensation monétaire pour leur temps et leur participation, qu’ils aient ou non terminé l’expérience. Les participants n’étaient pas autorisés à utiliser des produits de santé naturels contenant du NAD+, du NR ou de la nicotinamide dans les 14 jours précédant et pendant le déroulement de l’étude.
Normalisation du régime
Le jour précédant la perfusion IV de NAD+, les participants ont consommé un régime identique réduit en niacine et n’ont bu que de l’eau.
Aucune nourriture n’a été consommée le jour de l’étude jusqu’à ce que le dernier échantillon de sang/urine de 8 heures ait été collecté. Les participants étaient encouragés à boire de l’eau pour rester normalement hydratés. Aucun autre type de boisson n’était autorisé.
Pour garantir le maintien d’un apport énergétique adéquat pour les participants pendant les 6 h de perfusion, la solution intraveineuse contenait également 0,1 % de dextrose, fournissant environ 2 000 calories sur la période de perfusion de 6 h.
Protocole de perfusion
Les participants ont été randomisés dans le groupe test (n = 8) ou le groupe témoin (n = 3). Les participants du groupe Test ont reçu par voie intraveineuse 750 mg de NAD+ dans du sérum physiologique (Archway Apothecary, Covington, LA, USA) sur une période de 6 h (vitesse de perfusion = ~2 mg/min ≡ 3 μmoles/min). Ce dosage de NAD+ a été dérivé de manière empirique et reflète un schéma de dosage courant dans les cliniques (par exemple, Springfield Wellness Clinic, Springfield, LA, USA) qui fournissent régulièrement des perfusions IV de NAD+ dans la pratique clinique. Les participants du groupe témoin ont reçu par voie intraveineuse une solution saline normale sur une période de 6 h.
L’administration clinique et la supervision des perfusions IV et du prélèvement des échantillons ont été effectuées au Springfield Wellness Center, Springfield, LA, USA.
Collecte d’échantillons sanguins
Des échantillons sanguins de base (TO) ont été prélevés sur tous les participants après une nuit de jeûne de 12 h chronométrée pour se produire immédiatement avant le début de la perfusion. Des échantillons supplémentaires ont ensuite été prélevés à 30, 60, 120 (2 h), 360 (6 h) et 480 (8 h) minutes après le début de la perfusion.
Le sang total a été prélevé par ponction veineuse standard (bras opposé au site de perfusion) dans un tube hépariné sans gel de 5 ml. Immédiatement après le prélèvement, le sang a été centrifugé à 4°C pendant 10 min à 1 409× g.
Les fractions plasmatiques et érythrocytaires ont été immédiatement séparées et réparties en 5 × 500 μL aliquotes chacune. Toutes les aliquotes ont ensuite été immédiatement congelées et conservées à -80°C jusqu’à l’analyse.
Collecte d’échantillons d’urine
Après la collecte d’un échantillon d’urine de base à mi-course, les participants ont été invités à évacuer toute l’urine dans le ou les réceptacles prévus à cet effet à 30 min, 2 h, 6 h et 8 h après le début de la perfusion de NAD+. Si les participants avaient besoin d’uriner par intermittence entre ces points de temps, ils étaient invités à le faire dans le réceptacle suivant. Tous les échantillons ont été aliquotés et stockés à -80°C dès leur réception.
Méthode analytique
Séparation chromatographique du NAD+ et des métabolites associés et détection par MS La chromatographie liquide couplée à la spectrométrie de masse en tandem (LC/MS/MS) a été réalisée à l’aide d’un spectromètre de masse Sciex QTRAP 5500 (Sciex, Redwood City, CA, USA) comme décrit précédemment (Clement et al., 2018). Brièvement, 100 μL de plasma ou d’urine humaine ont été extraits dans 400 μL de méthanol glacé, centrifugés à 4°C pendant 10 min, et filtrés à travers des cartouches à membrane de 3 kDa. Les extraits d’échantillons ont été séchés sous vide, reconstitués dans 200 μL de tampon NH4OAc 100 mM et transférés dans des flacons en verre de 200 μL et bouchés avant l’analyse LC/MS/MS. Les standards et les échantillons (20 μL) ont été injectés sur une colonne Phenomenex NH2 (150 mm- 2 mm- 3 mm) comme décrit précédemment. Un gradient de solvant binaire composé de 5 mM NH4OAc pH 9,5 ajusté avec de l’ammoniac (phase mobile A) et d’acétonitrile (phase mobile B) avec un débit de 250 μL/min a été utilisé. La composition initiale du solvant à l’injection était de 25 % A, suivie d’un gradient de 2 minutes à 45 % A et d’une rampe de gradient rapide à 80 % A (0,1 min) qui a été maintenue pendant 5,9 min, A a été augmenté à nouveau à 95 % (2 min), maintenu pendant 13 min, puis ramené aux conditions initiales (0,1 min) pour l’équilibrage, avec une durée d’exécution totale de 30 min. Le flux de la colonne a été dirigé vers le détecteur MS. Les courbes d’étalonnage des métabolites individuels ont été construites en utilisant les rapports de surface de pic (surface de pic du métabolite divisée par la surface de pic du SI sélectionné) de chaque calibrateur en fonction de sa concentration.
Les standards internes étaient constitués de 2H2NAM (pour le NAM, le méthylNAM et l’ADPR) et de 13C5;-Cyclic AMP (pour le NMN et le NAD+). Il convient de noter que, comme les marqueurs isotopiques ne sont pas disponibles dans le commerce pour tous les métabolites du NAD, une molécule étroitement apparentée (analogue structurel) peut également être utilisée (Yamada et al., 2006), à condition qu’elle soit jugée d’une stabilité et d’une efficacité d’ionisation similaires pendant l’analyse. Les normes internes sélectionnées dans cette étude ont été précédemment optimisées pour le métabolite apparenté (Bustamante et al., 2017).
Sécurité
La sécurité du NAD+ IV a été évaluée à l’aide de tests de la fonction hépatique et de l’observation clinique de tout événement indésirable. Les tests de la fonction hépatique comprenaient le sérum, la bilirubine totale (bili), la phosphatase alcaline (ALP), l’alanine aminotransférase (ALT), la gamma glutamyl transférase (GGT), la lactate déshydrogénase (LD) et l’aspartate aminotransférase (AST).
Analyse statistique
L’analyse statistique a été complétée en utilisant SPSS version 24 et GraphPad Prism version 8 pour windows. Une ANOVA à deux voies à moyennes non pondérées avec test post hoc de comparaison multiple de Bonferroni a été utilisée pour déterminer si la concentration moyenne des analystes testés était différente sur la période de 8 h et entre les groupes Test et Contrôle. Le test des rangs signés de Wilcoxon a été utilisé pour déterminer si les différences dans les concentrations moyennes des tests de la fonction hépatique étaient significatives entre le point de départ et les points de temps de 8 heures. Les différences ont été considérées comme statistiquement significatives lorsque p < 0,05.
Ethique
Cette étude a été réalisée conformément au Code d’éthique de l’Association médicale mondiale (Déclaration d’Helsinki) pour les expériences impliquant des humains. L’approbation éthique a été obtenue auprès du conseil d’examen institutionnel de l’Université William Carey, Hattiesburg, MS (protocole #2017-12). Le consentement éclairé a été obtenu de tous les participants.
Résultats
Sécurité
Aucun événement indésirable n’a été observé pendant la perfusion de 6 h avec les cohortes placebo (solution saline) ou test (NAD+).
Une diminution significative de l’activité (1,3, 57, 3,6 unités/L) pour les enzymes de la fonction hépatique GGT, LD et AST, respectivement, a été observée 8 h après le début de la perfusion de NAD+ (tableau 1). Aucun changement significatif de l’activité des marqueurs de la fonction hépatique n’était apparent à 8 heures dans les échantillons traités par placebo (solution saline), mais le faible nombre d’échantillons peut réduire la sensibilité de la discrimination. Une augmentation significative de 2,75 μmoles/L de la bilirubine plasmatique a également été observée. Cependant, aucun de ces changements n’a été considéré comme cliniquement significatif.

Tableau 1. Le test des rangs signés de Wilcoxon a été utilisé pour déterminer si les différences dans les concentrations moyennes des tests de la fonction hépatique étaient significatives entre le point de départ et les points de temps de 8 h.
Plasma
Une perfusion continue de NAD+ à un taux de 3 μmoles/min a entraîné une augmentation significative (398 %) des niveaux de NAD+ dans le plasma uniquement au point de temps de 6 h (c’est-à-dire à la fin de la perfusion) par rapport au point de départ (p < 0,0001). Ce résultat était significativement différent du contrôle traité par une solution saline 6 h (p < 0,001).
Les niveaux de NAD+ sont restés élevés à 8 h (c’est-à-dire, 2 h après la perfusion) par rapport à la ligne de base et aux échantillons de contrôle traités par une solution saline.
Les niveaux de NAD+ plasmatique n’ont pas changé de manière significative par rapport à la ligne de base tout au long de la période d’évaluation de 8 h dans les échantillons de contrôle traités par une solution saline (Figure 1A).
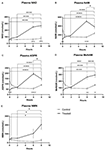
Figure 1. Changements dans le plasma du nicotinamide adénine dinucléotide (NAD+) et des métabolites sur 8 h . (A) NAD+, (B) Nicotinamide (NAM), (C) adénosine phosphoribose (ADPR), (D) méthyl nicotinamide (meNAM), (E) nicotinamide mononucléotide (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, comme indiqué. Une ANOVA à deux voies avec le test post hoc de comparaison multiple de Bonferroni a été utilisée pour déterminer si la concentration moyenne des analystes testés était différente sur la période de 8 h et entre les groupes Test (n = 8) et Témoin (n = 3).
Similairement aux changements observés pour le NAD+, les niveaux plasmatiques du métabolite NAD+, la nicotinamide (NAM), ont augmenté significativement de 409 % à la fin de la perfusion de NAD+ (c’est-à-dire, 6 h) par rapport à la ligne de base (p < 0,0001). Cela était également significativement différent du contrôle traité par une solution saline 6 h (p < 0,001).
Au point de temps 8 h (c’est-à-dire 2 h après la fin de la perfusion), les niveaux de NAM entre le contrôle et les groupes traités n’étaient plus significativement différents (p > 0,05).
Les niveaux de NAM pour les échantillons de contrôle traités par une solution saline n’ont pas changé significativement au cours de la période de 8 h (p > 0,05, Figure 1B).
Concordant avec les changements observés pour le NAM, les niveaux plasmatiques du métabolite NAD+ ADPR ont augmenté significativement de 393% à la fin de la perfusion de NAD+ (c’est-à-dire 6 h) par rapport à la ligne de base (p < 0,0001). Ceci était significativement différent du contrôle traité par une solution saline 6 h (p < 0,0001).
Au point temporel 8 h (c’est-à-dire 2 h après la fin de la perfusion), les niveaux d’ADPR sont restés 305% au-dessus de la ligne de base (p < 0,0001). Cependant, cela n’était pas significativement supérieur aux niveaux d’ADPR dans les échantillons de contrôle traités par une solution saline au même point temporel (p > 0,05).
Les niveaux d’ADPR pour les échantillons de contrôle traités par une solution saline n’ont pas changé de manière significative au cours de la période de 8 h (p > 0,05, figure 1C).
Une analyse de corrélation de Spearman entre les moyennes des groupes à travers les points de temps de 8 h pour les deux métabolites cataboliques NAD+, NAM et ADPR, a produit un coefficient de corrélation de 1,00 (p < 0.001).
De nouveau, conformément aux changements observés pour le NAM, les niveaux plasmatiques du métabolite du NAM, le méthyl-nicotinamide (meNAM) ont augmenté de manière significative à 350% à la fin de la perfusion de NAD+ (c’est-à-dire, 6 h) par rapport à la fois à la ligne de base (p < 0,0001) et au contrôle traité par une solution saline 6 h (p < 0,01).
Au point temporel 8 h (c’est-à-dire, 2 h après la fin de la perfusion), les niveaux de meNAM sont restés 393 % au-dessus de la ligne de base (p < 0,0001) et significativement plus élevés que les échantillons de contrôle traités par une solution saline au même moment (p < 0,05).
Les niveaux de NAMme pour les échantillons témoins traités par une solution saline n’ont pas changé de manière significative au cours de la période de 8 h (p > 0,05, Figure 1D).
Les niveaux plasmatiques de NMN, un métabolite de la NAM via la voie de récupération anabolique, étaient significativement élevés (472%) uniquement au point de temps de 8 h (c’est-à-dire, 2 h après la fin de la perfusion, p < 0,05).
Les niveaux de NMN pour les échantillons témoins traités par une solution saline n’ont pas changé de manière significative au cours de la période de 8 h (p > 0,05, Figure 1E).
Urine
La perfusion IV continue de NAD+ à un taux de 3 μmoles/min a entraîné une augmentation significative (538%) du taux d’excrétion urinaire de NAD+ au point de temps 6 h (c’est-à-dire, fin de la perfusion) par rapport à celle excrétée à 30 min (p < 0,001). Ce taux était également significativement différent de la quantité de NAD+ urinaire excrétée à 6 h par les témoins traités par une solution saline (p < 0,05).
La quantité de NAD+ excrétée dans l’urine a diminué de 43 % (p < 0,05) à 8 h (c’est-à-dire, 2 h après la perfusion) par rapport au pic d’excrétion au point de temps 6 h.
Le taux d’excrétion urinaire de NAD+ n’a pas changé de manière significative au cours de la période d’évaluation de 8 h dans les échantillons témoins traités par une solution saline (figure 2A).

Figure 2. Modifications du NAD+ et des métabolites urinaires sur 8 h (les 6 premières heures consistant en une perfusion IV continue de 3 μmoles/min de NAD+). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, comme indiqué. Une ANOVA à deux voies avec le test post hoc de comparaison multiple de Bonferroni a été utilisée pour déterminer si la concentration moyenne des analystes testés était différente sur la période de 8 h et entre les groupes Test (n = 8) et Contrôle (n = 3).
Le taux d’excrétion du métabolite NAD+ NAM n’a pas changé de manière significative au cours de la période de test de 8 h et n’était pas différent du taux d’excrétion de NAM observé pour les témoins traités par une solution saline (figure 2B).
Le taux d’excrétion urinaire du métabolite NAM meNAM a été significativement augmenté (403%) au point temporel de 6 h (c’est-à-dire, fin de la perfusion) par rapport à celui observé à 30 min (p < 0,01). La quantité de meNAM excrétée dans l’urine a diminué de 43 % (p < 0,05) à 8 h (c.-à-d, 2 h après la perfusion) par rapport au pic d’excrétion au point temporel de 6 h.
Le taux d’excrétion urinaire de la meNAM n’a pas changé de manière significative au cours de la période d’évaluation de 8 h chez les témoins traités par une solution saline (figure 2C).
Discussion
Un intérêt croissant pour les thérapies basées sur le NAD+, y compris les perfusions de NAD+, a mis en évidence la nécessité de mieux comprendre le devenir du NAD+ et de ses métabolites après l’administration IV. L’étude actuelle documente les changements dans les niveaux de NAD+ et des métabolites clés à la fois dans le plasma et l’urine sur 8 h en utilisant un schéma de dosage clinique typique de 750 mg de NAD+ administré par voie IV sur une période de 6 h.
Important de noter que la perfusion de NAD+ n’a produit aucun effet indésirable observable dans la cohorte testée, mais a plutôt réduit les activités plasmatiques des enzymes indicatrices du stress hépatique, telles que la LD et l’AST intra-hépatiques et l’enzyme GGT post-hépatique (canal biliaire), suggérant que l’intégrité du tissu intra-hépatique et post-hépatique a été améliorée, même dans le délai relativement court de 8 heures. L’augmentation de la bilirubine, un produit de dégradation des globules rouges, à 8 heures peut refléter soit une très faible augmentation du renouvellement des globules rouges, comme cela peut se produire en raison de l’hémolyse induite par la perfusion, soit une réduction du métabolisme de l’hème (tableau 1). Cependant, étant donné la très faible ampleur de ce changement, cela n’a pas été considéré comme cliniquement pertinent.
Comme prévu, chez les participants traités par une solution saline (c’est-à-dire le groupe témoin), les taux plasmatiques de NAD+ et des métabolites NAM et ADPR et des métabolites NAM, NMN et meNAM sont restés essentiellement inchangés pendant la période de 8 heures. Cependant, une diminution apparente du NAM, du meNAM et de l’ADPR a été observée entre 30 min et 6 h, très probablement en raison d’un effet de dilution saline. Conformément à cette notion, les valeurs de ces analytes sont revenues aux niveaux de base à 8 heures (c’est-à-dire 2 heures après la fin du traitement salin), Cependant, de manière inattendue, chez les participants ayant reçu une perfusion de NAD+, les taux plasmatiques de NAD+ n’ont pas augmenté avant le point de temps de 2 heures, atteignant un maximum de ~400% au-dessus de la ligne de base pour le NAD+ et les métabolites NAM, meNAM et ADPR (398%, 409%, 393%, respectivement) seulement au point de temps de 6 heures (Figures 1A-E). Cela était cohérent en interne avec le pic d’excrétion urinaire pour le NAD+ et le meNAM survenant également à 6 h avant de diminuer rapidement après la fin de la perfusion (figures 2A-C).
Le NAD+ a été perfusé à un taux constant de 3 μmoles/min. Par conséquent, 90 μmoles de NAD+ étaient perfusées directement dans le compartiment vasculaire toutes les 30 min, délivrant un total de 1 080 μmoles à la fin de la perfusion à 6 h. Le mélange intravasculaire à partir de n’importe quel point de la perfusion se produit en ~2 min ; en supposant un volume sanguin moyen de 5, le NAD+ ajouté, en l’absence de métabolisme ou d’absorption significatif, correspondrait à une augmentation supplémentaire de (NAD+) d’au moins 18 μM, toutes les 30 min pendant les 6 h de perfusion. Bien qu’une augmentation de cette ampleur soit bien en deçà des limites de détection analytique de cette étude, aucune augmentation du NAD+ ou de ses métabolites, n’a été observée avant 2 h (c’est-à-dire au point de temps de 6 h) dans le plasma ou l’urine. Cette observation inattendue indique une absorption et/ou un métabolisme tissulaire rapide, et pour au moins les 2 premières heures, complet du NAD+ et/ou de ses métabolites.
Un certain nombre d’enzymes peuvent réaliser un catabolisme efficace du NAD+, notamment les sirtuines (SIRTs 1-7), les adénosine diphosphate (ADP)-ribose transférases (ARTs) et les poly(ADP-ribose) polymérases (PARPs 1-17) et les ADP-ribose cycliques (cADPR) synthases (CD38, CD157). Les pyrophosphatases extracellulaires du NAD+ présentes dans le sérum humain peuvent également dégrader le NAD+ en AMP et NMN (Schmidt-Brauns et al., 2001). La protéine de surface CD73 convertit également le NMN en NR, qui traverse facilement les membranes cellulaires pour une resynthèse potentielle en NAD+. Il est important de noter que les glycohydrolases catabolisant le NAD+, CD38 et CD157, l’ecto-nucléotide pyrophosphatase (CD203a) et la protéine CD73 catabolisant le NMN sont des ectoenzymes présentes sur une grande variété de cellules, notamment les cellules lymphoïdes, granulocytaires, neuronales et endothéliales (Wei et al., 2014), et que des glycohydrolases NAD solubles dans le plasma peuvent également être présentes (figure 3 ; Funaro et al., 2009). L’augmentation parallèle de la NAM et de l’ADPR plasmatiques (coefficient de corrélation de 1,000, p < 0,001, données non présentées) suggère fortement qu’au moins à 6 heures, un destin majeur du NAD+ est le métabolisme par clivage de la liaison glycosidique ADPribose-nicotinamide en NAM et ADPR, sous-produits symptomatiques de l’activité de la NAD glycohydrolase (par exemple, CD38). Ceci est cohérent avec les preuves apportées par d’autres, où il a été démontré que CD38, en particulier, a un rôle primordial dans le contrôle des niveaux de NAD+ extracellulaire (Wei et al., 2014). Les érythrocytes humains adultes sont CD38 positifs et expriment des niveaux élevés d’activité NAD+ glycohydrolase, clivant le NAD+ exogène pour fournir aux érythrocytes de l’ADP ribose qui peut être efficacement absorbé dans la cellule (Kim et al., 1993 ; Albeniz et al., 2004). L’absence de toute augmentation du NAD+ ou de ses métabolites, dans le plasma ou l’urine, jusqu’après les 2 premières heures de la perfusion indique que le NAD+ et/ou ses métabolites font l’objet d’un trafic hors de l’espace vasculaire extracellulaire et sont efficacement séquestrés dans les compartiments tissulaires ou extravasculaires sous forme de NAD+ et/ou de ses métabolites pendant cette période.

Figure 3. Catabolisme extracellulaire potentiel du NAD+ fourni de manière exogène par l’activité des ectoenzymes CD38 (ADP-ribose (ADPR) synthase), CD203a (NAD+ pyrophosphatase), CD 73 (5′-nucléotidase), CD157-ADP-ribosyl cyclase 2. Abréviations : NAM, nicotinamide ; NMN, nicotinamide mononucléotide ; ADPR, adénosine diphosphate riboside ; meNAM, méthyl nicotinamide ; 4PY, N-méthyl-4-pyridone-3-carboxamide ; 2PY, méthyl-2-pyridone-5-carboxamide ; ARPP, ADP ribose pyrophosphatase ; RPPK, ribosyl pyrophosphokinase ; NAmpt, nicotinamide phosphoribosyltransférase ; NMNAT, nicotinamide mononucléotideadényltransférase ; CX-43, connexine 43.
Bien que la PARP et les sirtuines soient impliquées dans le catabolisme du NAD+, en tant qu’enzymes intracellulaires ayant des représentants dans le cytoplasme, le noyau et les mitochondries, il est peu probable qu’elles aient un impact direct sur les niveaux extracellulaires de NAD+. Cependant, on peut s’attendre à ce que ces enzymes répondent aux changements des concentrations intracellulaires de NAD+, NAM et NR qui peuvent résulter d’un apport exogène de NAD+. La figure 4 résume schématiquement les destins possibles du NAD+ exogène.
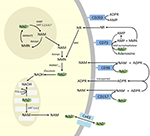
Figure 4. Destinations potentielles intra et extracellulaires du NAD+ apporté par voie exogène. Abréviations : CD38 , CD203a (NAD+ pyrophosphatase), CD 73 (5′-nucléotidase). NAM, nicotinamide ; NMN, nicotinamide mononucléotide ; ADPR, adénosine diphosphate riboside ; meNAM, méthyl nicotinamide ; 4PY, N-méthyl-4-pyridone-3-carboxamide ; 2PY, méthyl-2-pyridone-5-carboxamide ; ARPP, ADP ribose pyrophosphatase ; RPPK, ribosyl pyrophosphokinase ; NAmpt, nicotinamide phosphoribosyltransférase ; NMNAT, nicotinamide mononucléotideadényltransférase ; PARP ; NRK .
Alors qu’il existe une capacité significative de dégradation rapide du NAD+ IV fourni de manière exogène en métabolites constitutifs, il convient également de noter que l’absorption de NAD+ extracellulaire peut également avoir lieu. Le NAD+ ayant une charge globale négative, il ne peut pas traverser passivement les membranes cellulaires et doit donc être transporté activement à travers la membrane. Ce phénomène a été démontré par un certain nombre de chercheurs qui ont signalé que l’application de NAD+ exogène à divers types de cellules humaines entraîne effectivement une augmentation significative du NAD+ intracellulaire (Ying et al., 2003 ; Zhu et al., 2005 ; Billington et al., 2008 ; Pittelli et al., 2011 ; Felici et al., 2013). Bien que le ou les mécanismes impliqués ne soient pas encore entièrement caractérisés, Alano et al. (2010) ont signalé que le NAD+ exogène pouvait pénétrer dans les neurones par les canaux P2X7 et d’autres ont régulièrement observé le transport du NAD+ à travers les membranes par les hémichannels de la connexine 43 (CX43), même à des concentrations aussi faibles que 250 pM (Billington et al., 2008). Comme les connexines ont une large distribution dans les tissus humains et que la CX43 semble être la connexine la plus ubiquitaire dans de nombreux types de cellules, le potentiel d’absorption rapide du NAD+ ne peut être écarté.
Ainsi, l’absorption cellulaire et/ou le métabolisme du NAD+ et des métabolites NAM et ADPR et des métabolites secondaires meNAM et NMN semblent se dérouler au rythme de la perfusion de 3 μmoles/min de NAD+ pendant au moins les 2 premières heures. Soit le NAD+ et/ou les métabolites primaires testés sont efficacement séquestrés pendant cette première période de 2 à 6 heures, soit des métabolites secondaires sont également formés. L’ADPR peut être recyclé pour produire du NAD+ à partir du NAM (Figure 4) ou être métabolisé plus avant via des ectoenzymes comme CD203a (NAD+ pyrophosphatase) pour produire de l’AMP qui peut ensuite être rapidement métabolisé en adénosine par CD73 a 5′-nucléotidase (Bogan et Brenner, 2010 ; Horenstein et al., 2016 ; Morandi et al., 2018). À l’appui de cette hypothèse, une augmentation des niveaux d’adénosine dans le sang a été reconnue par d’autres comme une conséquence de la perfusion de NAD+ extracellulaire (Szczepañska-Konkel et al., 2003). Le NAM peut également être métabolisé en NMN par la voie de récupération avant d’être resynthétisé en NAD+ (Figures 3, 4) ou être traité par des méthyltransférases hépatiques pour produire du N1-méthylnicotinamide qui peut être excrété directement ou converti en N-méthyl-2-pyridone-5-carboxamide (2PY, +99% du meNAM) et en N-méthyl-4-pyridone-3-carboxamide (4PY, ~0.25% du meNAM) avant d’être excrété (Shibata et Matsuo, 1989 ; Okamoto et al, 2003).
Il est évident qu’avec le schéma posologique utilisé, les mécanismes impliqués dans le métabolisme et la séquestration du NAD+ et des métabolites ont atteint la saturation quelque temps après 2 h, ce qui a entraîné une élévation significative du NAD+ plasmatique et une accumulation de tous les métabolites testés (NMA, ADPR, meNAM et NMN) à 6 heures. Comme mentionné précédemment, ces données soutiennent l’idée que l’une des principales voies du métabolisme du NAD+ dans ces conditions est le clivage de la liaison glycosidique, par des ectoenzymes comme le CD38, pour produire le NAM et l’ADPR. Cependant, l’augmentation du NMN plasmatique après 2 h suggère également que le NAD+ exogène est probablement agi par des pyrophosphatases NAD+ extracellulaires, élevant le NMN plasmatique et libérant de l’AMP comme métabolite supplémentaire.
En résumé, cette étude a révélé pour la première fois que : (a) à un débit de 3 μmole/min, tout le NAD+ perfusé de manière exogène était rapidement et complètement éliminé du plasma pendant au moins les 2 premières heures ; (b) l’augmentation des bi-produits métaboliques analysés est cohérente avec les NAD+ glycohydrolases et l’activité de la NAD+ pyrophosphatase ; et (c) les produits d’excrétion urinaire découlant de la perfusion de NAD+ comprennent le NAD+ natif et le meNAM mais pas le NAM.
Bien que les résultats de cette enquête soient nouveaux et permettent d’avancer dans notre compréhension du devenir temporel du NAD+ exogène chez l’homme, des limites ont été identifiées. Pour améliorer le calcul métabolique global, les études futures devraient examiner les changements dans le NAD+ et les métabolites des globules rouges et l’excrétion urinaire des métabolites secondaires du meNAM, 2PY et 4PY. En outre, il sera probablement utile d’évaluer l’impact du NAD+ exogène sur les changements du métabolisme des purines, ce qui devrait inclure au moins une évaluation de l’AMP et de l’adénosine plasmatiques et érythrocytaires. L’utilisation de modèles animaux peut également aider à clarifier l’implication relative des différentes voies métaboliques grâce à l’utilisation d’inhibiteurs pharmacologiques appropriés et de prélèvements tissulaires.
En conclusion, cette étude a pu révéler pour la première fois des informations très utiles, jusqu’alors inconnues, sur le devenir du NAD+ exogène IV chez l’homme, notamment, la sécurité et la tolérabilité globales d’une perfusion IV de NAD+ à un taux de 3 μmoles/min, la séquestration rapide du NAD+ du plasma, la contribution probable de l’activité de la NAD+ glycohydrolase et du NAD+ pyrophosphate dans le métabolisme du NAD+ et la réabsorption tubulaire rénale apparemment efficace du NAM. Cependant, des recherches supplémentaires sont nécessaires pour révéler pleinement le destin métabolique complexe de cette importante molécule. En outre, la caractérisation de ces changements aidera à progresser dans le développement et l’amélioration des régimes de traitement basés sur le NAD+ pour les troubles qui sont susceptibles de bénéficier d’une disponibilité accrue du NAD+, y compris les conditions nécessitant une régénération et une réparation cellulaires accrues telles que la maladie d’Alzheimer et d’autres démences neurodégénératives.
Data Availability
Les ensembles de données générés pour cette étude sont disponibles sur demande à l’auteur correspondant.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le conseil d’examen institutionnel de l’Université William Carey, Hattiesburg, MS (protocole #2017-12). Les patients/participants ont fourni leur consentement éclairé écrit pour participer à cette étude.
Contributions des auteurs
RG a participé à la conception et à la supervision de l’étude, à la discussion critique et à la rédaction du manuscrit. JBer a participé à la conception de l’étude, à la discussion critique, à la collecte des données, à l’analyse statistique, à la rédaction du manuscrit et à la révision du manuscrit. RM a participé à la conception de l’étude, à la discussion critique, à la supervision clinique et à la révision du manuscrit. NB a participé à l’analyse biochimique et à la révision du manuscrit. JW a participé à la conception de l’étude, à la discussion critique et à la révision du manuscrit. JBen a participé à la collecte des données et à la révision du manuscrit. SB a participé à la conception de l’étude et à la révision du manuscrit. Tous les auteurs ont examiné, lu et approuvé la version finale du manuscrit, et sont d’accord avec l’ordre de présentation des auteurs.
Financement
Cette étude a été financée conjointement par le NAD+ Research Inc…, (LA, USA) et l’Australasian Research Institute Incorporation (Sydney, Australie) et a été menée au Springfield Wellness Center, Springfield, LA, USA.
Déclaration de conflit d’intérêts
RM est directeur de NAD+ Research Inc, et directeur médical du Springfield Wellness Center qui utilise le NAD IV comme thérapie clinique. SB a reçu des honoraires de consultation de NAD+ Research Inc.
Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à remercier Archway Apothecary Pty Limited, LA, USA pour leur fourniture gratuite de NAD+ IV pour ce projet.
Abeti, R., et Duchen, M. R. (2012). Activation de PARP par le stress oxydatif induit par la β-amyloïde : implications pour la maladie d’Alzheimer. Neurochem. Res. 37, 2589-2596. doi : 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Une étude ouverte et non randomisée de la pharmacocinétique du complément alimentaire nicotinamide riboside (NR) et de ses effets sur les taux sanguins de NAD+ chez des volontaires sains. PLoS One 12:e0186459. doi : 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., et Swanson, R. A. (2010). NAD+ depletion is necessary and sufficient for PARP-1 mediated neuronal death. J. Neurosci. 30, 2967-2978. doi : 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., et Bermek, E. (2004). Activités NAD glycohydrolase et absorption de l’adp-ribose dans les érythrocytes de sujets normaux et de patients atteints de cancer. Biosci. Rep. 24, 41-53. doi : 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Characterisation of NAD+ uptake in mammalian cells. J. Biol. Chem. 283, 6367-6374. doi : 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., et Brenner, C. (2010). 5′-nucléotidases et leurs nouveaux rôles dans le métabolisme du NAD+ et du phosphate. New J. Chem. 34, 845-853. doi : 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Age related changes in NAD+ metabolism oxidative stress and sirt1 activity in wistar rats. PLoS One 6:e19194. doi : 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Cartographie du métabolisme du NAD+ dans le cerveau des rats Wistar vieillissants : cibles potentielles pour influencer la sénescence du cerveau. Biogerontologie 15, 177-198. doi : 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Quantifier le métabolome cellulaire NAD+ en utilisant une approche de spectrométrie de masse par chromatographie liquide en tandem. Metabolomics 14:15. doi : 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., et Braidy, N. (2018). Le métabolome NAD+ plasmatique est dysrégulé dans le vieillissement « normal ». Rejuvenation Res. 22, 121-130. doi : 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rôle de la déficience endothéliale en NAD+ dans le dysfonctionnement vasculaire lié à l’âge. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi : 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., et Milbrandt, J. (2017). Le domaine du récepteur de péage/interleukine-1 SARM1 possède une activité intrinsèque de clivage du NAD+ qui favorise la dégénérescence axonale pathologique. Neuron 93, 1334.e5-1343.e5. doi : 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., et Chiarugi, A. (2013). L’aperçu des propriétés moléculaires et fonctionnelles de NMNAT3 révèle de nouveaux indices de l’homéostasie du NAD au sein des mitochondries humaines. PLoS One 8:e76938. doi : 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzymes et immunité innée : le rôle du CD157 humain dans le trafic des leucocytes. Front. Biosci. 14, 929-943. doi : 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). L’étiologie de la Pellagre : l’importance de certaines observations épidémiologiques à son égard. Public Health Rep. 29, 1683-1686. doi : 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., et Croft, K. D. (2014). Changements dans les dommages oxydatifs, l’inflammation et avec l’âge dans le liquide céphalo-rachidien. PLoS One 9:e85335. doi : 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). L’adénosine générée dans la niche de la moelle osseuse par une voie médiée par CD38 est en corrélation avec la progression du myélome humain. Mol. Med. 22, 694-704. doi : 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., et An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi : 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., et Schuh, R. A. (2015). Effet du mononucléotide de nicotinamide sur les déficits respiratoires mitochondriaux du cerveau dans un modèle murin pertinent pour la maladie d’Alzheimer. BMC Neurol. 15:19. doi : 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Age-associated changes in oxidative stress and NAD+ metabolism in human tissue. PLoS One 7:e42357. doi : 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). La dépendance la nuit noire de l’âme, NAD+ la lumière de l’espoir. (Bloomington IS : Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). L’administration à long terme de nicotinamide mononucléotide atténue le déclin physiologique associé à l’âge chez les souris. Cell Metab. 24, 795-806. doi : 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., et Malavasi, F. (2018). Le rôle de la génération d’adénosine extracellulaire dans le développement des maladies auto-immunes. Mediators Inflamm. 2018:7019398. doi : 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). Le DPN dans la prévention, le diagnostic et le traitement des toxicomanies. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Diurnal variations in human urinary excretion of nicotinamide catabolites : effects of stress on the metabolism of nicotinamide. Am. J. Clin. Nutr. 77, 406-410. doi : 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., et Gupta, M. P. (2005). La mort cellulaire des myocytes cardiaques dépendante de la poly(ADP-ribose) polymérase-1 pendant l’insuffisance cardiaque est médiée par l’épuisement du NAD+ et la réduction de l’activité de la désacétylase Sir2α. J. Biol. Chem. 280, 43121-43130. doi : 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Pharmacological effects of exogenous NAD on mitochondrial bioenergetics, DNA repair, and apoptosis. Mol. Pharmacol. 80, 1136-1146. doi : 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., et Reidl, J. (2001). Est-ce qu’une activité pyrophosphatase NAD est nécessaire pour la multiplication de Haemophilus influenzae type b dans la circulation sanguine ? Int. J. Med. Microbiol. 291, 219-225. doi : 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., et Matsuo, H. (1989). Corrélation entre l’apport équivalent en niacine et l’excrétion urinaire de ses métabolites, le N’-méthylnicotinamide, le N’-méthyl-2-pyridone-5-carboxamide et le N’-méthyl-4-pyridone-3-carboxamide, chez des humains consommant un aliment auto-sélectionné. Am. J. Clin. Nutr. 50, 114-119. doi : 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Signalisation du stress oxydatif dans la maladie d’Alzheimer. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., et Angielski, S. (2003). Renal haemodynamics and natriuretic responses to intravenous administration of diadenosine tetraphosphate (ap4a) and nicotinamide adenine dinucleotide (NAD) in rat. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., et Yue, J. (2014). Rôles et mécanismes de la voie de signalisation CD38/adénosine diphosphate ribose cyclique/Ca2+. World J. Biol. Chem. 5, 58-67. doi : 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H. et Yan, L. J. (2016). Sources et implications du déséquilibre redox NADH/NAD+ dans le diabète et ses complications. Diabetes Metab. Syndr. Obes. 9, 145-153. doi : 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., et Tsuchiya, M. (2006). La mesure simultanée du nicotinamide adénine dinucléotide et des composés connexes par chromatographie liquide/spectrométrie de masse en tandem par ionisation électrospray. Anal. Biochem. 352, 282-285. doi : 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Rôles du NAD+, de PARP-1 et des sirtuines dans la mort cellulaire, les lésions cérébrales ischémiques et les lésions tissulaires induites par le rayonnement synchrotron. Scientifica 2013:691251. doi : 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., et Swanson, R. A. (2003). La réplétion en NAD+ empêche le blocage glycolytique induit par PARP-1 et la mort cellulaire dans les astrocytes de souris en culture. Biochem. Biophys. Res. Commun. 308, 809-813. doi : 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G.. (2010). Stress oxydatif et NAD+ dans les lésions cérébrales ischémiques : avancées actuelles et perspectives futures. Curr. Med. Chem. 17, 2152-2158. doi : 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., et Imai, S. I. (2018). Intermédiaires du NAD+ : la biologie et le potentiel thérapeutique du NMN et du NR. Cell Metab. 27, 513-528. doi : 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., et Imai, S. (2011). Le mononucléotide de nicotinamide, un intermédiaire clé du NAD+, traite la pathophysiologie du diabète induit par le régime alimentaire et l’âge chez les souris. Cell Metab. 14, 528-536. doi : 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). La mort neuronale induite par la protéine prion mal repliée est due à l’épuisement du NAD+ et peut être soulagée in vitro et in vivo par la reconstitution du NAD+. Brain 138, 992-1008. doi : 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). Le NADH peut entrer dans les astrocytes pour bloquer la mort des astrocytes médiée par PARP-1. Neuroreport 16, 1209-1212. doi : 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., et Perry, G. (2007). Causes du stress oxydatif dans la maladie d’Alzheimer. Cell. Mol. Life Sci. 64, 2202-2210. doi : 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar
.