- Introduction
- Materiais e Métodos
- Participantes
- Padronização da Diet
- Protocolo de infusão
- Recolha de amostras de sangue por via endovenosa
- Recolha de amostras de urina
- Método Analítico
- Safety
- Análise estatística
- Ethics
- Resultados
- Segurança
- Plasma
- Urina
- Discussão
- Dados Disponibilidade
- Declaração Ethics
- Contribuições dos autores
- Funding
- Conflict of Interest Statement
- Administrações
Introduction
The parent pyridine nucleotide, nicotinamide adenine dinucleotide (NAD+) is present in all cells of the body and is essential for cell viability and function.
Como co-factor responsável pelo transporte de electrões na cadeia respiratória, o NAD+ e o seu par redox NADH são centrais para a produção de energia (ATP) nas mitocôndrias via fosforilação oxidativa. O metabolito fosforilado do NAD+, NADP+ com o seu par redox NADPH também fornece o poder redutor para conduzir um número de reacções anabólicas, incluindo a síntese do colesterol e do ácido nucleico, o alongamento dos ácidos gordos e a regeneração do glutatião (GSH), um dos principais antioxidantes do organismo. Esta família de nucleotídeos em piridina, em geral, contribui para a troca redox de mais de 400 reações enzimáticas. É importante ressaltar que, quando atua como um casal redox, o NAD+ não é consumido. No entanto, o NAD+ também serve como substrato para uma série de outros processos metabólicos importantes e, portanto, é consumido como consequência das suas reacções químicas, potencialmente esgotando o tecido do NAD+. Estão incluídas neste número as reacções impulsionadas pela família de enzimas de poliadenosina fosforibose-ribose (ADPR) (PARP 1-17) que controlam a reparação do ADN e a estabilidade nuclear, as enzimas de controlo epigenético (Sirt1-7), a comunicação imunitária intercelular (CD38/CD157) e a regeneração neuronal (SARM1; Essuman et al., 2017). O potencial existe, portanto, para a ruptura do metabolismo celular em múltiplos níveis em condições onde o consumo de NAD+ por estas enzimas excede o fornecimento ou síntese de NAD+.
A importância clínica de manter os níveis celulares de NAD+ foi estabelecida no início do século passado com a descoberta de que a pelagra, uma doença caracterizada por diarréia, dermatite, demência e morte, poderia ser curada com alimentos contendo a niacina precursora de NAD+ (também conhecida como vitamina B3; Goldberger, 1914). Embora a pelagra seja rara em países desenvolvidos, as concentrações celulares de NAD+ têm diminuído sob condições de aumento dos danos oxidativos, como ocorre durante o envelhecimento (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Foi constatado que níveis alterados de NAD+ acompanham vários distúrbios associados ao aumento do dano oxidativo/livre radical, incluindo diabetes (Wu et al., 2016), doença cardíaca (Pillai et al., 2005), disfunção vascular relacionada à idade (Csiszar et al., 2019), lesão cerebral isquêmica (Ying e Xiong, 2010), proteínas neuronais desdobradas (Zhou et al., 2015) e demência de Alzheimer (Abeti e Duchen, 2012).
Além das marcas patológicas das placas Aβ e dos emaranhados neurofibrilares de tau, o dano oxidativo é um achado consistente na doença de Alzheimer e é amplamente reconhecido como um evento precoce no processo patogênico, mesmo antes do depósito de Aβ (Su et al., 2008). Enquanto as espécies reativas de oxigênio (ROS) causadoras desse dano provavelmente têm origem em múltiplas fontes, acredita-se que mitocôndrias disfuncionais e a disponibilidade de metais ativos redox como Fe++ e Cu+ desempenhem papéis dominantes (Zhua et al., 2007).
Uma grande conseqüência do estresse oxidativo celular, no cérebro e em outros lugares, são quebras simples ou duplas no DNA. Em resposta a danos no DNA, PARP1 hidrolisa NAD+ para produzir polímeros de ADP-ribose (Ying, 2013). Mostramos anteriormente que os níveis de NAD+ estavam inversamente correlacionados com medidas de estresse oxidativo no tecido humano (Massudi et al., 2012) e no cérebro do rato (Braidy et al., 2014). Assim, enquanto níveis reduzidos de NAD+ no cérebro de portadores vivos de Alzheimer aguardam confirmação por técnicas não invasivas, os achados consistentes de dano oxidativo no cérebro post mortem apóiam fortemente a visão de que a aceleração do turnover e esgotamento do NAD+ contribuem para a disfunção neurológica desta doença. Como as intervenções direcionadas à restauração da DAE+ têm sido mostradas em modelos animais para apoiar o envelhecimento saudável e melhorar a função metabólica (Yoshino et al., 2011; Mills et al., 2016) e demência (Long et al., 2015), estratégias para elevar os níveis de DAE+ no ser humano estão sendo ativamente exploradas.
O método mais direto de aumentar os níveis de DAE+ é através da administração intravenosa (IV). Embora os dados da pesquisa experimental sejam mínimos, o benefício clínico significativo da infusão IV de NAD+ na privação de álcool já foi relatado anteriormente (O’Holleran, 1961; Mestayer, 2019). Surpreendentemente, enquanto a administração oral de precursores de NAD+ como o ribósido de nicotinamida (NR) ou o mononucleotídeo de nicotinamida (NMN) estão sendo entusiasticamente investigados por seu impacto nos níveis de NAD+ (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), o destino metabólico e as propriedades farmacocinéticas da administração IV de NAD+ ainda não foram relatados em humanos. Este estudo, portanto, apresenta pela primeira vez as mudanças nas concentrações de NAD+ e seus metabolitos durante uma infusão IV de NAD+ em uma coorte de participantes masculinos saudáveis.
Materiais e Métodos
Participantes
Onze (Teste n = 8, Controle n = 3) participantes masculinos de 30-55 anos de idade foram recrutados através de anúncios em rádio, TV e mídias sociais. Todos os participantes tinham IMC inferior a 30 kg/m2 (Média do teste IMC = 27,5 ± 2,5 kg/m2; Média do controle IMC = 24,6 ± 6,5 kg/m2), não eram diabéticos, fumavam menos de 1 cigarro e consumiam menos de 2 bebidas alcoólicas padrão por dia. Foram excluídos do estudo os indivíduos que tomavam lipídios ou anti-inflamatórios, que tinham histórico de insuficiência hepática ou renal ou que sofreram recentemente uma infecção microbiana, trauma ou qualquer outro distúrbio médico significativo ou não tratado. Os indivíduos receberam compensação monetária pelo seu tempo e participação, independentemente de terem completado o experimento. Os participantes não tiveram permissão para usar produtos naturais de saúde contendo NAD+, NR ou Nicotinamida nos 14 dias anteriores e durante o curso do estudo.
Padronização da Diet
No dia anterior à infusão de NAD+ IV, os participantes consumiram uma dieta idêntica com redução de niacina e beberam apenas água.
Nenhum alimento foi consumido no dia do estudo até que a amostra final de 8 h de sangue/urina tivesse sido coletada. Os participantes foram encorajados a beber água para permanecerem normalmente hidratados. Nenhum outro tipo de bebida foi permitido.
Para garantir que a ingestão de energia adequada fosse mantida para os participantes durante as 6 h de infusão, a solução EV também continha 0,1% de dextrose, fornecendo aproximadamente 2.000 calorias durante o período de 6 h de infusão.
Protocolo de infusão
Os participantes foram randomizados para o grupo Teste (n = 8) ou Controle (n = 3). Os participantes do grupo Teste foram administrados por via intravenosa 750 mg NAD+ em soro fisiológico normal (Archway Apothecary, Covington, LA, EUA) durante um período de 6 h (taxa de infusão = ~2 mg/min ≡ 3 μmoles/min). Esta dosagem de NAD+ foi derivada empiricamente e reflete um regime de dosagem comum em clínicas (por exemplo, Springfield Wellness Clinic, Springfield, LA, EUA) que fornecem regularmente infusões IV de NAD+ na prática clínica. Os participantes do grupo Controlo foram administrados por via intravenosa com solução salina normal durante um período de 6 horas.
A administração e supervisão clínica das infusões EV e a colheita de amostras foram realizadas no Springfield Wellness Center, Springfield, LA, EUA.
Recolha de amostras de sangue por via endovenosa
Amostras de sangue por via endovenosa (TO) foram colhidas em todos os participantes após um jejum de 12 horas, que ocorreu imediatamente antes do início da infusão. Amostras adicionais foram coletadas às 30, 60, 120 (2 h), 360 (6 h) e 480 (8 h) minutos após o início da infusão.
Sangue total foi coletado através de punção venosa padrão (braço oposto ao local da infusão) em um tubo não heparinizado de 5 mL. Imediatamente após a coleta, o sangue foi centrifugado a 4°C por 10 min a 1.409× g.
As frações de plasma e eritrócitos foram imediatamente separadas e distribuídas em 5 × 500 μL alíquotas cada. Todas as alíquotas foram imediatamente congeladas e armazenadas a -80°C até a análise.
Recolha de amostras de urina
Após a coleta de uma amostra de urina na linha de base, os participantes foram solicitados a esvaziar toda a urina no(s) recipiente(s) fornecido(s) aos 30 min, 2 h, 6 h e 8 h após o início da infusão de NAD+. Se os participantes precisassem passar urina intermitentemente entre estes pontos de tempo, foi-lhes pedido que o fizessem no próximo receptáculo sucessivo. Todas as amostras foram aliquotadas e armazenadas a -80°C imediatamente após o recebimento.
Método Analítico
Separação cromatográfica de NAD+ e metabólitos relacionados e detecção de EM Cromatografia líquida acoplada à espectrometria de massa em tandem (LC/MS/MS) foi realizada usando um espectrômetro de massa Sciex QTRAP 5500 (Sciex, Redwood City, CA, EUA) como descrito anteriormente (Clement et al., 2018). Em resumo, 100 μL de plasma humano ou urina foi extraído em 400 μL de metanol gelado, centrifugado a 4°C durante 10 min, e filtrado através de cartuchos de membrana de 3 kDa. Os extratos de amostra foram secos sob vácuo, reconstituídos em 200 μL de 100 mM de tampão NH4OAc e transferidos para 200 μL frascos de vidro e tampados antes da análise LC/MS/ MS. Normas e amostras (20 μL) foram injetadas em uma coluna Phenomenex NH2 (150 mm – 2 mm – 3 mm), conforme descrito anteriormente. Foi utilizado um gradiente de solvente binário constituído por 5 mM NH4OAc pH 9,5 ajustado com amônia (fase móvel A) e acetonitrilo (fase móvel B) com uma taxa de fluxo de 250 μL/min. A composição inicial do solvente na injeção foi de 25% A, seguida por um gradiente de 2 minutos a 45% A e uma rampa de gradiente rápido a 80% A (0,1 min) que foi mantida por 5,9 min, A foi aumentada novamente para 95% (2 min), mantida por 13 min, e depois revertida para condições iniciais (0,1 min) para equilíbrio, com um tempo total de execução de 30 min. O fluxo da coluna foi direcionado para o detector de EM. As curvas de calibração de metabólitos individuais foram construídas usando as razões de área de pico (área de pico do metabólito dividida pela área de pico do SI selecionado) de cada calibrador vs. sua concentração.
Padrões internos consistiram de 2H2NAM (para NAM, metilNAM e ADPR) e 13C5;-AMP cíclica (para NMN e NAD+). Note-se que como as etiquetas isotópicas não estão comercialmente disponíveis para todos os metabólitos NAD, uma molécula estreitamente relacionada (análoga estrutural) também pode ser usada (Yamada et al., 2006) desde que seja considerada de estabilidade e eficiência de ionização similares durante a análise. Os padrões internos selecionados neste estudo foram previamente otimizados para o metabolito relacionado (Bustamante et al., 2017).
Safety
A segurança do DNAIV+ foi avaliada através de testes de função hepática e observação clínica de quaisquer eventos adversos. Os testes de função hepática consistiram de soro, bilirrubina total (bili), fosfatase alcalina (ALP), alanina aminotransferase (ALT), gama-glutamil transferase (GGT), lactato desidrogenase (LD) e aspartato aminotransferase (AST).
Análise estatística
Análise estatística foi completada usando SPSS versão 24 e GraphPad Prism versão 8 para windows. Para determinar se a concentração média dos analistas testados foi diferente no período de 8 h e entre os grupos Teste e Controle, foi utilizada uma ANOVA bidirecional não ponderada com o teste de comparação múltipla pós-hoc de Bonferroni. O teste de Wilcoxon Signed Ranks foi utilizado para determinar se as diferenças nas concentrações médias dos testes de função hepática foram significativas entre os pontos basais e 8 h de tempo. As diferenças foram consideradas estatisticamente significativas quando p < 0.05.
Ethics
Este estudo foi realizado de acordo com o Código de Ética da Associação Médica Mundial (Declaração de Helsinque) para experimentos envolvendo seres humanos. A aprovação ética foi obtida do Conselho de Revisão Institucional da William Carey University, Hattiesburg, MS (Protocolo #2017-12). O consentimento informado foi obtido de todos os participantes.
Resultados
Segurança
Não foram observados eventos adversos durante as 6 h de infusão com coortes de placebo (soro fisiológico) ou teste (NAD+).
Diminuição significativa na atividade (1,3, 57, 3,6 unidades/l) para as enzimas de função hepática GGT, LD e AST, respectivamente, foi observada às 8 h após o início da infusão de NAD+ (Tabela 1). Nenhuma alteração significativa na atividade de qualquer marcador de função hepática foi aparente às 8 h nas amostras tratadas com placebo (soro fisiológico), porém um baixo número de amostras pode reduzir a sensibilidade à discriminação. Um aumento significativo de 2,75 μmoles/L na bilirrubina plasmática também foi observado. Entretanto, nenhuma das alterações foi considerada clinicamente significativa.

Tábua 1. O teste Wilcoxon Signed Ranks foi usado para determinar se as diferenças nas concentrações médias do teste de função hepática foram significativas entre o ponto basal e 8 h de tempo.
Plasma
A infusão contínua de NAD+ a uma taxa de 3 μmoles/min resultou em um aumento significativo (398%) nos níveis plasmáticos de NAD+ apenas no ponto 6 h de tempo (i.e., final da infusão) em relação ao basal (p < 0.0001). Isto foi significativamente diferente do controle de 6 h de tratamento salino (p < 0,001).
NAD+ níveis permaneceram elevados às 8 h (i.e, 2 h pós-infusão) em relação às amostras de controle tratadas com soro fisiológico.
NAD+ não se alterou significativamente em relação à linha de base durante o período de avaliação de 8 h em amostras de controle tratadas com soro fisiológico (Figura 1A).
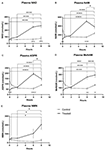
Figura 1. Alterações no nicotinamida adenina dinucleótido plasmático (NAD+) e metabólitos acima de 8 h . (A) NAD+, (B) Nicotinamida (NAM), (C) adenosina fosforibose (ADPR), (D) metil nicotinamida (meNAM), (E) nicotinamida mononucleotídeo (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, conforme indicado. Para determinar se a concentração média dos analistas testados foi diferente no período de 8 h e entre os grupos Teste (n = 8) e Controle (n = 3) foi utilizada a ANOVA bidirecional com o teste pós-hoc de comparação múltipla de Bonferroni.
Similar às alterações observadas para NAD+, os níveis plasmáticos do metabolito NAD+ nicotinamida (NAM) aumentaram significativamente em 409% ao final da infusão de NAD+ (ou seja 6 h) em relação à linha de base (p < 0,0001). Isto também foi significativamente diferente do controle com 6 h de tratamento salino (p < 0,001).
No período de 8 h (ou seja, 2 h após o final da infusão), os níveis de NAM entre os grupos controle e tratado não foram mais significativamente diferentes (p > 0,05).
níveis de NAM para amostras de controle tratadas com soro fisiológico não se alteraram significativamente no período de 8 h (p > 0,05, Figura 1B).
Consistente com as mudanças observadas para NAM, os níveis plasmáticos do metabolito NAD+ ADPR aumentaram significativamente em 393% no final da infusão de NAD+ (ou seja, 6 h) em relação à linha de base (p < 0,0001). Isto foi significativamente diferente do controle com tratamento salino de 6 h (p < 0,0001).
No momento de 8 h (ou seja, 2 h após o final da infusão), os níveis de ADPR permaneceram 305% acima da linha de base (p < 0,0001). Entretanto, isto não foi significativamente maior que os níveis de ADPR nas amostras de controle tratadas com soro no mesmo momento (p > 0,05).
Os níveis de ADPR para amostras de controle tratadas com soro não mudaram significativamente durante o período de 8 h (p > 0,05, Figura 1C).
A análise de correlação de Spearman entre as médias de grupo ao longo dos pontos de tempo de 8 h para os dois metabolitos catabólicos NAD+, NAM e ADPR, produziu um coeficiente de correlação de 1,00 (p < 0.001).
Again, consistente com as mudanças observadas para o NAM, os níveis plasmáticos do metabolito NAM, metil-nicotinamida (meNAM) aumentaram significativamente para 350% no final da infusão do NAD+ (ou seja 6 h) em relação tanto à linha de base (p < 0,0001) como ao controle 6 h de controle com tratamento salino (p < 0,01).
No ponto de tempo de 8 h (i.e, 2 h após o final da infusão) os níveis de meNAM permaneceram 393% acima da linha de base (p < 0,0001) e significativamente maiores que as amostras de controle tratadas com soro fisiológico no mesmo momento (p < 0,05).
Níveis de meNAM para amostras de controle tratadas com soro fisiológico não se alteraram significativamente durante o período de 8 h (p > 0,05, Figura 1D).
Níveis de Plasma de NMN, um metabolito de NAM através da via de salvamento anabólico, foi significativamente elevado (472%) apenas no ponto de tempo de 8 h (i.e, 2 h após o final da infusão, p < 0,05).
NMN para amostras de controle tratadas salinas não se alteraram significativamente ao longo do período de 8 h (p > 0,05, Figura 1E).
Urina
A infusão IV contínua de NAD+ a uma taxa de 3 μmoles/min resultou em um aumento significativo (538%) na taxa de excreção de NAD+ na urina no período de 6 h (i.e, final da infusão) em relação àquela excretada aos 30 min (p < 0,001). Isto também foi significativamente diferente da quantidade de urina NAD+ excretada às 6 h pelos controles salinos tratados (p < 0,05).
A quantidade de NAD+ excretada na urina diminuiu 43% (p < 0,05) às 8 h (i.e, 2 h pós-infusão) em relação ao pico de excreção no período de 6 h.
A taxa de excreção de urina para NAD+ não mudou significativamente durante o período de avaliação de 8 h em amostras de controle tratadas com soro fisiológico (Figura 2A).

Figura 2. Alterações na urina NAD+ e metabólitos durante 8 h (1ª 6 h consistindo de uma infusão contínua, 3 μmoles/min, NAD+ IV). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, conforme indicado. Para determinar se a concentração média dos analistas testados foi diferente no período de 8 h e entre os grupos Teste (n = 8) e Controle (n = 3), foi utilizada a ANOVA bidirecional com o teste de comparação múltipla pós-hoc de Bonferroni.
A taxa de excreção do metabolito NAD+ NAM não se alterou significativamente durante o período de 8 h do teste e não foi diferente da taxa de excreção observada do NAM para os controles tratados salinamente (Figura 2B).
A taxa de excreção de urina do meNAM do metabolito NAM foi significativamente aumentada (403%) no período de 6 h (i.e, final da infusão) em relação ao observado aos 30 min (p < 0,01). A quantidade de meNAM excretado na urina diminuiu 43% (p < 0,05) às 8 h (i.e., o meNAM foi excretado na urina), 2 h pós-infusão) em relação ao pico de excreção no ponto de tempo de 6 h.
A taxa de excreção de urina para o meNAM não mudou significativamente durante o período de avaliação de 8 h nos controles tratados com soro fisiológico (Figura 2C).
Discussão
Um interesse crescente em terapias baseadas em NAD+ incluindo infusões de NAD+ destacou a necessidade de uma compreensão mais clara do destino do NAD+ e seus metabólitos após a administração IV. O estudo atual documenta mudanças nos níveis de NAD+ e metabólitos chave tanto no plasma quanto na urina durante 8 h usando um regime clínico típico de dosagem de 750 mg de NAD+ administrado por via intravenosa durante um período de 6 h.
Importante infusão de NAD+ não produziu nenhum evento adverso observável na coorte do teste, mas reduziu as atividades plasmáticas das enzimas indicativas de estresse hepático como o LD intra-hepático e AST e a enzima GGT pós-hepática (duto biliar) sugerindo que a integridade do tecido intra-hepático e pós-hepático foi aumentada mesmo dentro do período de tempo relativamente curto de 8 h. O aumento da bilirrubina, um produto de degradação dos eritrócitos, às 8 h pode refletir ou um aumento muito pequeno no volume de células vermelhas, como pode ocorrer devido à hemeólise induzida pela infusão, ou a redução do metabolismo da heme (Tabela 1). Entretanto, dada a magnitude muito baixa desta alteração, isto não foi considerado clinicamente relevante.
Como esperado, em participantes tratados com sal (ou seja, controle), os níveis plasmáticos de NAD+ e metabólitos NAM e ADPR e os metabólitos NAM, NMN e meNAM permaneceram essencialmente inalterados ao longo do período de 8 h. Entretanto, uma aparente diminuição no NAM, meNAM e ADPR foi observada entre 30 min e 6 h, muito provavelmente devido a um efeito de diluição salina. Consistente com esta noção, os valores para estes analitos voltaram aos níveis de base às 8 h (ou seja 2 h após o final da infusão salina).
Unexpectedly however in NAD+ infused participants, plasma NAD+ levels failed to rise until after the 2 h time point reaching a maximum of ~400% above baseline for NAD+ and metabolites NAM, meNAM and ADPR (398%, 409%, 393%, respectively) only at the 6 h time point (Figuras 1A-E). Isto foi internamente consistente com o pico de excreção urinária tanto para NAD+ quanto para meNAM também ocorrendo às 6 h antes de diminuir rapidamente após o final da infusão (Figuras 2A-C).
NAD+ foi infundido a uma taxa constante de 3 μmoles/min. Portanto, 90 μmoles de NAD+ estava sendo infundido diretamente no compartimento vascular a cada 30 min, fornecendo um total de 1.080 μmoles ao final da infusão às 6 h. A mistura intravascular de qualquer ponto de infusão ocorre dentro de ~2 min; assumindo um volume médio de sangue de 5, o NAD+ adicionado, na ausência de metabolismo ou absorção significativa, corresponderia a um aumento adicional em (NAD+) de pelo menos 18 μM, a cada 30 min ao longo das 6 h de infusão. Embora um aumento desta magnitude esteja bem dentro dos limites de detecção analítica deste estudo, nenhum aumento do NAD+ ou de seus metabólitos foi observado até após 2 h (ou seja, no ponto de tempo de 6 h), tanto no plasma quanto na urina. Esta observação inesperada indica uma rápida, e pelo menos durante as primeiras 2 h, absorção completa do tecido e/ou metabolismo do NAD+ e/ou seus metabólitos.
Um número de enzimas pode alcançar um catabolismo eficaz do NAD+ incluindo as sirtuínas (SIRTs 1-7), as difosfato de adenosina (ADP)-ribose transferases (ARTs) e poli(ADP-ribose) polimerases (PARPs 1-17) e as sintetases cíclicas ADP-ribose (cADPR) (CD38, CD157). As pirofosfatases extracelulares de NAD+ presentes no soro humano também podem degradar NAD+ para AMP e NMN (Schmidt-Brauns et al., 2001). A proteína de superfície celular CD73 também converte NMN em NR, que atravessa facilmente as membranas celulares para potencial ressíntese para NAD+. Importantes são as glicoidrolases catabolizantes NAD+, CD38 e CD157, pirofosfatase ecto-nucleotídica (CD203a) e o catabolizante NMN CD73, que são ectoenzimas encontradas em uma grande variedade de células, incluindo linfóides, granulócitos, neuronais e endoteliais (Wei et al., 2014) e glicoidrolases NAD solúveis no plasma (Figura 3; Funaro et al., 2009). O aumento paralelo do plasma NAM e ADPR (coeficiente de correlação de 1.000, p < 0,001, dados não mostrados) sugere fortemente que pelo menos por 6 h um destino importante do NAD+ é o metabolismo através da clivagem da ligação glicosídica ADPribose-nicotinamida com NAM e ADPR, subprodutos sintomáticos da atividade da glicoidrolase NAD (por exemplo, CD38). Isto é consistente com evidências de outros onde a CD38, em particular, tem mostrado ter um papel primário no controle dos níveis extracelulares de NAD+ (Wei et al., 2014). Os eritrócitos humanos adultos são CD38 positivos e expressam altos níveis de atividade de NAD+ glicoidrolase, clivando NAD+ exógeno para fornecer eritrócitos com ribose ADP que podem ser eficientemente absorvidos pela célula (Kim et al., 1993; Albeniz et al., 2004). A ausência de qualquer aumento de NAD+ ou metabolitos, no plasma ou na urina, até após as primeiras 2 h da infusão indica que NAD+ e/ou seus metabólitos são traficados para fora do espaço vascular extracelular e eficientemente seqüestrados em tecidos ou compartimentos extravasculares como NAD+ e/ou seus metabólitos durante este período de tempo.

Figure 3. Catabolismo extracelular potencial de NAD+ fornecido exogenamente através de atividade de ectoenzimas CD38 (ADP-ribose (ADPR) synthase), CD203a (NAD+ pirofosfátase), CD 73 (5′-nucleotidase), CD157-ADP-ribosyl ciclase 2. Abreviaturas: NAM, nicotinamida; NMN, nicotinamida mononucleotídeo; ADPR, adenosina difosfato ribósido; meNAM, metil nicotinamida; 4PY, N-metil-4-piridona-3-carboxamida; 2PY, metil-2-piridona-5-carboxamida; ARPP, ADP ribose pirofosfatase; RPPK, ribosil pirofosfoquinase; NAmpt, nicotinamida fosforibosiltransferase; NMNAT, nicotinamida mononucleotídeoadeniltransferase; CX-43, connexin 43.
Embora PARP e sirtuínas estejam envolvidas no catabolismo NAD+, como enzimas intracelulares com representantes no citoplasma, núcleo e mitocôndrias é improvável que elas tenham impacto direto nos níveis extracelulares de NAD+. Entretanto, essas enzimas podem responder a mudanças nas concentrações intracelulares de NAD+, NAM e NR que podem surgir de NAD+ fornecidos exógenos. A Figura 4 resume esquematicamente os possíveis destinos de NAD+ exógeno.
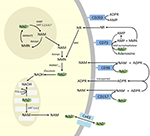
Figure 4. Potenital Intra e destino extracelular do NAD+ exógeno fornecido. Abreviaturas: CD38 , CD203a (NAD+ pirofosfátase), CD 73 (5′-nucleotidase). NAM, nicotinamida; NMN, nicotinamida mononucleotídeo; ADPR, adenosina difosfato ribossídico; meNAM, metil nicotinamida; 4PY, N-metil-4-piridona-3-carboxamida; 2PY, metil-2-piridona-5-carboxamida; ARPP, ADP ribose pirofosfatase; RPPK, ribosil pirofosfoquinase; NAmpt, nicotinamida fosforibosiltransferase; NMNAT, nicotinamida mononucleotídeoadeniltransferase; PARP ; NRK .
Embora exista uma capacidade significativa para a rápida degradação do NAD+ exógeno fornecido IV em metabólitos constituintes, também vale a pena notar que a absorção de NAD+ extracelular também pode estar ocorrendo. Como o NAD+ tem uma carga global negativa, ele é incapaz de atravessar passivamente as membranas celulares e, portanto, deve ser ativamente transportado através da membrana. Que isto ocorre foi demonstrado por vários pesquisadores que relataram que a NAD+ exógena aplicada a uma variedade de tipos de células humanas resulta de fato em uma elevação significativa da NAD+ intracelular (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Enquanto os mecanismos envolvidos ainda não estão totalmente caracterizados, Alano et al. (2010) relataram que NAD+ exógeno poderia entrar em neurônios através de canais fechados P2X7 e outros têm consistentemente observado o transporte de NAD+ através de membranas por hemicanais connexin 43 (CX43), mesmo em concentrações tão baixas quanto 250 pM (Billington et al., 2008). Como as connexinas têm uma ampla distribuição em tecido humano e a CX43 parece ser a connexina mais ubíqua em muitos tipos de células, o potencial de rápida absorção de NAD+ não pode ser desconsiderado.
Assim a absorção celular e/ou metabolismo de NAD+ e metabolitos NAM e ADPR e metabolitos secundários meNAM e NMN parecem prosseguir no ritmo da infusão de 3 μmoles/min NAD+ durante pelo menos as primeiras 2 h. Ou NAD+ e/ou os metabolitos primários testados estão sendo eficientemente sequestrados durante este primeiro período de 2-6 h ou os metabolitos secundários também estão sendo formados. O ADPR pode ser reciclado para produzir NAD+ a partir do NAM (Figura 4) ou ainda metabolizado via ectoenzimas como CD203a (NAD+ pirofosfatase) para produzir AMP que pode ser rapidamente metabolizado para adenosina pelo CD73 a 5′-nucleotidase (Bogan e Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). Em apoio a esta hipótese, um aumento nos níveis sanguíneos de adenosina foi reconhecido por outros como consequência da infusão extracelular de NAD+ (Szczepañska-Konkel et al., 2003). O NAM também pode ser metabolizado para NMN através da via de salvamento antes da ressíntese para NAD+ (Figuras 3, 4) ou atuado por metiltransferases hepáticas para produzir N1-metilnicotinamida que pode ser excretada diretamente ou posteriormente convertida para N-metil-2-piridona-5-carboxamida (2PY, +99% do meNAM) e N-metil-4-piridona-3-carboxamida (4PY, ~0.25% do meNAM) antes da excreção (Shibata e Matsuo, 1989; Okamoto et al, 2003).
É evidente que no regime de dosagem usado os mecanismos envolvidos no metabolismo e sequestro de NAD+ e metabólitos atingiram saturação algum tempo após 2 h resultando numa elevação significativa do plasma NAD+ e acúmulo de todos os metabólitos testados (NMA, ADPR, meNAM e NMN) às 6 h. Como mencionado anteriormente, estes dados apoiam a visão de que uma das principais vias para o metabolismo do NAD+ nestas condições é a clivagem da ligação glicosídica, por ectoenzimas como o CD38 para produzir NAM e ADPR. Entretanto, o aumento no plasma NMN após 2 h também sugere que o NAD+ exógeno é provavelmente atuado por pirofosfatases extracelulares de NAD+, elevando o NMN plasmático e liberando AMP como um metabolito adicional.
Em resumo, este estudo revelou pela primeira vez que: (a) a uma taxa de fluxo de 3 μmole/min, todos os NAD+ exogenamente infundidos foram rápida e completamente removidos do plasma durante pelo menos as primeiras 2 h; (b) o aumento dos bi-produtos metabólicos analisados é consistente com NAD+ glicoidrolases e atividade de pirofosfatase NAD+; e (c) os produtos de excreção urinária decorrentes da infusão de NAD+ incluem NAD+ nativo e meNAM, mas não NAM.
Embora os resultados desta investigação sejam novos e contribuam para o avanço do nosso entendimento sobre o destino cronometrado do NAD+ exógeno em humanos, foram identificadas limitações. Para melhorar o cálculo metabólico geral, estudos futuros devem investigar mudanças no NAD+ de células vermelhas e metabólitos e excreção urinária dos metabólitos meNAM secundários, 2PY e 4PY. Além disso, provavelmente será útil avaliar o impacto do NAD+ exógeno sobre as mudanças no metabolismo purínico, que deve incluir pelo menos a avaliação da AMP do plasma e dos eritrócitos e da adenosina. O uso de modelos animais também pode ajudar a esclarecer o envolvimento relativo das várias vias metabólicas através do uso de inibidores farmacológicos adequados e da amostragem de tecidos.
Em conclusão, este estudo foi capaz de revelar pela primeira vez algumas informações muito úteis, até então desconhecidas, sobre o destino de NAD+ exógena em humanos, incluindo, a segurança e tolerabilidade geral de uma infusão de NAD+ intravenosa a uma taxa de 3 μmoles/min, a rápida seqüestro de NAD+ do plasma, a provável contribuição tanto da glicohidrolase NAD+ quanto da atividade de pirofosfato NAD+ no metabolismo da NAD+ e a aparente reabsorção tubular renal eficiente da NAM. Entretanto, pesquisas adicionais são necessárias para revelar completamente o complexo destino metabólico desta importante molécula. Além disso, a caracterização dessas mudanças ajudará a progredir no desenvolvimento e melhoria dos regimes de tratamento baseados em NAD+ para doenças que provavelmente se beneficiarão do aumento da disponibilidade de NAD+, incluindo condições que requerem maior regeneração e reparo celular, como Alzheimer e outras demências neurodegenerativas.
Dados Disponibilidade
Os conjuntos de dados gerados para este estudo estão disponíveis mediante solicitação ao autor correspondente.
Declaração Ethics
Os estudos envolvendo participantes humanos foram revisados e aprovados pelo William Carey University Institutional Review Board, Hattiesburg, MS (Protocolo #2017-12). Os pacientes/participantes deram seu consentimento informado por escrito para participar deste estudo.
Contribuições dos autores
RG participaram do desenho e supervisão do estudo, da discussão crítica e da autoria do manuscrito. JBer participou do desenho e supervisão do estudo, discussão crítica, coleta de dados, análise estatística, redação e revisão do manuscrito. RM participou do desenho do estudo, discussão crítica, supervisão clínica e revisão do manuscrito. NB participou da análise bioquímica e revisão de manuscritos. JW participou do desenho do estudo, discussão crítica e revisão do manuscrito. JBen participou da coleta de dados e da revisão do manuscrito. A SB participou do desenho do estudo e da revisão do manuscrito. Todos os autores revisaram, leram e aprovaram a versão final do manuscrito, e concordam com a ordem de apresentação dos autores.
Funding
Este estudo foi financiado em conjunto pela NAD+ Research Inc., (LA, EUA) e pela Australasian Research Institute Incorporation (Sydney, Austrália) e foi realizado no Springfield Wellness Center, Springfield, LA, EUA.
Conflict of Interest Statement
RM é diretor da NAD+ Research Inc., e diretor médico do Springfield Wellness Center, que usa IV NAD como terapia clínica. A SB recebeu honorários de consultoria da NAD+ Research Inc.
Os demais autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Administrações
Desejamos agradecer à Archway Apothecary Pty Limited, LA, EUA, pelo fornecimento gratuito de IV NAD+ para este projeto.
Abeti, R.., e Duchen, M. R. (2012). Ativação do PARP por estresse oxidativo induzido por β-amilóide: implicações para a doença de Alzheimer. Neuroquímica. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Um estudo aberto, não aleatório, da farmacocinética do suplemento nutricional nicotinamida ribósido (NR) e seus efeitos nos níveis sanguíneos de NAD+ em voluntários saudáveis. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., e Swanson, R. A. (2010). O esgotamento do NAD+ é necessário e suficiente para a morte neuronal mediada pelo PARP-1. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). NAD atividades de glicoidrolase e absorção adp-ribose em eritrócitos de sujeitos normais e pacientes com câncer. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Caracterização da captação de NAD+ em células de mamíferos. J. Biol. Quimio. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nucleotidases e seus novos papéis no metabolismo do NAD+ e do fosfato. Nova J. Quimioterapia. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Mudanças relacionadas à idade no metabolismo do NAD+ stress oxidativo e atividade de sirt1 em ratos wistar. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Mapeamento do metabolismo do NAD+ no cérebro de ratos Wistar idosos: potenciais alvos para influenciar a senescência cerebral. Biogerontologia 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Quantificação do metaboloma celular NAD+ usando uma abordagem de cromatografia líquida tandem de espectrometria de massa. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). O metaboloma de plasma NAD+ é desregulado no envelhecimento “normal”. Rejuvenescimento Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Papel da deficiência endotelial do NAD+ na disfunção vascular relacionada com a idade. Am. J. Fisiol. Circ. do Coração. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., e Milbrandt, J. (2017). O domínio receptor SARM1 toll/interleucina-1 possui atividade intrínseca de clivagem NAD+ que promove degeneração axonal patológica. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., and Chiarugi, A. (2013). O conhecimento das propriedades moleculares e funcionais do NMNAT3 revela novos indícios de homeostase de NAD dentro da mitocôndria humana. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzymes e imunidade inata: o papel do CD157 humano no tráfico de leucócitos. Frente. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). A etiologia da Pellagra: o significado de certas observações epidemiológicas com respeito a ela. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., e Croft, K. D. (2014). Alterações nos danos oxidativos, inflamação e com a idade no líquido cefalorraquidiano. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). A adenosina gerada no nicho da medula óssea através de um percurso mediado por CD38 correlaciona-se com a progressão do mieloma humano. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Função da glicoclorlase NAD na absorção de ADP-ribose a partir de eritrócitos humanos. Biochim. Biófilas. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., e Schuh, R. A. (2015). Efeito da nicotinamida mononucleotídeo nos déficits respiratórios mitocondriais cerebrais num modelo murino relevante para a doença de Alzheimer. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Alterações associadas à idade no stress oxidativo e no metabolismo do NAD+ no tecido humano. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Addiction the Dark Night of the Soul, NAD+ a Luz da Esperança. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). A administração a longo prazo de nicotinamida mononucleotídeo mitiga o declínio fisiológico associado à idade em ratos. Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). O papel da geração extracelular de adenosina no desenvolvimento de doenças auto-imunes. Mediadores Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN na prevenção, diagnóstico e tratamento de toxicodependências. Oeste. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Variações diurnas na excreção urinária humana de catabolitos de nicotinamida: efeitos do estresse sobre o metabolismo da nicotinamida. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., e Gupta, M. P. (2005). A morte de células de miócitos cardíacos dependentes de poli(ADP-ribose) durante a insuficiência cardíaca é mediada pela depleção do NAD+ e pela redução da atividade da deacetilase Sir2α. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Efeitos farmacológicos do NAD exógeno sobre a bioenergética mitocondrial, reparação do DNA e apoptose. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., e Reidl, J. (2001). É necessária uma atividade de pirofosfatase NAD para a multiplicação de Haemophilus influenzae tipo b na corrente sanguínea? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., e Matsuo, H. (1989). Correlação entre a ingestão de equivalente de niacina e a excreção urinária de seus metabólitos, N’-metilnicotinamida, N’-metil-2-piridona-5-carboxamida e N’-metil-4-piridona-3-carboxamida, em humanos que consomem um alimento auto-selecionado. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Sinalização de estresse oxidativo na doença de Alzheimer. Moeda. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., e Angielski, S. (2003). Renal hemodynamics and natriuretic responses to intravenous administration of diadenosine tetraphosphate (ap4a) and nicotinamide adenine dinucleotide (NAD) in rat. J. Physiol. Pharmacol. 54, 163–173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). Papéis e mecanismos da via de sinalização CD38/cíclica adenosina difosfato ribose/Ca2+. Mundo J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). Fontes e implicações do desequilíbrio do NADH/NAD+ redox na diabetes e suas complicações. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., and Tsuchiya, M. (2006). A medição simultânea de nicotinamida adenina dinucleotídeo e compostos relacionados por cromatografia líquida/ionização por electrospray espectrometria de massa tandem. Anal. Bioquímica. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Papéis de NAD+, PARP-1 e sirtuínas na morte celular, lesão cerebral isquêmica e lesão do tecido induzido por radiação X sincrotrônica. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). A repleção NAD+ previne o bloqueio glicolítico induzido pelo PARP-1 e a morte celular em astrocitos de rato cultivados. Biochem. Biofísicos. Res. Comun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Stress oxidativo e NAD+ em lesão cerebral isquêmica: avanços atuais e perspectivas futuras. Moeda. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., e Imai, S. I. (2018). Intermediários NAD+: a biologia e o potencial terapêutico do NMN e NR. Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., e Imai, S. (2011). Nicotinamida mononucleotídeo, um intermediário chave do NAD+, trata a fisiopatologia da diabetes induzida pela dieta e pela idade em ratos. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). A morte neuronal induzida pela proteína priônica desdobrada é devida ao esgotamento do NAD+ e pode ser aliviada in vitro e in vivo pelo reabastecimento do NAD+. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., e Ying, W. (2005). NADH pode entrar em astrocitos para bloquear a morte mediada por astrocitos PARP-1. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., e Perry, G. (2007). Causas do stress oxidativo na doença de Alzheimer. Célula. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar