- Introduktion
- Materialer og metoder
- Deltagere
- Dietstandardisering
- Infusionsprotokol
- Blodprøveindsamling
- Urinprøveindsamling
- Analytisk metode
- Sikkerhed
- Statistisk analyse
- Etik
- Resultater
- Sikkerhed
- Plasma
- Urin
- Diskussion
- Datatilgængelighed
- Ethisk erklæring
- Author Contributions
- Funding
- Interessekonflikterklæring
- Akkreditering
Introduktion
Den overordnede pyridinnukleotid, nikotinamid adenin dinukleotid (NAD+) er til stede i alle kroppens celler og er afgørende for cellens levedygtighed og funktion.
Som en cofaktor, der er ansvarlig for elektrontransporten i respirationskæden, er NAD+ og dets redoxpar NADH centrale for energiproduktionen (ATP) i mitokondrierne via oxidativ fosforylering. Den fosforylerede metabolit af NAD+, NADP+ med sit redoxpar NADPH, leverer også den reducerende kraft til at drive en række anabole reaktioner, herunder kolesterol- og nukleinsyresyntese, forlængelse af fedtsyrer og regenerering af glutathion (GSH), en af kroppens vigtigste antioxidanter. Samlet set bidrager denne familie af pyridinnukleotider, , til redoxudvekslingen i over 400 enzymeretninger. Det er vigtigt, at NAD+ ikke forbruges, når det fungerer som et redoxpar. NAD+ tjener imidlertid også som substrat for en række andre vigtige metaboliske processer og forbruges derfor som følge af deres kemiske reaktioner, hvilket potentielt kan udtømme vævet for NAD+. I dette antal indgår reaktioner, der drives af enzymer af poly adenosinphosphoribose-ribose (ADPR)-familien (PARP 1-17), der kontrollerer DNA-reparation og nukleær stabilitet, epigenetiske kontrolenzymer (Sirt1-7), intercellulær immunkommunikation (CD38/CD157) og neuronal regeneration (SARM1; Essuman et al., 2017). Der er derfor potentiale for forstyrrelse af cellulær metabolisme på flere niveauer under forhold, hvor disse enzymers NAD+-forbrug overstiger NAD+-tilførsel eller -syntese.
Den kliniske betydning af at opretholde cellulære NAD+-niveauer blev fastslået tidligt i sidste århundrede med opdagelsen af, at pellagra, en sygdom karakteriseret ved diarré, dermatitis, demens og død, kunne kureres med fødevarer, der indeholdt NAD+-prækursoren niacin (også kendt som vitamin B3; Goldberger, 1914). Selv om pellagra er sjælden i de udviklede lande, har det vist sig, at de cellulære koncentrationer af NAD+ falder under forhold med øget oxidativ skade, som f.eks. opstår under aldring (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Ændrede niveauer af NAD+ har vist sig at ledsage flere lidelser, der er forbundet med øget oxidativ/fri radikalskade, herunder diabetes (Wu et al., 2016), hjertesygdomme (Pillai et al., 2005), aldersrelateret vaskulær dysfunktion (Csiszar et al., 2019), iskæmisk hjerneskade (Ying og Xiong, 2010), misfoldede neuronale proteiner (Zhou et al, 2015) og Alzheimers demens (Abeti og Duchen, 2012).
Ud over de patologiske kendetegn ved Aβ-plaques og neurofibrillære tau-tangles er oxidativ skade et konsekvent fund i Alzheimers sygdom og er bredt anerkendt som en tidlig begivenhed i den patogene proces, endda forud for Aβ-aflejring (Su et al., 2008). Mens de reaktive oxygenarter (ROS), der forårsager denne skade, sandsynligvis stammer fra flere kilder, men dysfunktionelle mitokondrier og tilgængeligheden af redoxaktive metaller som Fe++ og Cu+ menes at spille en dominerende rolle (Zhua et al., 2007).
En vigtig konsekvens af cellulær oxidativ stress, i hjernen og andre steder, er enkelt- eller dobbeltstrengede brud på DNA’et. Som reaktion på DNA-skader hydrolyserer PARP1 NAD+ for at producere polymerer af ADP-ribose (Ying, 2013). Vi viste tidligere, at NAD+-niveauerne var omvendt korreleret med målinger af oxidativ stress i humant væv (Massudi et al., 2012) og i rottehjernen (Braidy et al., 2014). Mens reducerede niveauer af NAD+ i hjernen hos levende Alzheimerpatienter således afventer bekræftelse ved hjælp af ikke-invasive teknikker, understøtter de konsekvente fund af oxidativ skade i post mortem-hjernen stærkt det synspunkt, at accelereret NAD+-omsætning og udtømning bidrager til den neurologiske dysfunktion i denne sygdom. Da interventioner rettet mod at genoprette NAD+ har vist sig i dyremodeller at understøtte sund aldring og forbedre metabolisk funktion (Yoshino et al., 2011; Mills et al., 2016) og demens (Long et al., 2015), udforskes strategier til at øge NAD+-niveauet hos mennesker aktivt.
Den mest direkte metode til at øge NAD+-niveauet er gennem intravenøs (IV) administration. Selv om data fra eksperimentel forskning er minimale, er den betydelige kliniske fordel ved IV NAD+-infusion ved alkoholafvænning tidligere blevet rapporteret (O’Holleran, 1961; Mestayer, 2019). Overraskende nok, mens den orale administration af NAD+-prækursorer såsom nikotinamidribosid (NR) eller nikotinamidmononukleotid (NMN) undersøges entusiastisk for deres indvirkning på NAD+-niveauerne (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), er den metaboliske skæbne og de farmakokinetiske egenskaber af IV NAD+-administration endnu ikke rapporteret i mennesker. Denne undersøgelse præsenterer derfor for første gang ændringerne i koncentrationerne af NAD+ og dets metabolitter under en IV-infusion af NAD+ i en kohorte af sunde mandlige deltagere.
Materialer og metoder
Deltagere
Eleven (Test n = 8, Kontrol n = 3) mandlige deltagere i alderen 30-55 år blev rekrutteret via reklamer på radio, tv og sociale medier. Alle deltagere havde et BMI på under 30 kg/m2 (Test gennemsnitligt BMI = 27,5 ± 2,5 kg/m2; Kontrol gennemsnitligt BMI = 24,6 ± 6,5 kg/m2), var ikke diabetiske, røg mindre end 1 cigaret og indtog mindre end 2 standard alkoholholdige drikkevarer om dagen. Personer, der tog lipidsænkende eller antiinflammatoriske lægemidler, som havde en historie med lever- eller nyresvigt eller for nylig havde været udsat for en mikrobiel infektion, traume eller andre væsentlige eller ubehandlede medicinske lidelser, blev udelukket fra undersøgelsen. Forsøgspersonerne modtog monetær kompensation for deres tid og deltagelse, uanset om de gennemførte forsøget eller ej. Deltagerne måtte ikke bruge naturlige sundhedsprodukter, der indeholdt NAD+, NR eller nikotinamid inden for 14 dage før og i løbet af undersøgelsen.
Dietstandardisering
Dagen før NAD+ IV-infusionen indtog deltagerne en identisk niacinreduceret kost og drak kun vand.
Der blev ikke indtaget mad på undersøgelsesdagen før efter den sidste 8 timers blod-/urinprøve var blevet indsamlet. Deltagerne blev opfordret til at drikke vand for at forblive normalt hydreret. Ingen andre typer drikkevarer var tilladt.
For at sikre, at deltagerne fik et tilstrækkeligt energiindtag i løbet af den 6 timer lange infusion, indeholdt IV-opløsningen også 0,1 % dextrose, hvilket gav ca. 2.000 kalorier i løbet af den 6 timer lange infusionsperiode.
Infusionsprotokol
Deltagerne blev randomiseret til enten test- (n = 8) eller kontrolgruppen (n = 3). Deltagerne i testgruppen fik intravenøst indgivet 750 mg NAD+ i normal saltvand (Archway Apothecary, Covington, LA, USA) over en periode på 6 timer (infusionshastighed = ~2 mg/min ≡ 3 μmol/min). Denne dosering af NAD+ blev udledt empirisk og afspejler et almindeligt doseringsregime i klinikker (f.eks. Springfield Wellness Clinic, Springfield, LA, USA), som regelmæssigt giver IV NAD+-infusioner i klinisk praksis. Deltagerne i kontrolgruppen fik intravenøst indgivet normal saltvand over en periode på 6 timer.
Klinisk administration og overvågning af IV-infusionerne og prøveindsamlingen blev udført på Springfield Wellness Center, Springfield, LA, USA.
Blodprøveindsamling
Baseline (TO)-blodprøver blev indsamlet på alle deltagere efter en 12 timers faste om natten timet til at ske umiddelbart før infusionens start. Der blev derefter indsamlet yderligere prøver 30, 60, 120 (2 h), 360 (6 h) og 480 (8 h) minutter efter infusionens start.
Hele blodet blev indsamlet via standard venepunktur (modsat arm af infusionsstedet) i et 5 mL ikke-gel hepariniseret rør. Umiddelbart efter opsamlingen blev blodet centrifugeret ved 4 °C i 10 minutter ved 1 409× g.
Plasma- og røde blodlegemerfraktionerne blev straks adskilt og fordelt i 5 × 500 μL alikvater hver. Alle alikvotes blev derefter straks frosset ned og opbevaret ved -80 °C indtil analyse.
Urinprøveindsamling
Efter indsamling af en baseline-urinprøve midt i strømmen blev deltagerne bedt om at tømme al urin i den eller de medfølgende beholdere 30 min, 2 h, 6 h og 8 h efter påbegyndelse af NAD+-infusionen. Hvis deltagerne havde behov for at afgive urin med mellemrum mellem disse tidspunkter, blev de bedt om at gøre det i den næste efterfølgende beholder. Alle prøver blev aliquoteret og opbevaret ved -80 °C umiddelbart efter modtagelsen.
Analytisk metode
Kromatografisk adskillelse af NAD+ og relaterede metabolitter og MS-detektion Flydende kromatografi koblet til tandem-massespektrometri (LC/MS/MS) blev udført ved hjælp af et Sciex QTRAP 5500-massespektrometer (Sciex, Redwood City, CA, USA) som tidligere beskrevet (Clement et al., 2018). Kort fortalt blev 100 μL humant plasma eller urin ekstraheret i 400 μL iskold methanol, centrifugeret ved 4 ° C i 10 min og filtreret gennem 3 kDa-membranpatroner. Prøveekstrakterne blev tørret under vakuum, rekonstitueret i 200 μL 100 mM NH4OAc-buffer og overført til 200 μL glasflasker og lukket inden LC/MS/ MS-analyse. Standarder og prøver (20 μL) blev injiceret på en Phenomenex NH2-kolonne (150 mm- 2 mm- 3 mm) som tidligere beskrevet. Der blev anvendt en binær opløsningsmiddelgradient bestående af 5 mM NH4OAc pH 9,5 justeret med ammoniak (mobilfase A) og acetonitril (mobilfase B) med en strømningshastighed på 250 μL/min. Den indledende opløsningsmiddelsammensætning ved injektion var 25 % A, efterfulgt af en gradient på 2 minutter til 45 % A og en hurtig gradientrampe til 80 % A (0,1 min), der blev opretholdt i 5,9 minutter, A blev igen øget til 95 % (2 min), holdt i 13 minutter og derefter tilbageført til de indledende betingelser (0,1 min) til equilibrering, med en samlet køretid på 30 minutter. Kolonneflowet blev ledt ind i MS-detektoren. Kalibreringskurver for individuelle metabolitter blev konstrueret ved hjælp af forholdet mellem toparealerne (toparealet af metabolitten divideret med toparealet af den valgte IS) for hver kalibrator i forhold til dens koncentration.
Interne standarder bestod af 2H2NAM (for NAM, methylNAM og ADPR) og 13C5;-Cyclic AMP (for NMN og NAD+). Bemærk, at da isotopmærker ikke er kommercielt tilgængelige for alle NAD-metabolitter, kan et nært beslægtet molekyle (strukturel analog) også anvendes (Yamada et al., 2006), forudsat at det anses for at være af lignende stabilitet og ioniseringseffektivitet under analysen. De interne standarder, der er valgt i denne undersøgelse, er tidligere blevet optimeret til den beslægtede metabolit (Bustamante et al., 2017).
Sikkerhed
Sikkerheden af IV NAD+ blev vurderet ved hjælp af leverfunktionstest og klinisk observation af eventuelle bivirkninger. Leverfunktionstest bestod af serum, total bilirubin (bili), alkalisk fosfatase (ALP), alaninaminotransferase (ALT), gamma-glutamyltransferase (GGT), laktatdehydrogenase (LD) og aspartataminotransferase (AST).
Statistisk analyse
Statistisk analyse blev gennemført ved hjælp af SPSS version 24 og GraphPad Prism version 8 til Windows. Der blev anvendt en uvægtet middelværdi, tovejs ANOVA med Bonferronis multiple sammenlignings post hoc-test for at afgøre, om gennemsnitskoncentrationen for de testede analytikere var forskellig i løbet af 8 timer og mellem test- og kontrolgrupper. Wilcoxon Signed Ranks-testen blev anvendt til at afgøre, om forskellene i de gennemsnitlige leverfunktionstestkoncentrationer var signifikante mellem baseline- og 8-timerstidspunkterne. Forskelle blev betragtet som statistisk signifikante, når p < 0,05.
Etik
Denne undersøgelse blev udført i overensstemmelse med The Code of Ethics of the World Medical Association (Helsinki-deklarationen) for eksperimenter med mennesker. Der blev opnået etisk godkendelse fra William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Der blev indhentet informeret samtykke fra alle deltagere.
Resultater
Sikkerhed
Der blev ikke observeret nogen bivirkninger under 6 timers infusion med enten placebo (saltvand) eller testkohorter (NAD+).
Et signifikant fald i aktiviteten (1,3, 57, 3,6 enheder/L) for henholdsvis leverfunktionsenzymerne GGT, LD og AST blev observeret 8 timer efter påbegyndelse af NAD+-infusionen (tabel 1). Der var ingen signifikant ændring i aktiviteten for nogen leverfunktionsmarkør ved 8 timer i de placebobehandlede (saltvand) prøver, men det lave antal prøver kan dog reducere diskriminationsfølsomheden. Der blev også observeret en signifikant stigning på 2,75 μmol/L i plasmabilirubin. Ingen af ændringerne blev dog anset for at være klinisk signifikante.

Tabel 1. Wilcoxon Signed Ranks-testen blev anvendt til at afgøre, om forskelle i gennemsnitlige leverfunktionstestkoncentrationer var signifikante mellem baseline- og 8 timers tidspunkter.
Plasma
En kontinuerlig infusion af NAD+ med en hastighed på 3 μmol/min resulterede kun i en signifikant (398 %) stigning i plasma-NAD+-niveauerne på 6 timers tidspunktet (dvs. ved slutningen af infusionen) i forhold til baseline (p < 0,0001). Dette var signifikant forskelligt fra den 6 h saltvandsbehandlede kontrol (p < 0,001).
NAD+-niveauerne var fortsat forhøjede ved 8 h (dvs, 2 h efter infusion) i forhold til basislinjen og saltvandsbehandlede kontrolprøver.
Plasma NAD+-niveauer ændrede sig ikke signifikant fra basislinjen i løbet af vurderingsperioden på 8 h i de saltvandsbehandlede kontrolprøver (figur 1A).
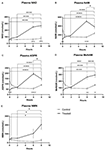
Figur 1. Ændringer i plasma nicotinamid adenin dinukleotid (NAD+) og metabolitter over 8 h . (A) NAD+, (B) nikotinamid (NAM), (C) adenosinphosphoribose (ADPR), (D) methylnikotinamid (meNAM), (E) nikotinamidmononukleotid (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, som angivet. Tovejs ANOVA med Bonferronis multiple sammenlignings post hoc-test blev anvendt til at bestemme, om gennemsnitskoncentrationen for de testede analytikere var forskellig i løbet af 8 timers perioden og mellem test- (n = 8) og kontrolgrupper (n = 3).
I lighed med de ændringer, der blev observeret for NAD+, steg plasmaniveauerne af NAD+-metabolitten nikotinamid (NAM) signifikant med 409 % ved slutningen af NAD+-infusionen (dvs, 6 h) i forhold til baseline (p < 0,0001). Dette var ligeledes signifikant forskelligt fra den 6 h saltvandsbehandlede kontrol (p < 0,001).
På tidspunktet 8 h (dvs. 2 h efter endt infusion) var NAM-niveauerne mellem kontrol- og behandlede grupper ikke længere signifikant forskellige (p > 0,05).
NAM-niveauerne for saltvandsbehandlede kontrolprøver ændrede sig ikke signifikant i løbet af 8 h tidsperioden (p > 0,05, figur 1B).
I overensstemmelse med de ændringer, der blev observeret for NAM, steg plasmaniveauerne af NAD+-metabolitten ADPR signifikant med 393 % ved afslutningen af NAD+-infusionen (dvs. 6 timer) i forhold til baseline (p < 0,0001). Dette var signifikant forskelligt fra den 6 h saltvandsbehandlede kontrol (p < 0,0001).
På tidspunktet 8 h (dvs. 2 h efter afslutningen af infusionen) var ADPR-niveauerne fortsat 305 % over baseline (p < 0,0001). Dette var imidlertid ikke signifikant større end ADPR-niveauerne i de saltvandsbehandlede kontrolprøver på samme tidspunkt (p > 0,05).
ADPR-niveauerne for saltvandsbehandlede kontrolprøver ændrede sig ikke signifikant i løbet af 8 h-tidsperioden (p > 0,05, figur 1C).
En Spearmans korrelationsanalyse mellem gruppegennemsnit på tværs af de 8 h tidspunkter for de to NAD+ kataboliske metabolitter, NAM og ADPR, gav en korrelationskoefficient på 1,00 (p < 0.001).
I overensstemmelse med de ændringer, der blev observeret for NAM, steg plasmaniveauerne af NAM-metabolitten methyl-nicotinamid (meNAM) igen signifikant til 350 % ved afslutningen af NAD+-infusionen (dvs, 6 h) i forhold til både baseline (p < 0,0001) og den 6 h saltvandsbehandlede kontrol (p < 0,01).
På 8 h-tidspunktet (dvs, 2 h efter endt infusion) forblev meNAM-niveauerne 393 % over baseline (p < 0,0001) og signifikant større end de saltvandsbehandlede kontrolprøver på samme tidspunkt (p < 0,05).
meNAM-niveauer for saltvandsbehandlede kontrolprøver ændrede sig ikke signifikant i løbet af 8 timers tidsperioden (p > 0,05, figur 1D).
Plasmaniveauerne af NMN, en metabolit af NAM via den anabole bjærgningsvej, var kun signifikant forhøjet (472 %) på 8 timers tidspunktet (dvs, 2 h efter afslutning af infusion, p < 0,05).
NMN-niveauer for saltvandsbehandlede kontrolprøver ændrede sig ikke signifikant i løbet af 8 h-tidsperioden (p > 0,05, figur 1E).
Urin
Den kontinuerlige IV-infusion af NAD+ med en hastighed på 3 μmol/min resulterede i en signifikant (538%) stigning i urinens NAD+-udskillelseshastighed på 6 h-tidspunktet (dvs, slutningen af infusionen) i forhold til den udskilte mængde på 30 min (p < 0,001). Dette var også signifikant forskelligt fra den mængde NAD+ i urinen, der blev udskilt ved 6 h af de saltvandsbehandlede kontroller (p < 0,05).
Mængden af NAD+, der blev udskilt i urinen, faldt med 43 % (p < 0,05) ved 8 h (dvs, 2 h efter infusion) i forhold til den maksimale udskillelse på 6 h tidspunktet.
Urinudskillelseshastigheden for NAD+ ændrede sig ikke signifikant i løbet af vurderingsperioden på 8 h i saltvandsbehandlede kontrolprøver (figur 2A).

Figur 2. Ændringer i urin-NAD+ og metabolitter i løbet af 8 timer (1. 6 timer bestående af en kontinuerlig, 3 μmol/min, NAD+ IV-infusion). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, som angivet. Tovejs ANOVA med Bonferronis multiple sammenlignings post hoc-test blev anvendt til at bestemme, om gennemsnitskoncentrationen for de testede analytikere var forskellig i løbet af 8 timers perioden og mellem test- (n = 8) og kontrolgrupper (n = 3).
Udskillelseshastigheden af NAD+-metabolitten NAM ændrede sig ikke signifikant i løbet af testperioden på 8 timer og var ikke forskellig fra den observerede NAM-udskillelseshastighed for de saltvandsbehandlede kontroller (figur 2B).
Udskillelseshastigheden i urinen af NAM-metabolitten meNAM var signifikant forøget (403 %) på 6 timers tidspunktet (dvs, slutningen af infusionen) i forhold til den observerede ved 30 min (p < 0,01). Mængden af meNAM, der blev udskilt i urinen, faldt med 43 % (p < 0,05) ved 8 h (dvs, 2 h efter infusion) i forhold til den maksimale udskillelse på 6 h tidspunktet.
Urinudskillelseshastigheden for meNAM ændrede sig ikke signifikant i løbet af vurderingsperioden på 8 h i saltvandsbehandlede kontroller (Figur 2C).
Diskussion
En voksende interesse for NAD+-baserede terapier, herunder NAD+-infusioner, har understreget behovet for en klarere forståelse af skæbnen for NAD+ og dets metabolitter efter IV-administration. Den aktuelle undersøgelse dokumenterer ændringer i niveauerne af NAD+ og vigtige metabolitter i både plasma og urin over 8 timer ved hjælp af et typisk klinisk doseringsregime på 750 mg NAD+, der administreres IV over en 6 timers periode.
Det er vigtigt at bemærke, at infusion af NAD+ ikke gav anledning til nogen observerbare bivirkninger i testkohorten, men snarere reducerede plasmaaktiviteterne af enzymer, der indikerer hepatisk stress, såsom intrahepatisk LD og AST og det posthepatiske (galdegangs-) enzym GGT, hvilket tyder på, at integriteten af både intrahepatisk og posthepatisk væv blev forbedret selv inden for den relativt korte tidsramme på 8 timer. Stigningen i bilirubin, et nedbrydningsprodukt af røde blodlegemer, efter 8 timer kan afspejle enten en meget lille stigning i omsætningen af røde blodlegemer, som kan forekomme som følge af infusionsinduceret hæmolyse, eller reduceret hæmmetabolisme (tabel 1). I betragtning af den meget lave størrelse af denne ændring blev dette imidlertid ikke anset for klinisk relevant.
Som forventet forblev plasmaniveauerne af NAD+ og metabolitterne NAM og ADPR og NAM-metabolitterne NMN og meNAM hos de saltvandsbehandlede (dvs. kontrol) deltagere stort set uændrede i hele 8-timers perioden. Der blev dog observeret et tilsyneladende fald i NAM, meNAM og ADPR mellem 30 minutter og 6 timer, sandsynligvis på grund af en fortyndingseffekt af saltvand. I overensstemmelse med denne opfattelse blev værdierne for disse analyter set vende tilbage til baseline-niveauet efter 8 timer (dvs, 2 h efter afslutningen af saltvandsinfusionen).
Uventet steg plasmaniveauerne af NAD+ i de deltagere, der fik NAD+-infusion, dog ikke før efter 2 h-tidspunktet og nåede et maksimum på ~400 % over baseline for NAD+ og metabolitterne NAM, meNAM og ADPR (henholdsvis 398 %, 409 % og 393 %) først ved 6 h-tidspunktet (figur 1A-E). Dette var internt i overensstemmelse med toppen af urinudskillelsen for både NAD+ og meNAM, der også indtraf ved 6 h, før den hurtigt faldt efter endt infusion (figur 2A-C).
NAD+ blev infunderet med en konstant hastighed på 3 μmol/min. Derfor blev 90 μmol NAD+ infunderet direkte ind i det vaskulære kompartment hvert 30. minut, hvilket gav en samlet mængde på 1 080 μmol ved slutningen af infusionen efter 6 timer. Intravaskulær blanding fra ethvert infusionspunkt sker inden for ~2 minutter; hvis man antager et gennemsnitligt blodvolumen på 5, ville det tilsatte NAD+, i fravær af betydelig metabolisme eller absorption, svare til en yderligere stigning i (NAD+) på mindst 18 μM hvert 30. minut i løbet af de 6 timers infusion. Selv om en stigning af denne størrelsesorden ligger godt inden for denne undersøgelses analytiske detektionsgrænser, blev der ikke observeret nogen stigning i hverken NAD+ eller dets metabolitter før efter 2 timer (dvs. på det 6 timer lange tidspunkt) i hverken plasma eller urin. Denne uventede observation tyder på en hurtig og i det mindste i de første 2 timer fuldstændig vævsoptagelse og/eller metabolisme af NAD+ og/eller dets metabolitter i vævet.
En række enzymer kan opnå effektiv NAD+-katabolisme, herunder sirtuinerne (SIRT 1-7), adenosindiphosphat (ADP)-ribose-transferaserne (ART) og poly(ADP-ribose)-polymeraserne (PARP 1-17) og de cykliske ADP-ribose (cADPR)-syntaser (CD38, CD157). Ekstracellulære NAD+ pyrofosfataser, der findes i humant serum, kan også nedbryde NAD+ til AMP og NMN (Schmidt-Brauns et al., 2001). Celleoverfladeproteinet CD73 omdanner også NMN til NR, som let krydser cellemembraner med henblik på potentiel resyntese til NAD+. Det er vigtigt, at de NAD+-kataboliserende glykohydrolaser, CD38 og CD157, ekto-nukleotidpyrofosfatase (CD203a) og NMN-katabolisatoren CD73 er ektoenzymer, der findes på en lang række celler, herunder lymfoide, granulocytære, neuronale og endotelceller (Wei et al., 2014), og plasmaopløselige NAD-glykohydrolaser kan også være til stede (figur 3; Funaro et al., 2009). Den parallelle stigning i plasma-NAM og ADPR (korrelationskoefficient på 1,000, p < 0,001, data ikke vist) tyder stærkt på, at i det mindste ved 6 h er en vigtig skæbne for NAD+ metabolisme gennem spaltning af den glykosidiske ADPribose-nicotinamidbinding til NAM og ADPR, biprodukter, der er symptomatiske for NAD-glykohydrolaseaktivitet (f.eks. CD38). Dette er i overensstemmelse med beviser fra andre, hvor især CD38 er blevet vist at have en primær rolle i kontrollen af ekstracellulære NAD+-niveauer (Wei et al., 2014). Voksne humane erytrocytter er CD38-positive og udtrykker høje niveauer af NAD+ glykohydrolaseaktivitet, der spalter eksogent NAD+ for at forsyne erytrocytterne med ADP ribose, der effektivt kan optages i cellen (Kim et al., 1993; Albeniz et al., 2004). Den manglende stigning i enten NAD+ eller metabolitter i plasma eller urin indtil efter de første 2 timer af infusionen tyder på, at NAD+ og/eller dets metabolitter transporteres ud af det ekstracellulære vaskulære rum og effektivt sekventeres i væv eller ekstravaskulære kompartmenter som NAD+ og/eller dets metabolitter i denne periode.

Figur 3. Mulig ekstracellulær katabolisme af eksogent tilført NAD+ gennem aktivitet af ektoenzymerne CD38 (ADP-ribosesynthase (ADPR)), CD203a (NAD+ pyrofosfatase), CD 73 (5′-nucleotidase), CD157-ADP-ribosylcyklase 2. Forkortelser: NAM, nikotinamid; NMN, nikotinamidmononukleotid; ADPR, adenosindiphosphatribosid; meNAM, methylnikotinamid; 4PY, N-methyl-4-pyridon-3-carboxamid; 2PY, methyl-2-pyridon-5-carboxamid; ARPP, ADP ribose pyrophosphatase; RPPK, ribosyl pyrophosphokinase; NAmpt, nicotinamid phosphoribosyltransferrase; NMNAT, nicotinamid mononukleotidadenyltransferase; CX-43, connexin 43.
Og selv om PARP og sirtuiner er involveret i NAD+-katabolisme, er det usandsynligt, at de som intracellulære enzymer med repræsentanter i cytoplasma, kerne og mitokondrier har direkte indflydelse på de ekstracellulære NAD+-niveauer. Disse enzymer kan dog forventes at reagere på ændringer i de intracellulære koncentrationer af NAD+, NAM og NR, som kan opstå ved tilførsel af eksogent NAD+. Figur 4 opsummerer skematisk de mulige skæbner for eksogent NAD+.
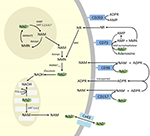
Figur 4. Mulig intra- og ekstracellulær skæbne for eksogent tilført NAD+. Forkortelser: CD38 , CD203a (NAD+ pyrofosfatase), CD 73 (5′-nucleotidase). NAM, nikotinamid; NMN, nikotinamidmononukleotid; ADPR, adenosindiphosphat ribosid; meNAM, methylnikotinamid; 4PY, N-methyl-4-pyridon-3-carboxamid; 2PY, methyl-2-pyridon-5-carboxamid; ARPP, ADP ribose pyrophosphatase; RPPK, ribosyl pyrophosphokinase; NAmpt, nicotinamid phosphoribosyltransferrase; NMNAT, nicotinamid mononukleotidadenyltransferase; PARP ; NRK .
Selv om der er betydelig kapacitet til hurtig nedbrydning af det exogent tilførte IV NAD+ til metabolitter, er det også værd at bemærke, at der også kan forekomme optagelse af ekstracellulært NAD+. Da NAD+ har en negativ ladning, er det ikke i stand til passivt at krydse cellemembraner og skal derfor transporteres aktivt over membranen. At dette sker, er blevet påvist af en række forskere, som har rapporteret, at eksogent NAD+, der påføres en række forskellige humane celletyper, faktisk resulterer i en betydelig forøgelse af intracellulært NAD+ (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Mens den eller de involverede mekanismer endnu ikke er fuldt ud karakteriseret, rapporterede Alano et al. (2010), at eksogent NAD+ kunne komme ind i neuroner gennem P2X7-gated kanaler, og andre har konsekvent observeret transport af NAD+ gennem membraner ved hjælp af connexin 43 (CX43) hemichannels, selv ved koncentrationer så lave som 250 pM (Billington et al., 2008). Da connexiner har en bred fordeling i humant væv, og CX43 synes at være det mest allestedsnærværende connexin i mange celletyper, kan potentialet for hurtig optagelse af NAD+ ikke udelukkes.
Det ser således ud til, at den cellulære optagelse og/eller metabolisme af NAD+ og metabolitterne NAM og ADPR og de sekundære metabolitter meNAM og NMN synes at foregå i takt med NAD+-infusionen på 3 μmol/min i mindst de første 2 timer. Enten bliver NAD+ og/eller de testede primære metabolitter effektivt bundet i denne første 2-6 timer lange periode, eller også dannes der sekundære metabolitter. ADPR kan genbruges til at producere NAD+ fra NAM (figur 4) eller metaboliseres yderligere via ektoenzymer som f.eks. CD203a (NAD+ pyrofosfatase) til at producere AMP, som kan metaboliseres yderligere hurtigt til adenosin af CD73 a 5′-nucleotidase (Bogan og Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). Til støtte for denne hypotese er en stigning i blodets adenosinniveauer blevet anerkendt af andre som en konsekvens af ekstracellulær NAD+-infusion (Szczepaññska-Konkel et al., 2003). NAM kan også metaboliseres til NMN via bjærgningsvejen før resyntese til NAD+ (figur 3, 4) eller påvirkes af hepatiske methyltransferaser for at producere N1-methylnicotinamid, som enten kan udskilles direkte eller omdannes yderligere til N-methyl-2-pyridon-5-carboxamid (2PY, +99 % af meNAM) og N-methyl-4-pyridon-3-carboxamid (4PY, ~0.25% af meNAM) før udskillelse (Shibata og Matsuo, 1989; Okamoto et al, 2003).
Det er tydeligt, at ved den anvendte doseringsregime har de mekanismer, der er involveret i metabolisme og sekventering af NAD+ og metabolitter, nået mætning engang efter 2 timer, hvilket resulterer i en betydelig forhøjelse af plasma-NAD+ og akkumulering af alle testede metabolitter (NMA, ADPR, meNAM og NMN) efter 6 timer. Som tidligere nævnt støtter disse data det synspunkt, at en af de vigtigste veje for NAD+-metabolismen under disse forhold er spaltning af den glykosidiske binding ved hjælp af ektoenzymer som CD38 til produktion af NAM og ADPR. Stigningen i plasma-NMN efter 2 timer tyder imidlertid også på, at exogent NAD+ sandsynligvis påvirkes af ekstracellulære NAD+ pyrofosfataser, hvilket øger plasma-NMN og frigør AMP som en yderligere metabolit.
Sammenfattende har denne undersøgelse for første gang afsløret, at: (a) ved en strømningshastighed på 3 μmole/min blev al exogent infunderet NAD+ hurtigt og fuldstændigt fjernet fra plasma i mindst de første 2 timer; (b) stigningen i de analyserede metaboliske bi-produkter er i overensstemmelse med NAD+-glykohydrolaser og NAD+-pyrofosfataseaktivitet; og (c) de urinudskillelsesprodukter, der stammer fra NAD+-infusion, omfatter native NAD+ og meNAM, men ikke NAM.
Selv om resultaterne af denne undersøgelse er nye og i nogen grad bidrager til at fremme vores forståelse af den tidsmæssige skæbne af eksogen NAD+ hos mennesker, blev der identificeret begrænsninger. For at forbedre det samlede metaboliske regnskab bør fremtidige undersøgelser undersøge ændringer i røde cellers NAD+ og metabolitter og urinudskillelse af de sekundære meNAM-metabolitter, 2PY og 4PY, for at forbedre det samlede metaboliske regnskab. Desuden vil det sandsynligvis være nyttigt at vurdere virkningen af eksogent NAD+ på ændringer i purinmetabolismen, hvilket i det mindste bør omfatte vurdering af plasma- og rødcelle-AMP og adenosin. Anvendelse af dyremodeller kan også bidrage til at klarlægge den relative involvering af de forskellige metaboliske veje ved hjælp af passende farmakologiske inhibitorer og vævsprøver.
Sammenfattende kunne denne undersøgelse for første gang afsløre nogle meget nyttige, tidligere ukendte oplysninger om skæbnen af exogent IV NAD+ hos mennesker, herunder den generelle sikkerhed og tolerabilitet af en IV NAD+-infusion med en hastighed på 3 μmol/min, den hurtige udskillelse af NAD+ fra plasma, det sandsynlige bidrag fra både NAD+ glykohydrolase- og NAD+ pyrofosfataktivitet i metabolismen af NAD+ og den tilsyneladende effektive renale tubulære reabsorption af NAM. Der er dog behov for yderligere forskning for fuldt ud at afdække dette vigtige molekyls komplekse metaboliske skæbne. Endvidere vil karakteriseringen af disse ændringer bidrage til at fremme udviklingen og forbedringen af NAD+-baserede behandlingsregimer for sygdomme, som sandsynligvis vil drage fordel af øget NAD+-tilgængelighed, herunder tilstande, der kræver øget cellulær regeneration og reparation, såsom Alzheimers sygdom og andre neurodegenerative demenssygdomme.
Datatilgængelighed
Datasættene, der er genereret til denne undersøgelse, er tilgængelige på anmodning til den tilsvarende forfatter.
Ethisk erklæring
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Patienterne/deltagerne gav deres skriftlige informerede samtykke til at deltage i denne undersøgelse.
Author Contributions
RG deltog i undersøgelsesdesign og tilsyn, kritisk diskussion og manuskriptforfatterskab. JBer deltog i undersøgelsesdesign, kritisk diskussion, dataindsamling, statistisk analyse, manuskriptudarbejdelse og manuskriptgennemgang. RM deltog i undersøgelsesdesign, kritisk diskussion, klinisk tilsyn og manuskriptgennemgang. NB deltog i biokemisk analyse og manuskriptgennemgang. JW deltog i undersøgelsesdesign, kritisk diskussion og manuskriptgennemgang. JBen deltog i dataindsamling og manuskriptgennemgang. SB deltog i udformningen af undersøgelsen og gennemgik manuskriptet. Alle forfattere har gennemgået, læst og godkendt den endelige version af manuskriptet og er enige i rækkefølgen af forfatternes præsentation.
Funding
Denne undersøgelse blev finansieret i fællesskab af NAD+ Research Inc, (LA, USA) og Australasian Research Institute Incorporation (Sydney, Australien) og blev udført på Springfield Wellness Center, Springfield, LA, USA.
Interessekonflikterklæring
RM er direktør for NAD+ Research Inc. og medicinsk direktør for Springfield Wellness Center, som anvender IV NAD som klinisk terapi. SB modtog konsulenthonorarer fra NAD+ Research Inc.
De øvrige forfattere erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi ønsker at takke Archway Apothecary Pty Limited, LA, USA, for deres gratis levering af IV NAD+ til dette projekt.
Abeti, R., og Duchen, M. R. (2012). Aktivering af PARP ved oxidativ stress induceret af β-amyloid: implikationer for Alzheimers sygdom. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). En åben, ikke-randomiseret undersøgelse af farmakokinetikken af ernæringstilskuddet nicotinamid ribosid (NR) og dets virkninger på blodets NAD+-niveauer hos raske frivillige. PLoS One 12:e010186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., og Swanson, R. A. (2010). NAD+-udtømning er nødvendig og tilstrækkelig for PARP-1-medieret neuronal død. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., og Bermek, E. (2004). NAD-glykohydrolaseaktiviteter og adp-riboseoptagelse i erytrocytter fra normale personer og kræftpatienter. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Karakterisering af NAD+-optagelse i pattedyrceller. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., og Brenner, C. (2010). 5′-nukleotidaser og deres nye roller i NAD+ og fosfatmetabolisme. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., og Grant, R. (2011). Aldersrelaterede ændringer i NAD+ metabolisme oxidativ stress og sirt1 aktivitet i wistar rotter. PLoS One 6:e1919194. doi: 10.1371/journal.pone.001919194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Kortlægning af NAD+-metabolisme i hjernen hos aldrende Wistar-rotter: potentielle mål for påvirkning af senescens i hjernen. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Kvantificering af det cellulære NAD+-metabolom ved hjælp af en tandemvæskekromatografisk massespektrometritilgang. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., og Braidy, N. (2018). Plasma NAD+-metabolomet er dysreguleret i “normal” aldring. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rolle af endothelial NAD+-mangel i aldersrelateret vaskulær dysfunktion. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., og Milbrandt, J. (2017). SARM1 toll/interleukin-1-receptordomænet SARM1 besidder en iboende NAD+-spaltningsaktivitet, der fremmer patologisk axonal degeneration. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., og Chiarugi, A. (2013). Indsigt i molekylære og funktionelle egenskaber af NMNAT3 afslører nye antydninger af NAD-homeostase i menneskelige mitokondrier. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzymer og medfødt immunitet: den menneskelige CD157’s rolle i leukocyt-trafikken. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). Pellagra’s ætiologi: Betydningen af visse epidemiologiske observationer i forbindelse hermed. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Ændringer i oxidativ skade, inflammation og med alderen i cerebrospinalvæske. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenosin genereret i knoglemarvsnichen gennem en CD38-medieret vej korrelerer med progression af humant myelom. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., og An, N. H. (1993). Funktion af NAD glycohydorlase i ADP-riboseoptagelse fra humane erythrocytter. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., og Schuh, R. A. (2015). Effekt af nikotinamidmononukleotid på hjernens mitokondrielle respiratoriske underskud i en Alzheimers sygdom-relevant murinmodel. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Aldersassocierede ændringer i oxidativ stress og NAD+-metabolisme i humant væv. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Addiction the Dark Night of the Soul, NAD+ the Light of Hope. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Langtidsadministration af nikotinamidmononukleotid afbøder aldersassocieret fysiologisk tilbagegang hos mus. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., og Malavasi, F. (2018). Den rolle, som ekstracellulær adenosingenerering spiller i udviklingen af autoimmune sygdomme. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN i forebyggelse, diagnose og behandling af stofmisbrug. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Døgnvariationer i menneskers urinudskillelse af nicotinamid-katabolitter: virkninger af stress på metabolismen af nicotinamid. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., og Gupta, M. P. (2005). Poly(ADP-ribose)polymerase-1-afhængig hjertemyocytcelledød under hjertesvigt er medieret af NAD+-udtømning og reduceret Sir2α deacetylaseaktivitet. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Farmakologiske virkninger af eksogen NAD på mitokondriel bioenergetik, DNA-reparation og apoptose. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., og Reidl, J. (2001). Er en NAD-pyrofosfataseaktivitet nødvendig for Haemophilus influenzae type b-multiplikation i blodstrømmen? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., og Matsuo, H. (1989). Korrelation mellem niacinækvivalent indtag og urinudskillelse af dets metabolitter, N’-methylnicotinamid, N’-methyl-2-pyridon-5-carboxamid og N’-methyl-4-pyridon-3-carboxamid, hos mennesker, der indtager en selvvalgt fødevare. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Signalering af oxidativ stress i Alzheimers sygdom. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., og Angielski, S. (2003). Renal hæmodynamik og natriuretisk respons på intravenøs administration af diadenosintetraphosphat (ap4a) og nikotinamidadenindinukleotid (NAD) hos rotter. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., og Yue, J. (2014). Roller og mekanismer i CD38/cyklisk adenosindiphosphat ribose/Ca2+-signalvejen. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., og Yan, L. J. (2016). Kilder og konsekvenser af NADH/NAD+ redox ubalance i diabetes og dens komplikationer. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., og Tsuchiya, M. (2006). Simultan måling af nikotinamid-adenin-dinukleotid og beslægtede forbindelser ved hjælp af væskekromatografi/elektrospray-ioniseringstandem-massespektrometri. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Roller af NAD+, PARP-1 og sirtuiner i celledød, iskæmisk hjerneskade og synkrotronstråling røntgeninduceret vævsskade. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., og Swanson, R. A. (2003). NAD+-tilførsel forhindrer PARP-1-induceret glykolytisk blokade og celledød i dyrkede astrocytter i musekulturer. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G., og Xiong, Z.-G. (2010). Oxidativ stress og NAD+ i iskæmisk hjerneskade: nuværende fremskridt og fremtidige perspektiver. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., og Imai, S. I. (2018). NAD+-mellemprodukter: biologi og terapeutisk potentiale af NMN og NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., og Imai, S. (2011). Nicotinamidmononukleotid, et centralt NAD+-mellemprodukt, behandler patofysiologien af diæt- og aldersinduceret diabetes hos mus. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Neuronal død induceret af misfoldet prionprotein skyldes NAD+-udtømning og kan afhjælpes in vitro og in vivo ved NAD+ genopfyldning. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., og Ying, W. (2005). NADH kan trænge ind i astrocytter for at blokere PARP-1-medieret astrocytdød. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., og Perry, G. (2007). Årsager til oxidativ stress ved Alzheimers sygdom. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar