- Introducere
- Materiale și metode
- Participanți
- Standardizarea dietei
- Protocolul de perfuzie
- Coletarea probelor de sânge
- Coletarea probelor de urină
- Metoda analitică
- Siguranță
- Analiză statistică
- Etica
- Rezultate
- Siguranță
- Plasma
- Urină
- Discuție
- Disponibilitatea datelor
- Declarație etică
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
- Recunoștințe
Introducere
Nucleotida piridinică mamă, nicotinamida adenină dinucleotidă (NAD+) este prezentă în toate celulele organismului și este esențială pentru viabilitatea și funcționarea celulelor.
În calitate de cofactor responsabil pentru transportul de electroni în lanțul respirator, NAD+ și cuplul său redox NADH sunt esențiale pentru producerea de energie (ATP) în mitocondrii prin fosforilarea oxidativă. Metabolitul fosforilat al NAD+, NADP+, împreună cu cuplul său redox NADPH, furnizează, de asemenea, puterea de reducere pentru a conduce o serie de reacții anabolice, inclusiv sinteza colesterolului și a acizilor nucleici, elongația acizilor grași și regenerarea glutationului (GSH), unul dintre principalii antioxidanți ai organismului. În ansamblu, această familie de nucleotide piridinice, , contribuie la schimbul redox a peste 400 de reacții enzimatice. Este important faptul că, atunci când acționează ca un cuplu redox, NAD+ nu este consumat. Cu toate acestea, NAD+ servește, de asemenea, ca substrat pentru o serie de alte procese metabolice importante și, prin urmare, este consumat ca urmare a reacțiilor chimice ale acestora, ceea ce poate epuiza țesutul de NAD+. În acest număr sunt incluse reacțiile conduse de familia de enzime poli adenozin fosforibază-riboză (ADPR) (PARP 1-17) care controlează repararea ADN-ului și stabilitatea nucleară, enzimele de control epigenetic (Sirt1-7), comunicarea imună intercelulară (CD38/CD157) și regenerarea neuronală (SARM1; Essuman et al., 2017). Prin urmare, există potențialul de perturbare a metabolismului celular la mai multe niveluri în condițiile în care consumul de NAD+ de către aceste enzime depășește aportul sau sinteza de NAD+.
Importanța clinică a menținerii nivelurilor de NAD+ celular a fost stabilită la începutul secolului trecut, odată cu descoperirea faptului că pelagra, o boală caracterizată prin diaree, dermatită, demență și deces, putea fi vindecată cu alimente care conțineau precursorul NAD+, niacina (cunoscută și sub numele de vitamina B3; Goldberger, 1914). Deși pelagra este rară în țările dezvoltate, s-a demonstrat că concentrațiile celulare de NAD+ scad în condiții de deteriorare oxidativă crescută, cum ar fi cele care apar în timpul îmbătrânirii (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). S-a constatat că nivelurile modificate de NAD+ însoțesc mai multe afecțiuni asociate cu daune oxidative/radicali liberi crescute, inclusiv diabetul (Wu et al., 2016), bolile cardiace (Pillai et al., 2005), disfuncția vasculară legată de vârstă (Csiszar et al., 2019), leziunile ischemice ale creierului (Ying și Xiong, 2010), proteinele neuronale prost pliate (Zhou et al., 2015) și demența Alzheimer (Abeti și Duchen, 2012).
În plus față de semnele patologice caracteristice ale plăcilor Aβ și încurcăturilor neurofibrilare tau, leziunile oxidative sunt o constatare constantă în boala Alzheimer și sunt recunoscute pe scară largă ca fiind un eveniment timpuriu în procesul patogenic, chiar înaintea depunerii Aβ (Su et al., 2008). În timp ce speciile reactive de oxigen (ROS) care cauzează aceste leziuni provin probabil din surse multiple, se crede că mitocondriile disfuncționale și disponibilitatea metalelor redox active, cum ar fi Fe++ și Cu+, joacă un rol dominant (Zhua et al., 2007).
O consecință majoră a stresului oxidativ celular, în creier și în alte părți, sunt rupturile monocatenare sau bicatenare ale ADN-ului. Ca răspuns la deteriorarea ADN, PARP1 hidrolizează NAD+ pentru a produce polimeri de ADP-riboză (Ying, 2013). Am arătat anterior că nivelurile de NAD+ au fost invers corelate cu măsurile de stres oxidativ în țesutul uman (Massudi et al., 2012) și în creierul de șobolan (Braidy et al., 2014). Astfel, în timp ce nivelurile reduse de NAD+ în creierul bolnavilor de Alzheimer în viață așteaptă să fie confirmate prin tehnici neinvazive, constatările consecvente de leziuni oxidative în creierul post-mortem susțin cu tărie opinia că o reînnoire și o epuizare accelerată a NAD+ contribuie la disfuncția neurologică în această boală. Deoarece s-a demonstrat că intervențiile care vizează restabilirea NAD+ au demonstrat în modelele animale că susțin îmbătrânirea sănătoasă și îmbunătățesc funcția metabolică (Yoshino et al., 2011; Mills et al., 2016) și demența (Long et al., 2015), se explorează în mod activ strategii de creștere a nivelurilor de NAD+ la om.
Cea mai directă metodă de creștere a nivelurilor de NAD+ este prin administrare intravenoasă (IV). Deși datele din cercetările experimentale sunt minime, beneficiul clinic semnificativ al perfuziei IV de NAD+ în sevrajul la alcool a fost raportat anterior (O’Holleran, 1961; Mestayer, 2019). În mod surprinzător, în timp ce administrarea orală a precursorilor NAD+, cum ar fi ribozidul de nicotinamidă (NR) sau mononucleotida de nicotinamidă (NMN), este investigată cu entuziasm pentru impactul lor asupra nivelurilor de NAD+ (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), soarta metabolică și proprietățile farmacocinetice ale administrării IV de NAD+ nu au fost încă raportate la om. Prin urmare, acest studiu prezintă pentru prima dată modificările concentrațiilor de NAD+ și de metaboliți ai acestuia în timpul unei perfuzii IV de NAD+ într-o cohortă de participanți sănătoși de sex masculin.
Materiale și metode
Participanți
Opt (Test n = 8, Control n = 3) participanți de sex masculin cu vârste cuprinse între 30 și 55 de ani au fost recrutați prin intermediul anunțurilor publicitare la radio, TV și în rețelele de socializare. Toți participanții aveau un IMC mai mic de 30 kg/m2 (IMC mediu al Testului = 27,5 ± 2,5 kg/m2; IMC mediu al Controlului = 24,6 ± 6,5 kg/m2), nu erau diabetici, fumau mai puțin de 1 țigară și consumau mai puțin de 2 băuturi alcoolice standard pe zi. Au fost excluse din studiu persoanele care luau medicamente hipolipemiante sau antiinflamatoare, care aveau antecedente de insuficiență hepatică sau renală sau care au suferit recent o infecție microbiană, traume sau orice alte tulburări medicale semnificative sau netratate. Subiecții au primit o compensație monetară pentru timpul și participarea lor, indiferent dacă au finalizat sau nu experimentul. Participanților nu li s-a permis să utilizeze produse naturale de sănătate care conțin NAD+, NR sau nicotinamidă în cele 14 zile anterioare și pe parcursul studiului.
Standardizarea dietei
În ziua anterioară perfuziei IV cu NAD+, participanții au consumat o dietă identică cu conținut redus de niacină și au băut doar apă.
Nu s-a consumat niciun aliment în ziua studiului până după ce a fost colectată ultima probă de sânge/urină de 8 ore. Participanții au fost încurajați să bea apă pentru a rămâne hidratați în mod normal. Nu au fost permise alte tipuri de băuturi.
Pentru a se asigura menținerea unui aport energetic adecvat pentru participanți în timpul perfuziei de 6 h, soluția intravenoasă conținea, de asemenea, 0,1% de dextroză, furnizând aproximativ 2.000 de calorii pe parcursul perioadei de perfuzie de 6 h.
Protocolul de perfuzie
Participanții au fost repartizați aleatoriu fie în grupul Test (n = 8), fie în grupul Control (n = 3). Participanților din grupul Test li s-a administrat intravenos 750 mg NAD+ în soluție salină normală (Archway Apothecary, Covington, LA, SUA) pe o perioadă de 6 h (rata de perfuzie = ~2 mg/min ≡ 3 μmoli/min). Această doză de NAD+ a fost derivată în mod empiric și reflectă un regim de dozare obișnuit în clinicile (de exemplu, Springfield Wellness Clinic, Springfield, LA, SUA) care furnizează în mod regulat perfuzii IV de NAD+ în practica clinică. Participanților din grupul de control li s-a administrat intravenos soluție salină normală pe o perioadă de 6 h.
Administrarea clinică și supravegherea perfuziilor intravenoase și a colectării probelor au fost efectuate la Springfield Wellness Center, Springfield, LA, SUA.
Coletarea probelor de sânge
Aprobe de sânge de bază (TO) au fost colectate la toți participanții după un post de 12 h peste noapte, programat să aibă loc imediat înainte de începerea perfuziei. S-au recoltat apoi probe suplimentare la 30, 60, 120 (2 h), 360 (6 h) și 480 (8 h) minute după începerea perfuziei.
Sângele total a fost recoltat prin puncție venoasă standard (brațul opus locului de perfuzie) într-un tub heparinizat non-gel de 5 ml. Imediat după recoltare, sângele a fost centrifugat la 4°C timp de 10 minute la 1.409× g.
Fracțiunile de plasmă și de globule roșii au fost imediat separate și distribuite în 5 × 500 μL alicote fiecare. Toate alicotele au fost apoi congelate imediat și depozitate la -80°C până la analiză.
Coletarea probelor de urină
După colectarea unei probe de urină de bază la mijlocul fluxului, participanților li s-a cerut să elimine toată urina în recipientul (recipientele) furnizat(e) la 30 min, 2 h, 6 h și 8 h după inițierea perfuziei de NAD+. În cazul în care participanții trebuiau să elimine urina intermitent între aceste momente, li s-a cerut să o facă în următorul recipient succesiv. Toate probele au fost alicotate și depozitate la -80°C imediat după primire.
Metoda analitică
Separarea cromatografică a NAD+ și a metaboliților înrudiți și detectarea MS Cromatografia lichidă cuplată la spectrometria de masă în tandem (LC/MS/MS) a fost efectuată cu ajutorul unui spectrometru de masă Sciex QTRAP 5500 (Sciex, Redwood City, CA, SUA), așa cum a fost descrisă anterior (Clement et al., 2018). Pe scurt, 100 μL de plasmă sau urină umană a fost extrasă în 400 μL de metanol rece ca gheața, centrifugată la 4°C timp de 10 min și filtrată prin cartușe cu membrană de 3 kDa. Extractele de probă au fost uscate în vid, reconstituite în 200 μL de tampon NH4OAc 100 mM și transferate în flacoane de sticlă de 200 μL și capsulate înainte de analiza LC/MS/MS. Standardele și probele (20 μL) au fost injectate pe o coloană Phenomenex NH2 (150 mm- 2 mm- 3 mm), așa cum s-a descris anterior. S-a utilizat un gradient de solvent binar format din 5 mM NH4OAc pH 9,5 ajustat cu amoniac (faza mobilă A) și acetonitril (faza mobilă B) cu un debit de 250 μL/min. Compoziția inițială a solventului la injectare a fost de 25 % A, urmată de un gradient de 2 minute până la 45 % A și o rampă rapidă de gradient până la 80 % A (0,1 min) care a fost menținută timp de 5,9 min, A a fost crescută din nou până la 95 % (2 min), menținută timp de 13 min, apoi s-a revenit la condițiile inițiale (0,1 min) pentru echilibrare, cu un timp total de funcționare de 30 min. Fluxul coloanei a fost direcționat în detectorul MS. Curbele de calibrare a metaboliților individuali au fost construite folosind rapoartele suprafețelor de vârf (suprafața de vârf a metabolitului împărțită la suprafața de vârf a SI selectat) ale fiecărui calibrator în funcție de concentrația acestuia.
Estandardele interne au constat din 2H2NAM (pentru NAM, metilNAM și ADPR) și 13C5;-Cyclic AMP (pentru NMN și NAD+). Rețineți că, deoarece etichetele izotopice nu sunt disponibile în comerț pentru toți metaboliții NAD, poate fi utilizată și o moleculă strâns înrudită (analog structural) (Yamada et al., 2006), cu condiția ca aceasta să fie considerată a avea o stabilitate și o eficiență de ionizare similare în timpul analizei. Standardele interne selectate în acest studiu au fost optimizate anterior pentru metabolitul înrudit (Bustamante et al., 2017).
Siguranță
Siguranța NAD+ intravenos a fost evaluată cu ajutorul testelor funcției hepatice și a observației clinice a oricăror evenimente adverse. Testele funcției hepatice au constat în ser, bilirubina totală (bili), fosfataza alcalină (ALP), alanin aminotransferaza (ALT), gama glutamil transferaza (GGT), lactat dehidrogenază (LD) și aspartat aminotransferaza (AST).
Analiză statistică
Analiza statistică a fost finalizată utilizând SPSS versiunea 24 și GraphPad Prism versiunea 8 pentru Windows. A fost utilizată o ANOVA în două direcții, cu medii neponderate, cu testul post hoc de comparație multiplă Bonferroni, pentru a determina dacă concentrația medie pentru analiștii testați a fost diferită pe parcursul perioadei de 8 h și între grupurile Test și Control. Testul Wilcoxon Signed Ranks a fost utilizat pentru a determina dacă diferențele dintre concentrațiile medii ale testelor funcției hepatice au fost semnificative între punctele de referință și cele 8 h. Diferențele au fost considerate semnificative din punct de vedere statistic atunci când p < 0,05.
Etica
Acest studiu a fost efectuat în conformitate cu Codul de etică al Asociației Medicale Mondiale (Declarația de la Helsinki) pentru experimentele care implică oameni. Aprobarea etică a fost obținută de la William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Consimțământul în cunoștință de cauză a fost obținut de la toți participanții.
Rezultate
Siguranță
Nu au fost observate evenimente adverse în timpul perfuziei de 6 h cu cohortele placebo (soluție salină) sau de testare (NAD+).
O scădere semnificativă a activității (1,3, 57, 3,6 unități/L) pentru enzimele funcției hepatice GGT, LD și, respectiv, AST, a fost observată la 8 h după inițierea perfuziei cu NAD+ (tabelul 1). Nu a fost evidentă nicio modificare semnificativă a activității pentru niciun marker al funcției hepatice la 8 h în probele tratate cu placebo (soluție salină), însă numărul redus de probe poate reduce sensibilitatea la discriminare. S-a observat, de asemenea, o creștere semnificativă de 2,75 μmoli/L a bilirubinei plasmatice. Cu toate acestea, niciuna dintre modificări nu a fost considerată semnificativă din punct de vedere clinic.

Tabelul 1. Testul Wilcoxon Signed Ranks a fost utilizat pentru a determina dacă diferențele în concentrațiile medii ale testelor funcției hepatice au fost semnificative între punctele de referință și punctele de timp de 8 h.
Plasma
O perfuzie continuă de NAD+ la o rată de 3 μmoli/min a dus la o creștere semnificativă (398%) a nivelurilor plasmatice de NAD+ numai la punctul de timp de 6 h (adică la sfârșitul perfuziei) în raport cu punctul de referință (p < 0,0001). Acest lucru a fost semnificativ diferit față de martorul tratat cu soluție salină timp de 6 h (p < 0,001).
Nivelurile de NAD+ au rămas ridicate la 8 h (i.e, 2 h după perfuzie) în raport cu valorile inițiale și cu probele de control tratate cu soluție salină.
Nivelurile plasmatice de NAD+ nu s-au modificat semnificativ față de valorile inițiale pe parcursul perioadei de evaluare de 8 h în probele de control tratate cu soluție salină (Figura 1A).
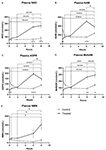
Figura 1. Modificări ale nicotinamidei adenină dinucleotide (NAD+) plasmatice și ale metaboliților pe parcursul a 8 h . (A) NAD+, (B) Nicotinamidă (NAM), (C) adenozină fosforibază (ADPR), (D) metil nicotinamidă (meNAM), (E) nicotinamidă mononucleotidă (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, după cum este indicat. ANOVA în două direcții cu testul post hoc de comparație multiplă Bonferroni a fost utilizat pentru a determina dacă concentrația medie pentru analiștii testați au fost diferite pe parcursul perioadei de 8 h și între grupurile Test (n = 8) și Control (n = 3).
Similare modificărilor observate pentru NAD+, nivelurile plasmatice ale metabolitului NAD+ nicotinamidă (NAM) au crescut semnificativ cu 409% la sfârșitul perfuziei de NAD+ (adică, 6 h) în raport cu valorile inițiale (p < 0,0001). Acest lucru a fost, de asemenea, semnificativ diferit față de martorul tratat cu soluție salină timp de 6 h (p < 0,001).
La punctul de timp de 8 h (adică la 2 h după terminarea perfuziei), nivelurile de NAM între grupurile de control și cele tratate nu au mai fost semnificativ diferite (p > 0,05).
Nivelurile de NAM pentru probele de control tratate cu soluție salină nu s-au schimbat semnificativ de-a lungul perioadei de timp de 8 h (p > 0,05, Figura 1B).
În concordanță cu modificările observate pentru NAM, nivelurile plasmatice ale metabolitului NAD+ ADPR au crescut semnificativ cu 393% la sfârșitul perfuziei de NAD+ (adică 6 ore) în raport cu linia de bază (p < 0,0001). Acest lucru a fost semnificativ diferit față de martorul tratat cu soluție salină timp de 6 h (p < 0,0001).
La punctul de timp de 8 h (adică la 2 h după terminarea perfuziei), nivelurile ADPR au rămas cu 305% peste nivelul inițial (p < 0,0001). Cu toate acestea, acest lucru nu a fost semnificativ mai mare decât nivelurile ADPR în eșantioanele de control tratate cu soluție salină la același moment (p > 0,05).
Nivelurile ADPR pentru eșantioanele de control tratate cu soluție salină nu s-au schimbat semnificativ de-a lungul perioadei de timp de 8 h (p > 0,05, Figura 1C).
O analiză de corelație Spearman între mediile de grup pe parcursul celor 8 h de timp pentru cei doi metaboliți catabolici NAD+, NAM și ADPR, a produs un coeficient de corelație de 1,00 (p < 0.001).
Din nou, în concordanță cu modificările observate pentru NAM, nivelurile plasmatice ale metabolitului NAM, metil-nicotinamida (meNAM) au crescut semnificativ până la 350% la sfârșitul perfuziei de NAD+ (i.e, 6 h) atât față de nivelul inițial (p < 0,0001), cât și față de martorul tratat cu soluție salină timp de 6 h (p < 0,01).
La momentul de timp de 8 h (i.e, 2 h după terminarea perfuziei) nivelurile de meNAM au rămas cu 393% peste nivelul inițial (p < 0,0001) și semnificativ mai mari decât probele de control tratate cu soluție salină la același moment (p < 0,05).
Nivelurile de meNAM pentru eșantioanele de control tratate cu soluție salină nu s-au modificat semnificativ pe parcursul perioadei de timp de 8 h (p > 0,05, Figura 1D).
Nivelurile plasmatice de NMN, un metabolit al NAM prin intermediul căii de salvare anabolică, au fost semnificativ ridicate (472%) numai la punctul de timp de 8 h (de ex, 2 h după terminarea perfuziei, p < 0,05).
Nivelurile de NMN pentru eșantioanele de control tratate cu soluție salină nu s-au modificat semnificativ pe parcursul perioadei de timp de 8 h (p > 0,05, Figura 1E).
Urină
Fuziunea intravenoasă continuă de NAD+ la o rată de 3 μmoli/min a dus la o creștere semnificativă (538%) a ratei de excreție a NAD+ în urină la punctul de timp de 6 h (de ex, sfârșitul perfuziei) în raport cu cea excretată la 30 min (p < 0,001). Acest lucru a fost, de asemenea, semnificativ diferit față de cantitatea de NAD+ excretată în urină la 6 h de către martorii tratați cu soluție salină (p < 0,05).
Cantitatea de NAD+ excretată în urină a scăzut cu 43% (p < 0,05) la 8 h (i.e, 2 h după perfuzie) în raport cu excreția maximă la momentul 6 h.
Rata de excreție în urină pentru NAD+ nu s-a modificat semnificativ pe parcursul perioadei de evaluare de 8 h în probele de control tratate cu soluție salină (Figura 2A).

Figura 2. Modificări ale NAD+ și metaboliților din urină pe parcursul a 8 h (primele 6 h constând într-o perfuzie IV continuă de NAD+, 3 μmoli/min, de NAD+). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, după cum este indicat. ANOVA în două direcții cu testul post-hoc de comparație multiplă Bonferroni a fost utilizat pentru a determina dacă concentrația medie pentru analiștii testați a fost diferită pe parcursul perioadei de 8 h și între grupurile Test (n = 8) și Control (n = 3).
Rata de excreție a metabolitului NAD+ NAM nu s-a modificat semnificativ de-a lungul perioadei de testare de 8 h și nu a fost diferită de rata de excreție a NAM observată pentru martorii tratați cu soluție salină (Figura 2B).
Rata de excreție în urină a metabolitului NAM meNAM a fost semnificativ crescută (403%) la momentul de 6 h (adică, sfârșitul perfuziei) în raport cu cea observată la 30 min (p < 0,01). Cantitatea de meNAM excretată în urină a scăzut cu 43% (p < 0,05) la 8 h (adică, 2 h după perfuzie) în raport cu excreția maximă la momentul 6 h.
Rata de excreție în urină pentru meNAM nu s-a modificat semnificativ pe parcursul perioadei de evaluare de 8 h la martorii tratați cu soluție salină (Figura 2C).
Discuție
Un interes crescând pentru terapiile bazate pe NAD+, inclusiv perfuziile de NAD+, a evidențiat necesitatea unei înțelegeri mai clare a sorții NAD+ și a metaboliților săi după administrarea intravenoasă. Studiul actual documentează modificările nivelurilor de NAD+ și ale principalilor metaboliți atât în plasmă, cât și în urină, pe parcursul a 8 ore, folosind un regim de dozare clinic tipic de 750 mg NAD+ administrat IV pe o perioadă de 6 ore.
Important este faptul că perfuzia de NAD+ nu a produs niciun eveniment advers observabil în cohorta de testare, ci mai degrabă a redus activitățile plasmatice ale enzimelor care indică stresul hepatic, cum ar fi LD și AST intrahepatice și enzima GGT post-hepatică (canalul biliar), sugerând că integritatea țesutului intrahepatic și post-hepatic a fost îmbunătățită chiar și în intervalul de timp relativ scurt de 8 h. Creșterea bilirubinei, un produs de degradare a eritrocitelor, la 8 h poate reflecta fie o creștere foarte mică a turnover-ului eritrocitar, așa cum poate apărea din cauza hemolizei induse de perfuzie, fie un metabolism redus al hematiilor (tabelul 1). Cu toate acestea, având în vedere magnitudinea foarte mică a acestei modificări, acest lucru nu a fost considerat relevant din punct de vedere clinic.
Cum era de așteptat, la participanții tratați cu soluție salină (adică control), nivelurile plasmatice ale NAD+ și ale metaboliților NAM și ADPR și ale metaboliților NAM, NMN și meNAM au rămas în esență neschimbate pe parcursul perioadei de 8 h. Cu toate acestea, o scădere aparentă a NAM, meNAM și ADPR a fost observată între 30 min și 6 h, cel mai probabil din cauza unui efect de diluție salină. În concordanță cu această noțiune, s-a observat că valorile pentru acești analiți au revenit la nivelurile inițiale la 8 h (de ex, 2 h după terminarea perfuziei cu soluție salină).
În mod neașteptat, totuși, la participanții perfuzați cu NAD+, nivelurile plasmatice de NAD+ nu au reușit să crească până după punctul de timp de 2 h, atingând un maxim de ~400% peste linia de bază pentru NAD+ și metaboliții NAM, meNAM și ADPR (398%, 409%, respectiv 393%) doar la punctul de timp de 6 h (figurile 1A-E). Acest lucru a fost în concordanță internă cu vârful excreției urinare atât pentru NAD+, cât și pentru meNAM, care a avut loc, de asemenea, la 6 h înainte de a scădea rapid după terminarea perfuziei (figurile 2A-C).
NAD+ a fost perfuzat la o rată constantă de 3 μmoli/min. Prin urmare, 90 μmoli de NAD+ au fost infuzați direct în compartimentul vascular la fiecare 30 min, livrând un total de 1 080 μmoli până la sfârșitul perfuziei la 6 h. Amestecul intravascular din orice punct al perfuziei are loc în ~2 min; presupunând un volum sanguin mediu de 5, NAD+ adăugat, în absența unui metabolism sau a unei absorbții semnificative, ar corespunde unei creșteri suplimentare a (NAD+) de cel puțin 18 μM, la fiecare 30 min pe parcursul celor 6 h de perfuzie. În timp ce o creștere de această magnitudine se încadrează în limitele de detecție analitică ale acestui studiu, nu s-a observat nicio creștere a NAD+ sau a metaboliților săi până după 2 ore (adică la punctul de timp de 6 ore) în plasmă sau în urină. Această observație neașteptată indică o absorbție și/sau un metabolism tisular rapid și, cel puțin pentru primele 2 ore, complet al NAD+ și/sau al metaboliților săi.
O serie de enzime pot realiza un catabolism eficient al NAD+, inclusiv sirtuinele (SIRTs 1-7), adenozin difosfat (ADP)-riboza transferazele (ARTs) și poli(ADP-riboza) polimerazele (PARPs 1-17) și ADP-riboza ciclică (cADPR) sintetazele (CD38, CD157). NAD+ pirofosfatazele extracelulare NAD+ prezente în serul uman pot, de asemenea, să degradeze NAD+ în AMP și NMN (Schmidt-Brauns et al., 2001). Proteina CD73 de pe suprafața celulară transformă, de asemenea, NMN în NR, care traversează cu ușurință membranele celulare pentru o potențială resinteză la NAD+. Este important faptul că glicohidrolazele catabolizatoare de NAD+, CD38 și CD157, ecto-nucleotide pirofosfataza (CD203a) și catabolizatorul de NMN CD73 sunt ectoenzime care se găsesc pe o mare varietate de celule, inclusiv celule limfoide, granulocitare, neuronale și endoteliale (Wei et al., 2014), iar glicohidrolazele NAD solubile în plasmă pot fi, de asemenea, prezente (figura 3; Funaro et al., 2009). Creșterea paralelă a NAM și ADPR din plasmă (coeficientul de corelație de 1,000, p < 0,001, date neevidențiate) sugerează cu tărie că, cel puțin până la 6 h, o soartă majoră a NAD+ este metabolismul prin scindarea legăturii glicozidice ADPriboză-nicotinamidă la NAM și ADPR, subproduse simptomatice ale activității NAD glicohidrolazei (de exemplu, CD38). Acest lucru este în concordanță cu dovezile altora în care s-a demonstrat că CD38, în special, are un rol principal în controlul nivelurilor extracelulare de NAD+ (Wei et al., 2014). Eritrocitele umane adulte sunt CD38 pozitive și exprimă niveluri ridicate de activitate NAD+ glicohidrolază, scindând NAD+ exogen pentru a furniza eritrocitelor ADP riboză care poate fi absorbită în mod eficient în celulă (Kim et al., 1993; Albeniz et al., 2004). Absența oricărei creșteri fie a NAD+, fie a metaboliților, în plasmă sau urină, până după primele 2 h de perfuzie, indică faptul că NAD+ și/sau metaboliții săi sunt traficați în afara spațiului vascular extracelular și sechestrați în mod eficient în compartimentele tisulare sau extravasculare ca NAD+ și/sau metaboliții săi în această perioadă de timp.

Figura 3. Catabolismul extracelular potențial al NAD+ furnizat în mod exogen prin activitatea ectoenzimelor CD38 (ADP-riboză (ADPR) sintetază), CD203a (NAD+ pirofosfatază), CD 73 (5′-nucleotidază), CD157-ADP-ribosilciclază 2. Abrevieri: NAM, nicotinamidă; NMN, nicotinamidă mononucleotidă; ADPR, adenozin difosfat ribozidic; meNAM, metil nicotinamidă; 4PY, N-metil-4-piridonă-3-carboxamidă; 2PY, metil-2-piridonă-5-carboxamidă; ARPP, ADP riboză pirofosfatază; RPPK, ribozil pirofosfokinază; NAmpt, nicotinamidă fosforibosiltransferază; NMNAT, nicotinamidă mononucleotidăadeniltransferază; CX-43, conexina 43.
Deși PARP și sirtuinele sunt implicate în catabolismul NAD+, ca enzime intracelulare cu reprezentanți în citoplasmă, nucleu și mitocondrie, este puțin probabil ca acestea să aibă un impact direct asupra nivelurilor extracelulare de NAD+. Cu toate acestea, este de așteptat ca aceste enzime să răspundă la modificările concentrațiilor intracelulare de NAD+, NAM și NR care pot apărea în urma unui aport exogen de NAD+. Figura 4 rezumă schematic destinele posibile ale NAD+ exogen.
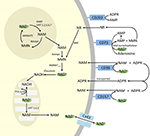
Figura 4. Destinația intra și extracelulară potențială a NAD+ furnizat exogen. Abrevieri: CD38 , CD203a (NAD+ pirofosfatază), CD 73 (5′-nucleotidază). NAM, nicotinamidă; NMN, nicotinamidă mononucleotidă; ADPR, adenozin difosfat ribozidic; meNAM, metil nicotinamidă; 4PY, N-metil-4-piridonă-3-carboxamidă; 2PY, metil-2-piridonă-5-carboxamidă; ARPP, ADP riboză pirofosfatază; RPPK, ribozil pirofosfokinază; NAmpt, nicotinamidă fosforibosiltransferază; NMNAT, nicotinamidă mononucleotidăadeniltransferază; PARP ; NRK .
În timp ce există o capacitate semnificativă de degradare rapidă a NAD+ IV furnizat în mod exogen în metaboliți constituenți, este, de asemenea, demn de remarcat faptul că poate avea loc și absorbția de NAD+ extracelular. Deoarece NAD+ are o sarcină globală negativă, acesta nu poate traversa membranele celulare în mod pasiv și, prin urmare, trebuie să fie transportat în mod activ prin membrană. Faptul că acest lucru se întâmplă a fost demonstrat de mai mulți cercetători care au raportat că NAD+ exogen aplicat la o varietate de tipuri de celule umane duce într-adevăr la o creștere semnificativă a NAD+ intracelular (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Deși mecanismul (mecanismele) implicat(e) nu este (sunt) încă pe deplin caracterizat(e), Alano et al. (2010) au raportat că NAD+ exogen ar putea intra în neuroni prin intermediul canalelor P2X7 gated, iar alții au observat în mod constant transportul NAD+ prin membrană prin intermediul hemicanalelor conexinei 43 (CX43), chiar și la concentrații de până la 250 pM (Billington et al., 2008). Având în vedere că conexinele au o distribuție largă în țesuturile umane, iar CX43 pare a fi cea mai omniprezentă conexină în multe tipuri de celule, potențialul de absorbție rapidă a NAD+ nu poate fi neglijat.
Astfel, absorbția și/sau metabolismul celular al NAD+ și al metaboliților NAM și ADPR și al metaboliților secundari meNAM și NMN pare să se desfășoare în același ritm cu perfuzia de 3 μmoli/min de NAD+ timp de cel puțin primele 2 ore. Fie NAD+ și/sau metaboliții primari testați sunt sechestrați eficient în această primă perioadă de 2-6 ore, fie se formează, de asemenea, metaboliți secundari. ADPR poate fi reciclat pentru a produce NAD+ din NAM (figura 4) sau poate fi metabolizat în continuare prin intermediul ectoenzimelor, cum ar fi CD203a (NAD+ pirofosfatază), pentru a produce AMP, care poate fi metabolizat rapid în continuare în adenozină de către CD73 a 5′-nucleotidaza (Bogan și Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). În sprijinul acestei ipoteze, o creștere a nivelurilor de adenozină din sânge a fost recunoscută de alții ca o consecință a infuziei extracelulare de NAD+ (Szczepañska-Konkel et al., 2003). NAM poate fi, de asemenea, metabolizat la NMN prin intermediul căii de salvare înainte de resinteza la NAD+ (figurile 3, 4) sau poate fi acționat de metiltransferazele hepatice pentru a produce N1-metilnicotinamidă care poate fi fie excretată direct, fie transformată ulterior în N-metil-2-piridonă-5-carboxamidă (2PY, +99% din meNAM) și N-metil-4-piridonă-3-carboxamidă (4PY, ~0.25% din meNAM) înainte de excreție (Shibata și Matsuo, 1989; Okamoto et al, 2003).
Este evident că, la regimul de dozare utilizat, mecanismele implicate în metabolismul și sechestrarea NAD+ și a metaboliților au ajuns la saturație cândva după 2 h, rezultând o creștere semnificativă a NAD+ în plasmă și o acumulare a tuturor metaboliților testați (NMA, ADPR, meNAM și NMN) la 6 h. După cum s-a menționat anterior, aceste date susțin ideea că o cale majoră pentru metabolismul NAD+ în aceste condiții este scindarea legăturii glicozidice de către ectoenzime, cum ar fi CD38, pentru a produce NAM și ADPR. Cu toate acestea, creșterea NMN plasmatic după 2 h sugerează, de asemenea, că NAD+ exogen este probabil acționat de NAD+ pirofosfatazele NAD+ extracelulare, crescând NMN plasmatic și eliberând AMP ca un metabolit suplimentar.
În concluzie, acest studiu a arătat pentru prima dată că: (a) la un debit de 3 μmole/min, tot NAD+ perfuzat exogen a fost rapid și complet eliminat din plasmă pentru cel puțin primele 2 h; (b) creșterea bi-produselor metabolice analizate este în concordanță cu activitatea NAD+ glichidrolazelor și NAD+ pirofosfatazelor; și (c) produsele de excreție urinară rezultate în urma perfuziei de NAD+ includ NAD+ nativ și meNAM, dar nu NAM.
În timp ce rezultatele acestei investigații sunt noi și contribuie într-o oarecare măsură la avansarea înțelegerii noastre cu privire la soarta cronologică a NAD+ exogen la om, au fost identificate limitări. Pentru a îmbunătăți calculul metabolic global, studiile viitoare ar trebui să investigheze modificările în NAD+ și metaboliții din celulele roșii și excreția urinară a metaboliților secundari meNAM, 2PY și 4PY. În plus, va fi probabil utilă evaluarea impactului NAD+ exogen asupra modificărilor metabolismului purinic, care ar trebui să includă cel puțin evaluarea AMP și adenozinei plasmatice și eritrocitare. Utilizarea modelelor animale poate contribui, de asemenea, la clarificarea implicării relative a diferitelor căi metabolice prin utilizarea de inhibitori farmacologici adecvați și prin prelevarea de probe de țesut.
În concluzie, acest studiu a putut dezvălui pentru prima dată câteva informații foarte utile, necunoscute anterior, despre soarta NAD+ exogen IV la om, inclusiv, siguranța și tolerabilitatea generală a unei perfuzii IV de NAD+ la un debit de 3 μmoli/min, sechestrarea rapidă a NAD+ din plasmă, contribuția probabilă atât a activității NAD+ glicohidrolazei, cât și a NAD+ pirofosfatului în metabolismul NAD+ și reabsorbția tubulară renală aparent eficientă a NAM. Cu toate acestea, sunt necesare cercetări suplimentare pentru a dezvălui pe deplin destinul metabolic complex al acestei molecule importante. În plus, caracterizarea acestor modificări va contribui la progresul dezvoltării și îmbunătățirii regimurilor de tratament bazate pe NAD+ pentru afecțiunile care ar putea beneficia de o disponibilitate crescută a NAD+, inclusiv afecțiunile care necesită o regenerare și reparare celulară sporită, cum ar fi Alzheimer și alte demențe neurodegenerative.
Disponibilitatea datelor
Seturile de date generate pentru acest studiu sunt disponibile la cerere la autorul corespondent.
Declarație etică
Studiile care implică participanți umani au fost revizuite și aprobate de William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Pacienții/participanții și-au dat consimțământul informat în scris pentru a participa la acest studiu.
Contribuții ale autorilor
RG a participat la proiectarea și supravegherea studiului, la discuții critice și la redactarea manuscrisului. JBer a participat la proiectarea studiului, discuția critică, colectarea datelor, analiza statistică, redactarea manuscrisului și revizuirea manuscrisului. RM a participat la proiectarea studiului, la discuții critice, la supravegherea clinică și la revizuirea manuscrisului. NB a participat la analiza biochimică și la revizuirea manuscrisului. JW a participat la proiectarea studiului, la discuții critice și la revizuirea manuscrisului. JBen a participat la colectarea datelor și la revizuirea manuscrisului. SB a participat la proiectarea studiului și la revizuirea manuscrisului. Toți autorii au revizuit, citit și aprobat versiunea finală a manuscrisului și sunt de acord cu ordinea de prezentare a autorilor.
Finanțare
Acest studiu a fost finanțat în comun de NAD+ Research Inc, (LA, SUA) și Australasian Research Institute Incorporation (Sydney, Australia) și a fost efectuat la Springfield Wellness Center, Springfield, LA, SUA.
Declarație privind conflictul de interese
RM este director al NAD+ Research Inc. și director medical al Springfield Wellness Center, care utilizează NAD IV ca terapie clinică. SB a primit onorarii de consultanță de la NAD+ Research Inc.
Ceilalți autori declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Dorim să mulțumim Archway Apothecary Pty Limited, LA, SUA, pentru furnizarea gratuită de NAD+ IV pentru acest proiect.
Abeti, R., și Duchen, M. R. R. (2012). Activarea PARP prin stresul oxidativ indus de β-amiloid: implicații pentru boala Alzheimer. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | Refef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Un studiu deschis, non-randomizat, privind farmacocinetica suplimentului nutrițional nicotinamidă ribozidă (NR) și efectele sale asupra nivelurilor de NAD+ din sânge la voluntari sănătoși. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., și Swanson, R. A. (2010). Epuizarea NAD+ este necesară și suficientă pentru moartea neuronală mediată de PARP-1. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., și Bermek, E. (2004). Activitățile NAD glicohidrolazei și absorbția de adp-riboză în eritrocite de la subiecți normali și pacienți cu cancer. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Caracterizarea absorbției de NAD+ în celulele mamiferelor. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | Text integral | Google Scholar
Bogan, K., și Brenner, C. (2010). 5′-nucleotidazele și noile lor roluri în metabolismul NAD+ și al fosfaților. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., și Grant, R. (2011). Modificări legate de vârstă în metabolismul NAD+, stresul oxidativ și activitatea sirt1 la șobolanii wistar. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Cartografierea metabolismului NAD+ în creierul șobolanilor Wistar îmbătrâniți: ținte potențiale pentru influențarea senescenței creierului. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | Full CrossRef Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Cuantificarea metabolomului celular NAD+ folosind o abordare de spectrometrie de masă prin cromatografie lichidă în tandem. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | Full CrossRef Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P. și Braidy, N. (2018). Metabolomul NAD+ din plasmă este dereglementat în îmbătrânirea „normală”. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | Refef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rolul deficienței endoteliale NAD+ în disfuncția vasculară legată de vârstă. Am. J. Physiol. inima Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., și Milbrandt, J. (2017). Domeniul receptorului de taxare/interleukin-1 SARM1 posedă o activitate intrinsecă de clivaj NAD+ care promovează degenerarea axonală patologică. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., și Chiarugi, A. (2013). Insight în proprietățile moleculare și funcționale ale NMNAT3 dezvăluie noi indicii ale homeostaziei NAD în mitocondriile umane. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzimele și imunitatea înnăscută: rolul CD157 uman în traficul de leucocite. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | Reflect Full Text | Google Scholar
Goldberger, J. (1914). Etiologia pelagrei: semnificația anumitor observații epidemiologice cu privire la aceasta. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Modificări ale daunelor oxidative, ale inflamației și cu vârsta în lichidul cefalorahidian. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenozina generată în nișa măduvei osoase prin intermediul unei căi mediate de CD38 se corelează cu progresia mielomului uman. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | Full CrossRef Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R. și An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | Ref Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., și Schuh, R. A. (2015). Efectul nicotinamidei mononucleotide asupra deficitelor respiratorii mitocondriale ale creierului într-un model murin relevant pentru boala Alzheimer’. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | Full CrossRef Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Modificări asociate vârstei în stresul oxidativ și metabolismul NAD+ în țesutul uman. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Dependența de noaptea întunecată a sufletului, NAD+ lumina speranței. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Administrarea pe termen lung a mononucleotidei de nicotinamidă atenuează declinul fiziologic asociat cu vârsta la șoareci. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | Full CrossRef Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R. și Malavasi, F. (2018). Rolul generării de adenozină extracelulară în dezvoltarea bolilor autoimune. Mediatori Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | Full CrossRef Text | Google Scholar
O’Holleran, P. (1961). DPN în prevenirea, diagnosticarea și tratamentul dependențelor de droguri. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Variații diurne în excreția urinară umană a cataboliților de nicotinamidă: efecte ale stresului asupra metabolismului nicotinamidei. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., și Gupta, M. P. (2005). Moartea celulară a miocitelor cardiace dependentă de poli(ADP-riboză) polimeraza-1 în timpul insuficienței cardiace este mediată de epuizarea NAD+ și de activitatea redusă a deacetilazei Sir2α. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | Refef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Efectele farmacologice ale NAD exogen asupra bioenergeticii mitocondriale, reparării ADN-ului și apoptozei. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | Refef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., și Reidl, J. (2001). Este o activitate NAD pirofosfatază necesară pentru multiplicarea Haemophilus influenzae tip b în fluxul sanguin? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | Refef Full Text | Google Scholar
Shibata, K., și Matsuo, H. (1989). Corelația dintre aportul echivalent de niacină și excreția urinară a metaboliților săi, N’-metilnicotinamida, N’-metil-2-piridona-5-carboxamida și N’-metil-4-piridona-3-carboxamida, la oamenii care consumă un aliment auto-selectat. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | Full CrossRef Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Semnalizarea stresului oxidativ în boala Alzheimer. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., și Angielski, S. (2003). Hemodinamica renală și răspunsurile natriuretice la administrarea intravenoasă de tetrafosfat de diadenozină (ap4a) și nicotinamidă adenină dinucleotidă (NAD) la șobolan. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., și Yue, J. (2014). Roluri și mecanisme ale căii de semnalizare CD38/cyclic adenozină difosfat de riboză / Ca2+. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | Refef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., și Yan, L. J. (2016). Surse și implicații ale dezechilibrului redox NADH/NAD+ în diabet și complicațiile sale. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | Text integral | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., și Tsuchiya, M. (2006). Măsurarea simultană a nicotinamidă adenină dinucleotidă și a compușilor înrudiți prin cromatografie lichidă/spectrometrie de masă în tandem cu ionizare prin electrospray. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | Text integral | Google Scholar
Ying, W. (2013). Roluri ale NAD+, PARP-1 și sirtuinelor în moartea celulară, leziuni cerebrale ischemice și leziuni tisulare induse de radiații sincrotronice cu raze X. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | Full CrossRef Text | Google Scholar
Ying, W., Garnier, P., și Swanson, R. A. (2003). Reîncărcarea NAD+ previne blocarea glicolitică indusă de PARP-1 și moartea celulară în astrocitele de șoarece cultivate. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., și Xiong, Z.-G. (2010). Stresul oxidativ și NAD+ în leziunile cerebrale ischemice: progrese actuale și perspective viitoare. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | Textul integral | Google Scholar
Yoshino, J., Baur, J. A., și Imai, S. I. (2018). Intermediari NAD+: biologia și potențialul terapeutic al NMN și NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | Full CrossRef Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., și Imai, S. (2011). Nicotinamida mononucleotidă, un intermediar cheie NAD +, tratează fiziopatologia diabetului indus de dietă și vârstă la șoareci. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Moartea neuronală indusă de proteina prion prost pliată se datorează epuizării NAD+ și poate fi ameliorată in vitro și in vivo prin reaprovizionarea cu NAD+. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | Full Text | Google Scholar
Zhu, K., Swanson, R. A., și Ying, W. (2005). NADH poate intra în astrocite pentru a bloca moartea astrocitelor mediată de PARP-1. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., și Perry, G. (2007). Cauzele stresului oxidativ în boala Alzheimer. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar
.