- Introducción
- Materiales y métodos
- Participantes
- Estandarización de la dieta
- Protocolo de infusión
- Recogida de muestras de sangre
- Recogida de muestras de orina
- Método analítico
- Seguridad
- Análisis estadístico
- Etica
- Resultados
- Seguridad
- Plasma
- Urina
- Discusión
- Disponibilidad de datos
- Declaración ética
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
Introducción
El nucleótido de piridina madre, nicotinamida adenina dinucleótido (NAD+) está presente en todas las células del cuerpo y es esencial para la viabilidad y la función celular.
Como cofactor responsable del transporte de electrones en la cadena respiratoria, el NAD+ y su par redox NADH son fundamentales para la producción de energía (ATP) en la mitocondria a través de la fosforilación oxidativa. El metabolito fosforilado del NAD+, el NADP+, con su par redox NADPH, también proporciona el poder reductor para impulsar una serie de reacciones anabólicas, como la síntesis del colesterol y de los ácidos nucleicos, la elongación de los ácidos grasos y la regeneración del glutatión (GSH), uno de los principales antioxidantes del organismo. En conjunto, esta familia de nucleótidos de piridina, contribuye al intercambio redox de más de 400 reacciones enzimáticas. Es importante destacar que, al actuar como par redox, el NAD+ no se consume. Sin embargo, el NAD+ también sirve como sustrato para otros procesos metabólicos importantes y, por lo tanto, se consume como consecuencia de sus reacciones químicas, agotando potencialmente el tejido de NAD+. Se incluyen en este número las reacciones impulsadas por la familia de enzimas de poli adenosina fosforibosa-ribosa (ADPR) (PARP 1-17) que controlan la reparación del ADN y la estabilidad nuclear, las enzimas de control epigenético (Sirt1-7), la comunicación inmunitaria intercelular (CD38/CD157) y la regeneración neuronal (SARM1; Essuman et al., 2017). Por lo tanto, existe la posibilidad de que se produzca una alteración del metabolismo celular a múltiples niveles en condiciones en las que el consumo de NAD+ por parte de estas enzimas supere el suministro o la síntesis de NAD+.
La importancia clínica de mantener los niveles de NAD+ celular se estableció a principios del siglo pasado con el hallazgo de que la pelagra, una enfermedad caracterizada por la diarrea, la dermatitis, la demencia y la muerte, podía curarse con alimentos que contenían el precursor de NAD+, la niacina (también conocida como vitamina B3; Goldberger, 1914). Aunque la pelagra es poco frecuente en los países desarrollados, se ha demostrado que las concentraciones celulares de NAD+ disminuyen en condiciones de mayor daño oxidativo como las que se producen durante el envejecimiento (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Se ha descubierto que los niveles alterados de NAD+ acompañan a varios trastornos asociados a un mayor daño oxidativo/radical libre, como la diabetes (Wu et al., 2016), las enfermedades cardíacas (Pillai et al., 2005), la disfunción vascular relacionada con la edad (Csiszar et al., 2019), la lesión cerebral isquémica (Ying y Xiong, 2010), las proteínas neuronales mal plegadas (Zhou et al., 2015) y la demencia de Alzheimer (Abeti y Duchen, 2012).
Además de los sellos patológicos de las placas Aβ y los ovillos neurofibrilares de tau, el daño oxidativo es un hallazgo consistente en la enfermedad de Alzheimer y es ampliamente reconocido como un evento temprano en el proceso patogénico, incluso anterior a la deposición de Aβ (Su et al., 2008). Aunque las especies reactivas de oxígeno (ROS) que causan este daño probablemente se originan en múltiples fuentes, se cree que las mitocondrias disfuncionales y la disponibilidad de metales redox activos como el Fe++ y el Cu+ desempeñan papeles dominantes (Zhua et al., 2007).
Una consecuencia importante del estrés oxidativo celular, en el cerebro y en otros lugares, son las roturas de una o dos cadenas en el ADN. En respuesta al daño del ADN, PARP1 hidroliza NAD+ para producir polímeros de ADP-ribosa (Ying, 2013). Anteriormente demostramos que los niveles de NAD+ estaban inversamente correlacionados con las medidas de estrés oxidativo en el tejido humano (Massudi et al., 2012) y en el cerebro de rata (Braidy et al., 2014). Por lo tanto, mientras que los niveles reducidos de NAD+ en el cerebro de los enfermos de Alzheimer vivos esperan ser confirmados por técnicas no invasivas, los hallazgos consistentes de daño oxidativo en el cerebro post mortem apoyan firmemente la opinión de que el recambio acelerado de NAD+ y su agotamiento contribuyen a la disfunción neurológica en esta enfermedad. Dado que las intervenciones dirigidas a restaurar el NAD+ han demostrado en modelos animales que favorecen el envejecimiento saludable y mejoran la función metabólica (Yoshino et al., 2011; Mills et al., 2016) y la demencia (Long et al., 2015), se están explorando activamente estrategias para aumentar los niveles de NAD+ en el ser humano.
El método más directo para aumentar los niveles de NAD+ es la administración intravenosa (IV). Aunque los datos de la investigación experimental son mínimos, se ha informado previamente del beneficio clínico significativo de la infusión de NAD+ por vía intravenosa en la abstinencia de alcohol (O’Holleran, 1961; Mestayer, 2019). Sorprendentemente, mientras que la administración oral de precursores de NAD+ como el ribósido de nicotinamida (NR) o el mononucleótido de nicotinamida (NMN) están siendo investigados con entusiasmo por su impacto en los niveles de NAD+ (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), el destino metabólico y las propiedades farmacocinéticas de la administración de NAD+ por vía intravenosa aún no se han comunicado en humanos. Este estudio, por lo tanto, presenta por primera vez los cambios en las concentraciones de NAD+ y sus metabolitos durante una infusión IV de NAD+ en una cohorte de participantes masculinos sanos.
Materiales y métodos
Participantes
Se reclutaron siete (Test n = 8, Control n = 3) participantes masculinos de entre 30 y 55 años de edad a través de anuncios en radio, televisión y medios sociales. Todos los participantes tenían un IMC inferior a 30 kg/m2 (IMC medio de prueba = 27,5 ± 2,5 kg/m2; IMC medio de control = 24,6 ± 6,5 kg/m2), no eran diabéticos, fumaban menos de un cigarrillo y consumían menos de dos bebidas alcohólicas estándar al día. Se excluyeron del estudio los individuos que tomaban fármacos hipolipemiantes o antiinflamatorios, que tenían antecedentes de insuficiencia hepática o renal o que habían sufrido recientemente una infección microbiana, un traumatismo o cualquier otro trastorno médico importante o no tratado. Los sujetos recibieron una compensación monetaria por su tiempo y participación, independientemente de que completaran el experimento. A los participantes no se les permitió utilizar productos naturales para la salud que contuvieran NAD+, NR o Nicotinamida en los 14 días anteriores y durante el transcurso del estudio.
Estandarización de la dieta
El día anterior a la infusión de NAD+ por vía intravenosa los participantes consumieron una dieta idéntica reducida en niacina y sólo bebieron agua.
El día del estudio no se consumió ningún alimento hasta después de la recogida de la última muestra de sangre/orina de 8 horas. Se animó a los participantes a beber agua para mantenerse normalmente hidratados. No se permitía ningún otro tipo de bebida.
Para garantizar que los participantes mantuvieran una ingesta energética adecuada durante las 6 horas de infusión, la solución intravenosa también contenía un 0,1% de dextrosa, lo que proporcionaba aproximadamente 2.000 calorías durante el periodo de infusión de 6 horas.
Protocolo de infusión
Los participantes fueron asignados aleatoriamente al grupo de Prueba (n = 8) o al de Control (n = 3). A los participantes del grupo de prueba se les administró por vía intravenosa 750 mg de NAD+ en solución salina normal (Archway Apothecary, Covington, LA, EE.UU.) durante un período de 6 horas (velocidad de infusión = ~2 mg/min ≡ 3 μmoles/min). Esta dosis de NAD+ se derivó empíricamente y refleja un régimen de dosificación común en las clínicas (por ejemplo, Springfield Wellness Clinic, Springfield, LA, USA) que proporcionan regularmente infusiones de NAD+ por vía intravenosa en la práctica clínica. A los participantes del grupo de control se les administró por vía intravenosa una solución salina normal durante un período de 6 horas.
La administración clínica y la supervisión de las infusiones IV y la recogida de muestras se llevaron a cabo en el Springfield Wellness Center, Springfield, LA, EE.UU.
Recogida de muestras de sangre
Se recogieron muestras de sangre de referencia (TO) en todos los participantes después de un ayuno nocturno de 12 horas programado para que se produjera inmediatamente antes del inicio de la infusión. A continuación, se recogieron muestras adicionales a los 30, 60, 120 (2 h), 360 (6 h) y 480 (8 h) minutos después del inicio de la infusión.
La sangre total se recogió mediante una venopunción estándar (en el brazo opuesto al lugar de la infusión) en un tubo heparinizado de 5 mL sin gel. Inmediatamente después de la recogida, la sangre se centrifugó a 4 °C durante 10 minutos a 1.409× g.
Las fracciones de plasma y glóbulos rojos se separaron inmediatamente y se distribuyeron en alícuotas de 5 × 500 μL cada una. A continuación, todas las alícuotas se congelaron inmediatamente y se almacenaron a -80 °C hasta su análisis.
Recogida de muestras de orina
Después de la recogida de una muestra de orina de referencia en la mitad del chorro, se pidió a los participantes que evacuaran toda la orina en el (los) receptáculo(s) proporcionado(s) a los 30 min, a las 2 h, a las 6 h y a las 8 h después del inicio de la infusión de NAD+. Si los participantes necesitaban orinar de forma intermitente entre estos puntos de tiempo, se les pedía que lo hicieran en el siguiente receptáculo sucesivo. Todas las muestras se alicuotaron y se almacenaron a -80 °C inmediatamente después de su recepción.
Método analítico
Separación cromatográfica del NAD+ y de los metabolitos relacionados y detección por EM La cromatografía líquida acoplada a la espectrometría de masas en tándem (LC/MS/MS) se llevó a cabo utilizando un espectrómetro de masas Sciex QTRAP 5500 (Sciex, Redwood City, CA, EE. UU.), como se describió previamente (Clement et al., 2018). Brevemente, se extrajeron 100 μL de plasma u orina humana en 400 μL de metanol helado, se centrifugaron a 4°C durante 10 min y se filtraron a través de cartuchos de membrana de 3 kDa. Los extractos de las muestras se secaron al vacío, se reconstituyeron en 200 μL de tampón NH4OAc 100 mM y se transfirieron a viales de vidrio de 200 μL y se taparon antes del análisis LC/MS/MS. Los estándares y las muestras (20 μL) se inyectaron en una columna Phenomenex NH2 (150 mm- 2 mm- 3 mm) como se ha descrito previamente. Se utilizó un gradiente de disolvente binario consistente en NH4OAc 5 mM pH 9,5 ajustado con amoníaco (fase móvil A) y acetonitrilo (fase móvil B) con un flujo de 250 μL/min. La composición inicial del disolvente en el momento de la inyección fue del 25% de A, seguido de un gradiente de 2 minutos hasta el 45% de A y una rampa de gradiente rápida hasta el 80% de A (0,1 min) que se mantuvo durante 5,9 min, se volvió a aumentar A hasta el 95% (2 min), se mantuvo durante 13 min y se volvió a las condiciones iniciales (0,1 min) para el equilibrio, con un tiempo de ejecución total de 30 min. El flujo de la columna se dirigió al detector de EM. Las curvas de calibración de los metabolitos individuales se construyeron utilizando las relaciones de área de pico (área de pico del metabolito dividida por el área de pico del IS seleccionado) de cada calibrador frente a su concentración.
Los estándares internos consistieron en 2H2NAM (para NAM, metilNAM y ADPR) y 13C5;-Cyclic AMP (para NMN y NAD+). Obsérvese que, como no hay etiquetas isotópicas disponibles en el mercado para todos los metabolitos del NAD, también se puede utilizar una molécula estrechamente relacionada (análogo estructural) (Yamada et al., 2006) siempre que se considere que tiene una estabilidad y una eficiencia de ionización similares durante el análisis. Los estándares internos seleccionados en este estudio se han optimizado previamente para el metabolito relacionado (Bustamante et al., 2017).
Seguridad
La seguridad del NAD+ IV se evaluó mediante pruebas de función hepática y la observación clínica de cualquier evento adverso. Las pruebas de función hepática consistieron en suero, bilirrubina total (bili), fosfatasa alcalina (ALP), alanina aminotransferasa (ALT), gamma glutamil transferasa (GGT), lactato deshidrogenasa (LD) y aspartato aminotransferasa (AST).
Análisis estadístico
El análisis estadístico se completó utilizando SPSS versión 24 y GraphPad Prism versión 8 para windows. Se utilizó un ANOVA de dos vías de medias no ponderadas con la prueba post hoc de comparación múltiple de Bonferroni para determinar si la concentración media de los analistas analizados era diferente a lo largo del periodo de 8 h y entre los grupos de Prueba y Control. Se utilizó la prueba de rangos con signo de Wilcoxon para determinar si las diferencias en las concentraciones medias de las pruebas de función hepática eran significativas entre los puntos de referencia y los puntos temporales de 8 h. Las diferencias se consideraron estadísticamente significativas cuando p < 0,05.
Etica
Este estudio se llevó a cabo de acuerdo con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki) para experimentos con seres humanos. Se obtuvo la aprobación ética de la Junta de Revisión Institucional de la Universidad William Carey, Hattiesburg, MS (Protocolo #2017-12). Se obtuvo el consentimiento informado de todos los participantes.
Resultados
Seguridad
No se observaron acontecimientos adversos durante la infusión de 6 h con las cohortes de placebo (solución salina) o de prueba (NAD+).
Se observó una disminución significativa de la actividad (1,3, 57, 3,6 unidades/L) de las enzimas de la función hepática GGT, LD y AST, respectivamente, a las 8 h del inicio de la infusión de NAD+ (Tabla 1). No se observó ningún cambio significativo en la actividad de ningún marcador de la función hepática a las 8 h en las muestras tratadas con placebo (solución salina), aunque el bajo número de muestras puede reducir la sensibilidad de discriminación. También se observó un aumento significativo de 2,75 μmoles/L en la bilirrubina plasmática. Sin embargo, ninguno de los cambios se consideró clínicamente significativo.

Tabla 1. Se utilizó la prueba de rangos con signo de Wilcoxon para determinar si las diferencias en las concentraciones medias de las pruebas de la función hepática eran significativas entre los puntos de referencia y los puntos temporales de 8 h.
Plasma
Una infusión continua de NAD+ a una velocidad de 3 μmoles/min dio lugar a un aumento significativo (398%) de los niveles de NAD+ en plasma sólo en el punto temporal de 6 h (es decir, al final de la infusión) en relación con el punto de referencia (p < 0,0001). Esto fue significativamente diferente del control tratado con solución salina durante 6 horas (p < 0,001).
Los niveles de NAD+ siguieron siendo elevados a las 8 horas (es decir, 2 h después de la infusión) en relación con la línea de base y las muestras de control tratadas con solución salina.
Los niveles de NAD+ en plasma no cambiaron significativamente con respecto a la línea de base a lo largo del periodo de evaluación de 8 h en las muestras de control tratadas con solución salina (Figura 1A).
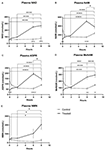
Figura 1. Cambios en el dinucleótido de nicotinamida adenina (NAD+) y en los metabolitos del plasma durante 8 h . (A) NAD+, (B) Nicotinamida (NAM), (C) adenosina fosforibosa (ADPR), (D) metil nicotinamida (meNAM), (E) nicotinamida mononucleótido (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, como se indica. Se utilizó un ANOVA de dos vías con la prueba post hoc de comparación múltiple de Bonferroni para determinar si la concentración media de los analizadores analizados era diferente a lo largo del periodo de 8 horas y entre los grupos de Prueba (n = 8) y Control (n = 3).
De forma similar a los cambios observados para el NAD+, los niveles plasmáticos del metabolito NAD+ nicotinamida (NAM) aumentaron significativamente en un 409% al final de la infusión de NAD+ (es decir, 6 h) en relación con la línea de base (p < 0,0001). Esto también fue significativamente diferente al control tratado con solución salina durante 6 horas (p < 0,001).
En el punto de tiempo de 8 horas (es decir, 2 horas después del final de la infusión), los niveles de NAM entre los grupos de control y tratados ya no eran significativamente diferentes (p > 0,05).
Los niveles de NAM para las muestras de control tratadas con solución salina no cambiaron significativamente a lo largo del período de tiempo de 8 horas (p > 0,05, Figura 1B).
Consistente con los cambios observados para NAM, los niveles plasmáticos del metabolito NAD+ ADPR aumentaron significativamente en un 393% al final de la infusión de NAD+ (es decir, 6 h) en relación con la línea de base (p < 0,0001). Esto fue significativamente diferente al control tratado con solución salina durante 6 h (p < 0,0001).
En el punto de tiempo de 8 h (es decir, 2 h después del final de la infusión), los niveles de ADPR se mantuvieron un 305% por encima de la línea de base (p < 0,0001). Sin embargo, esto no fue significativamente mayor que los niveles de ADPR en las muestras de control tratadas con solución salina en el mismo punto de tiempo (p > 0,05).
Los niveles de ADPR para las muestras de control tratadas con solución salina no cambiaron significativamente a través del período de tiempo de 8 h (p > 0,05, Figura 1C).
Un análisis de correlación de Spearman entre las medias de los grupos a lo largo de los puntos de tiempo de 8 h para los dos metabolitos catabólicos NAD+, NAM y ADPR, produjo un coeficiente de correlación de 1,00 (p < 0.001).
Además, en consonancia con los cambios observados para NAM, los niveles plasmáticos del metabolito NAM, metil-nicotinamida (meNAM) aumentaron significativamente hasta un 350% al final de la infusión de NAD+ (es decir, 6 h) en relación con la línea de base (p < 0,0001) y el control tratado con solución salina durante 6 h (p < 0,01).
En el punto de tiempo de 8 h (es decir, 2 h después del final de la infusión) los niveles de meNAM se mantuvieron un 393% por encima de la línea de base (p < 0,0001) y significativamente mayores que las muestras de control tratadas con solución salina en el mismo punto de tiempo (p < 0,05).
Los niveles de NMN para las muestras de control tratadas con solución salina no cambiaron significativamente a lo largo del período de 8 h (p > 0,05, Figura 1D).
Los niveles plasmáticos de NMN, un metabolito de NAM a través de la vía de salvamento anabólico, se elevaron significativamente (472%) sólo en el punto de tiempo de 8 h (es decir, 2 h después del final de la infusión, p < 0,05).
Los niveles de NMN para las muestras de control tratadas con solución salina no cambiaron significativamente a lo largo del período de 8 h (p > 0,05, Figura 1E).
Urina
La infusión IV continua de NAD+ a una velocidad de 3 μmoles/min dio lugar a un aumento significativo (538%) de la tasa de excreción de NAD+ en orina en el punto de tiempo de 6 h (es decir, final de la infusión) en relación con la excretada a los 30 minutos (p < 0,001). Esto también fue significativamente diferente a la cantidad de NAD+ excretada en orina a las 6 h por los controles tratados con solución salina (p < 0,05).
La cantidad de NAD+ excretada en orina disminuyó en un 43% (p < 0,05) a las 8 h (es decir, 2 h después de la infusión) en relación con el pico de excreción en el punto de tiempo de 6 h.
La tasa de excreción de NAD+ en orina no cambió significativamente a lo largo del periodo de evaluación de 8 h en las muestras de control tratadas con solución salina (Figura 2A).

Figura 2. Cambios en el NAD+ y los metabolitos de la orina a lo largo de 8 h (las primeras 6 h consisten en una infusión continua, de 3 μmoles/min, de NAD+ IV). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, como se indica. Se utilizó un ANOVA de dos vías con la prueba de comparación múltiple de Bonferroni para determinar si la concentración media de los analistas analizados era diferente a lo largo del periodo de 8 horas y entre los grupos de Prueba (n = 8) y Control (n = 3).
La tasa de excreción del metabolito NAD+ NAM no cambió significativamente a lo largo del periodo de prueba de 8 h y no fue diferente de la tasa de excreción de NAM observada para los controles tratados con solución salina (Figura 2B).
La tasa de excreción en orina del metabolito NAM meNAM aumentó significativamente (403%) en el punto temporal de 6 h (es decir, final de la infusión) en relación con la observada a los 30 minutos (p < 0,01). La cantidad de meNAM excretada en la orina disminuyó en un 43% (p < 0,05) a las 8 h (es decir, 2 h después de la infusión) en relación con el pico de excreción en el punto de tiempo de 6 h.
La tasa de excreción en orina de meNAM no cambió significativamente a lo largo del período de evaluación de 8 h en los controles tratados con solución salina (Figura 2C).
Discusión
El creciente interés en las terapias basadas en NAD+, incluidas las infusiones de NAD+, ha puesto de manifiesto la necesidad de comprender mejor el destino de NAD+ y sus metabolitos tras la administración IV. El presente estudio documenta los cambios en los niveles de NAD+ y metabolitos clave tanto en plasma como en orina a lo largo de 8 horas utilizando un régimen de dosificación clínico típico de 750 mg de NAD+ administrado por vía intravenosa durante un periodo de 6 horas.
Es importante destacar que la infusión de NAD+ no produjo ningún acontecimiento adverso observable en la cohorte de prueba, sino que redujo las actividades plasmáticas de las enzimas indicativas de estrés hepático, como la LD y la AST intrahepáticas y la enzima GGT poshepática (conducto biliar), lo que sugiere que la integridad del tejido intrahepático y poshepático mejoró incluso en el plazo relativamente corto de 8 horas. El aumento de la bilirrubina, un producto de degradación de los glóbulos rojos, a las 8 horas puede reflejar un aumento muy pequeño del recambio de glóbulos rojos, como puede ocurrir debido a la hemólisis inducida por la infusión, o una reducción del metabolismo del hemo (Tabla 1). Sin embargo, dada la muy baja magnitud de este cambio, esto no se consideró clínicamente relevante.
Como se esperaba, en los participantes tratados con solución salina (es decir, el control), los niveles plasmáticos de NAD+ y los metabolitos NAM y ADPR y los metabolitos NAM, NMN y meNAM permanecieron esencialmente sin cambios a lo largo del período de 8 horas. Sin embargo, se observó una aparente disminución de NAM, meNAM y ADPR entre los 30 min y las 6 h, muy probablemente debido a un efecto de dilución salina. En consonancia con esta noción, se observó que los valores de estos analitos volvieron a los niveles de referencia a las 8 h (es decir, 2 h después del final de la infusión de solución salina).
Sin embargo, de forma inesperada, en los participantes infundidos con NAD+, los niveles de NAD+ en plasma no aumentaron hasta después del punto de tiempo de 2 h, alcanzando un máximo de ~400% por encima de la línea de base para NAD+ y los metabolitos NAM, meNAM y ADPR (398%, 409%, 393%, respectivamente) sólo en el punto de tiempo de 6 h (Figuras 1A-E). Esto fue internamente consistente con el pico de excreción urinaria tanto para el NAD+ como para el meNAM que también se produjo a las 6 h antes de disminuir rápidamente tras el final de la infusión (Figuras 2A-C).
El NAD+ se infundió a una velocidad constante de 3 μmoles/min. Por lo tanto, se infundían 90 μmoles de NAD+ directamente en el compartimento vascular cada 30 min, lo que proporcionaba un total de 1.080 μmoles al final de la infusión a las 6 h. La mezcla intravascular desde cualquier punto de la infusión se produce en ~2 min; suponiendo un volumen sanguíneo medio de 5, el NAD+ añadido, en ausencia de un metabolismo o absorción significativos, correspondería a un aumento adicional de (NAD+) de al menos 18 μM, cada 30 min a lo largo de las 6 h de infusión. Aunque un aumento de esta magnitud está dentro de los límites de detección analítica de este estudio, no se observó ningún aumento del NAD+ ni de sus metabolitos hasta después de 2 horas (es decir, en el punto de tiempo de 6 horas), ni en plasma ni en orina. Esta inesperada observación indica una rápida, y al menos durante las primeras 2 h, completa captación tisular y/o metabolismo de NAD+ y/o sus metabolitos.
Una serie de enzimas pueden lograr un catabolismo efectivo del NAD+, incluyendo las sirtuinas (SIRTs 1-7) las adenosina difosfato (ADP)-ribosa transferasas (ARTs) y las poli(ADP-ribosa) polimerasas (PARPs 1-17) y las ADP-ribosa sintasas cíclicas (CD38, CD157). Las pirofosfatasas extracelulares de NAD+ presentes en el suero humano también pueden degradar el NAD+ a AMP y NMN (Schmidt-Brauns et al., 2001). La proteína de la superficie celular CD73 también convierte el NMN en NR, que atraviesa fácilmente las membranas celulares para su potencial resíntesis en NAD+. Es importante destacar que las glicohidrolasas catabolizadoras de NAD+, CD38 y CD157, la ecto-nucleótido pirofosfatasa (CD203a) y el catabolizador de NMN CD73 son ectoenzimas que se encuentran en una amplia variedad de células, incluyendo las linfoides, granulocíticas, neuronales y endoteliales (Wei et al., 2014) y también pueden estar presentes las glicohidrolasas de NAD solubles en plasma (Figura 3; Funaro et al., 2009). El aumento paralelo de NAM y ADPR en plasma (coeficiente de correlación de 1,000, p < 0,001, datos no mostrados) sugiere fuertemente que al menos a las 6 h un destino principal de NAD+ es el metabolismo a través de la escisión del enlace glicosídico ADPribosa-nicotinamida a NAM y ADPR, subproductos sintomáticos de la actividad de la NAD glicohidrolasa (por ejemplo, CD38). Esto es consistente con la evidencia de otros donde CD38, en particular, ha demostrado tener un papel primario en el control de los niveles extracelulares de NAD+ (Wei et al., 2014). Los eritrocitos humanos adultos son CD38 positivos y expresan altos niveles de actividad glicohidrolasa de NAD+, escindiendo el NAD+ exógeno para suministrar a los eritrocitos ADP ribosa que puede ser tomada eficientemente por la célula (Kim et al., 1993; Albeniz et al., 2004). La ausencia de aumento de NAD+ o metabolitos, en plasma u orina, hasta después de las primeras 2 h de la infusión indica que el NAD+ y/o sus metabolitos son traficados fuera del espacio vascular extracelular y secuestrados eficientemente en los tejidos o compartimentos extravasculares como NAD+ y/o sus metabolitos durante este periodo de tiempo.

Figura 3. Catabolismo potencial extracelular del NAD+ suministrado exógenamente a través de la actividad de las ectoenzimas CD38 (ADP-ribosa (ADPR) sintasa), CD203a (NAD+ pirofosfatasa), CD 73 (5′-nucleotidasa), CD157-ADP-ribosil ciclasa 2. Abreviaturas: NAM, nicotinamida; NMN, nicotinamida mononucleótido; ADPR, adenosina difosfato ribósido; meNAM, metil nicotinamida; 4PY, N-metil-4-piridona-3-carboxamida; 2PY, metil-2-piridona-5-carboxamida; ARPP, ADP ribosa pirofosfatasa; RPPK, ribosil pirofosfocinasa; NAmpt, nicotinamida fosforibosiltransferasa; NMNAT, nicotinamida mononucleótidoadeniltransferasa; CX-43, conexina 43.
Aunque la PARP y las sirtuinas están implicadas en el catabolismo del NAD+, como enzimas intracelulares con representantes en el citoplasma, el núcleo y las mitocondrias es poco probable que impacten directamente en los niveles extracelulares de NAD+. Sin embargo, es de esperar que estas enzimas respondan a los cambios en las concentraciones intracelulares de NAD+, NAM y NR que puedan surgir del suministro exógeno de NAD+. La Figura 4 resume de forma esquemática los posibles destinos del NAD+ exógeno.
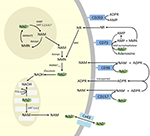
Figura 4. Destino potencial intra y extracelular del NAD+ suministrado exógenamente. Abreviaturas: CD38 , CD203a (NAD+ pirofosfatasa), CD 73 (5′-nucleotidasa). NAM, nicotinamida; NMN, nicotinamida mononucleótido; ADPR, adenosina difosfato ribósido; meNAM, metil nicotinamida; 4PY, N-metil-4-piridona-3-carboxamida; 2PY, metil-2-piridona-5-carboxamida; ARPP, ADP ribosa pirofosfatasa; RPPK, ribosil pirofosfocinasa; NAmpt, nicotinamida fosforibosiltransferasa; NMNAT, nicotinamida mononucleótidoadeniltransferasa; PARP ; NRK .
Si bien existe una capacidad significativa para la rápida degradación del NAD+ IV suministrado exógenamente en los metabolitos constituyentes, también vale la pena señalar que la captación de NAD+ extracelular también puede estar ocurriendo. Como el NAD+ tiene una carga negativa general, no puede atravesar las membranas celulares de forma pasiva y, por lo tanto, debe ser transportado activamente a través de la membrana. Varios investigadores han demostrado que la aplicación de NAD+ exógeno a diversos tipos de células humanas da lugar a un aumento significativo del NAD+ intracelular (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Aunque el mecanismo o mecanismos implicados aún no están completamente caracterizados, Alano et al. (2010) informaron de que el NAD+ exógeno podía entrar en las neuronas a través de los canales P2X7 y otros han observado sistemáticamente el transporte de NAD+ a través de las membranas mediante los hemicanales de la conexina 43 (CX43), incluso a concentraciones tan bajas como 250 pM (Billington et al., 2008). Como las conexinas tienen una amplia distribución en los tejidos humanos y la CX43 parece ser la conexina más ubicua en muchos tipos de células, no se puede descartar la posibilidad de una rápida captación de NAD+.
Por lo tanto, la captación celular y/o el metabolismo del NAD+ y los metabolitos NAM y ADPR y los metabolitos secundarios meNAM y NMN parecen proceder al ritmo de la infusión de 3 μmoles/min de NAD+ durante al menos las primeras 2 h. O bien el NAD+ y/o los metabolitos primarios analizados están siendo secuestrados eficientemente durante este primer período de 2 a 6 h o bien también se están formando metabolitos secundarios. La ADPR puede reciclarse para producir NAD+ a partir de NAM (Figura 4) o metabolizarse posteriormente a través de ectoenzimas como la CD203a (NAD+ pirofosfatasa) para producir AMP, que puede seguir metabolizándose rápidamente a adenosina por la CD73 a 5′-nucleotidasa (Bogan y Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). En apoyo de esta hipótesis, otros han reconocido un aumento de los niveles de adenosina en sangre como consecuencia de la infusión extracelular de NAD+ (Szczepañska-Konkel et al., 2003). La NAM también puede ser metabolizada a NMN a través de la vía de salvamento antes de la resíntesis a NAD+ (Figuras 3, 4) o actuada por las metiltransferasas hepáticas para producir N1-metilnicotinamida que puede ser excretada directamente o convertida en N-metil-2-piridona-5-carboxamida (2PY, +99% de la meNAM) y N-metil-4-piridona-3-carboxamida (4PY, ~0.25% de meNAM) antes de su excreción (Shibata y Matsuo, 1989; Okamoto et al, 2003).
Es evidente que, con el régimen de dosificación utilizado, los mecanismos implicados en el metabolismo y el secuestro del NAD+ y los metabolitos han alcanzado la saturación en algún momento después de las 2 horas, lo que da lugar a una elevación significativa del NAD+ en plasma y a la acumulación de todos los metabolitos analizados (NMA, ADPR, meNAM y NMN) a las 6 horas. Como se ha mencionado anteriormente, estos datos apoyan la opinión de que una de las principales vías del metabolismo del NAD+ en estas condiciones es la escisión del enlace glicosídico por ectoenzimas como la CD38 para producir NAM y ADPR. Sin embargo, el aumento del NMN plasmático después de 2 horas también sugiere que es probable que el NAD+ exógeno sea actuado por las pirofosfatasas de NAD+ extracelular, elevando el NMN plasmático y liberando AMP como un metabolito adicional.
En resumen, este estudio reveló por primera vez que: (a) a una velocidad de flujo de 3 μmole/min todo el NAD+ infundido exógenamente se eliminó rápida y completamente del plasma durante al menos las primeras 2 h; (b) el aumento de los biproductos metabólicos analizados es coherente con la actividad de las glicohidrolasas y las pirofosfatasas de NAD+; y (c) los productos de excreción urinaria derivados de la infusión de NAD+ incluyen NAD+ nativo y meNAM pero no NAM.
Aunque los hallazgos de esta investigación son novedosos y contribuyen a avanzar en nuestra comprensión del destino temporal del NAD+ exógeno en humanos, se identificaron limitaciones. Para mejorar el cálculo metabólico general, los estudios futuros deberían investigar los cambios en el NAD+ de los glóbulos rojos y los metabolitos y la excreción urinaria de los metabolitos secundarios de la meNAM, 2PY y 4PY. Además, probablemente será útil evaluar el impacto del NAD+ exógeno sobre los cambios en el metabolismo de las purinas, lo que debería incluir al menos la evaluación del AMP y la adenosina en plasma y glóbulos rojos. El uso de modelos animales también puede ayudar a aclarar la implicación relativa de las distintas vías metabólicas mediante el uso de inhibidores farmacológicos adecuados y el muestreo de tejidos.
En conclusión, este estudio pudo revelar por primera vez alguna información muy útil, hasta ahora desconocida, sobre el destino del NAD+ exógeno por vía intravenosa en los seres humanos, incluyendo, la seguridad general y la tolerabilidad de una infusión de NAD+ por vía intravenosa a una tasa de 3 μmoles/min, el rápido secuestro del NAD+ del plasma, la probable contribución de la actividad de la NAD+ glicohidrolasa y del NAD+ pirofosfato en el metabolismo del NAD+ y la aparente reabsorción tubular renal eficiente del NAM. Sin embargo, se requiere investigación adicional para revelar completamente el complejo destino metabólico de esta importante molécula. Además, la caracterización de estos cambios ayudará a progresar en el desarrollo y la mejora de los regímenes de tratamiento basados en NAD+ para los trastornos que probablemente se beneficien de una mayor disponibilidad de NAD+, incluidas las afecciones que requieren una mayor regeneración y reparación celular, como el Alzheimer y otras demencias neurodegenerativas.
Disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración ética
Los estudios con participantes humanos fueron revisados y aprobados por la Junta de Revisión Institucional de la Universidad William Carey, Hattiesburg, MS (Protocolo #2017-12). Los pacientes/participantes proporcionaron su consentimiento informado por escrito para participar en este estudio.
Contribuciones de los autores
RG participó en el diseño y la supervisión del estudio, la discusión crítica y la autoría del manuscrito. JBer participó en el diseño del estudio, la discusión crítica, la recogida de datos, el análisis estadístico, la redacción del manuscrito y la revisión del mismo. RM participó en el diseño del estudio, la discusión crítica, la supervisión clínica y la revisión del manuscrito. NB participó en el análisis bioquímico y la revisión del manuscrito. JW participó en el diseño del estudio, la discusión crítica y la revisión del manuscrito. JBen participó en la recopilación de datos y en la revisión del manuscrito. SB participó en el diseño del estudio y en la revisión del manuscrito. Todos los autores han revisado, leído y aprobado la versión final del manuscrito, y están de acuerdo con el orden de presentación de los autores.
Financiación
Este estudio fue financiado conjuntamente por la NAD+ Research Inc, (LA, EE.UU.) y el Australasian Research Institute Incorporation (Sydney, Australia) y se llevó a cabo en el Springfield Wellness Center, Springfield, LA, EE.UU..
Declaración de conflicto de intereses
RM es director de NAD+ Research Inc. y director médico del Springfield Wellness Center que utiliza NAD IV como terapia clínica. SB recibió honorarios de consultoría de NAD+ Research Inc.
Los demás autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos agradecer a Archway Apothecary Pty Limited, LA, EE.UU., su suministro gratuito de NAD+ IV para este proyecto.
Abeti, R., y Duchen, M. R. (2012). Activación de PARP por el estrés oxidativo inducido por β-amiloide: implicaciones para la enfermedad de Alzheimer. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Un estudio abierto y no aleatorizado de la farmacocinética del suplemento nutricional nicotinamida ribósido (NR) y sus efectos en los niveles de NAD+ en sangre en voluntarios sanos. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). El agotamiento de NAD+ es necesario y suficiente para la muerte neuronal mediada por PARP-1. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). NAD glycohydrolase activities and adp-ribose uptake in erythrocytes from normal subjects and cancer patients. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A., et al. (2008). Characterisation of NAD+ uptake in mammalian cells. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nucleotidasas y sus nuevas funciones en el metabolismo del NAD+ y del fosfato. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Cambios relacionados con la edad en el metabolismo del NAD+ estrés oxidativo y la actividad de sirt1 en ratas wistar. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Mapping NAD+ metabolism in the brain of ageing Wistar rats: potential targets for influencing brain senescence. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Cuantificación del metaboloma celular NAD+ utilizando un enfoque de espectrometría de masas de cromatografía líquida en tándem. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). El metaboloma del plasma NAD+ está desregulado en el envejecimiento «normal». Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Papel de la deficiencia endotelial de NAD+ en la disfunción vascular relacionada con la edad. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., y Milbrandt, J. (2017). El dominio del receptor toll/interleucina-1 de SARM1 posee una actividad intrínseca de escisión de NAD+ que promueve la degeneración axonal patológica. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., y Chiarugi, A. (2013). Insight into molecular and functional properties of NMNAT3 reveals new hints of NAD homeostasis within human mitochondria. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzymes and innate immunity: the role of human CD157 in leukocyte trafficking. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). La etiología de la pelagra: la importancia de ciertas observaciones epidemiológicas al respecto. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Cambios en el daño oxidativo, la inflamación y con la edad en el líquido cefalorraquídeo. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). La adenosina generada en el nicho de la médula ósea a través de una vía mediada por CD38 se correlaciona con la progresión del mieloma humano. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). Effect of nicotinamide mononucleotide on brain mitochondrial respiratory deficits in an Alzheimer’ disease-relevant murine model. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Cambios asociados a la edad en el estrés oxidativo y el metabolismo del NAD+ en los tejidos humanos. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Adicción la noche oscura del alma, NAD+ la luz de la esperanza. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). La administración a largo plazo de mononucleótidos de nicotinamida mitiga el declive fisiológico asociado a la edad en ratones. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., y Malavasi, F. (2018). El papel de la generación de adenosina extracelular en el desarrollo de enfermedades autoinmunes. Mediadores Inflamación. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN en la prevención, diagnóstico y tratamiento de las toxicomanías. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Diurnal variations in human urinary excretion of nicotinamide catabolites: effects of stress on the metabolism of nicotinamide. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., and Gupta, M. P. (2005). Poly(ADP-ribose) polymerase-1-dependent cardiac myocyte cell death during heart failure is mediated by NAD+ depletion and reduced Sir2α deacetylase activity. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Pharmacological effects of exogenous NAD on mitochondrial bioenergetics, DNA repair, and apoptosis. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., y Reidl, J. (2001). ¿Es necesaria una actividad NAD pirofosfatasa para la multiplicación de Haemophilus influenzae tipo b en el torrente sanguíneo? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., y Matsuo, H. (1989). Correlación entre la ingesta equivalente de niacina y la excreción urinaria de sus metabolitos, N’-metilnicotinamida, N’-metil-2-piridona-5-carboxamida y N’-metil-4-piridona-3-carboxamida, en humanos que consumen un alimento autoseleccionado. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Oxidative stress signaling in Alzheimer’s disease. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., y Angielski, S. (2003). Renal haemodynamics and natriuretic responses to intravenous administration of diadenosine tetraphosphate (ap4a) and nicotinamide adenine dinucleotide (NAD) in rat. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., y Yue, J. (2014). Roles y mecanismos de la vía de señalización CD38/difosfato cíclico de adenosina ribosa/Ca2+. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., y Yan, L. J. (2016). Fuentes e implicaciones del desequilibrio redox NADH/NAD+ en la diabetes y sus complicaciones. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., y Tsuchiya, M. (2006). The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Roles de NAD+, PARP-1 y sirtuinas en la muerte celular, la lesión cerebral isquémica y la lesión tisular inducida por la radiación de sincrotrón. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., y Swanson, R. A. (2003). La repleción de NAD+ previene el bloqueo glicolítico inducido por PARP-1 y la muerte celular en astrocitos de ratón cultivados. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Estrés oxidativo y NAD+ en la lesión cerebral isquémica: avances actuales y perspectivas futuras. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). Intermedios de NAD+: la biología y el potencial terapéutico de NMN y NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). El mononucleótido de nicotinamida, un intermediario clave de NAD+, trata la fisiopatología de la diabetes inducida por la dieta y la edad en ratones. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Neuronal death induced by misfolded prion protein is due to NAD+ depletion and can be relieved in vitro and in vivo by NAD+ replenishment. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). NADH puede entrar en los astrocitos para bloquear la muerte de astrocitos mediada por PARP-1. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., y Perry, G. (2007). Causas del estrés oxidativo en la enfermedad de Alzheimer. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar
.