Introduktion
Den överordnade pyridin-nukleotiden nikotinamidadenin-dinukleotid (NAD+) finns i alla kroppens celler och är nödvändig för cellens livskraft och funktion.
Som en kofaktor som ansvarar för elektrontransporten i andningskedjan är NAD+ och dess redoxpar NADH centrala för energiproduktionen (ATP) i mitokondrierna via oxidativ fosforylering. Den fosforylerade metaboliten av NAD+, NADP+ med dess redoxpar NADPH, ger också den reducerande kraften för att driva ett antal anabola reaktioner, inklusive kolesterol- och nukleinsyresyntesen, förlängning av fettsyror och regenerering av glutation (GSH), en av kroppens viktigaste antioxidanter. Sammantaget bidrar denna familj av pyridinnukleotider, , till redoxutbytet i över 400 enzymreaktioner. Det är viktigt att NAD+ inte förbrukas när det fungerar som ett redoxpar. NAD+ fungerar dock också som substrat för ett antal andra viktiga metaboliska processer och förbrukas därför som en följd av deras kemiska reaktioner, vilket kan leda till att vävnaden blir uttömd på NAD+. I detta antal ingår reaktioner som drivs av enzymerna i polyadenosinfosforibose-ribose-familjen (ADPR) (PARP 1-17) som kontrollerar DNA-reparation och kärnstabilitet, epigenetiska kontrollenzymer (Sirt1-7), intercellulär immunkommunikation (CD38/CD157) och neuronal regeneration (SARM1; Essuman et al., 2017). Det finns därför potential för störning av cellulär metabolism på flera nivåer under förhållanden där NAD+-förbrukningen av dessa enzymer överstiger NAD+-tillgången eller syntesen.
Den kliniska betydelsen av att bibehålla de cellulära NAD+-nivåerna fastställdes i början av förra århundradet med upptäckten att pellagra, en sjukdom som kännetecknas av diarré, dermatit, demens och död, kunde botas med livsmedel som innehöll NAD+-prekursorn niacin (även känd som vitamin B3; Goldberger, 1914). Även om pellagra är sällsynt i utvecklade länder har det visat sig att cellkoncentrationerna av NAD+ minskar under förhållanden med ökad oxidativ skada som uppstår vid åldrande (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Förändrade nivåer av NAD+ har visat sig åtfölja flera sjukdomar som är förknippade med ökad oxidativ/fri radikalskada, inklusive diabetes (Wu et al., 2016), hjärtsjukdomar (Pillai et al., 2005), åldersrelaterad vaskulär dysfunktion (Csiszar et al., 2019), ischemisk hjärnskada (Ying och Xiong, 2010), felveckade neuronala proteiner (Zhou et al, 2015) och Alzheimers demens (Abeti och Duchen, 2012).
Förutom de patologiska kännetecknen Aβ-plattor och neurofibrillära tau-tanglar är oxidativ skada ett genomgående fynd vid Alzheimers sjukdom och är allmänt erkänd som en tidig händelse i den patogena processen, till och med före Aβ-avlagring (Su et al., 2008). Även om de reaktiva syrearter (ROS) som orsakar denna skada sannolikt har sitt ursprung i flera olika källor, tros dysfunktionella mitokondrier och tillgången på redoxaktiva metaller som Fe++ och Cu+ spela en dominerande roll (Zhua et al., 2007).
En viktig konsekvens av cellulär oxidativ stress, i hjärnan och annorstädes, är enkel- eller dubbelsträngade brytningar i DNA. Som svar på DNA-skador hydrolyserar PARP1 NAD+ för att producera polymerer av ADP-ribose (Ying, 2013). Vi har tidigare visat att NAD+-nivåerna var omvänt korrelerade med mått på oxidativ stress i mänsklig vävnad (Massudi et al., 2012) och i råtthjärna (Braidy et al., 2014). Även om minskade NAD+-nivåer i hjärnan hos levande alzheimerpatienter väntar på bekräftelse med icke-invasiva tekniker stöder de konsekventa fynden av oxidativ skada i hjärnan efter dödlig behandling således starkt uppfattningen att accelererad omsättning och utarmning av NAD+ bidrar till den neurologiska dysfunktionen vid denna sjukdom. Eftersom interventioner inriktade på att återställa NAD+ har visat sig i djurmodeller stödja ett hälsosamt åldrande och förbättra metabolisk funktion (Yoshino et al., 2011; Mills et al., 2016) och demens (Long et al., 2015), utforskas aktivt strategier för att öka NAD+-nivåerna hos människor.
Den mest direkta metoden för att öka NAD+-nivåerna är genom intravenös (IV) administrering. Även om data från experimentell forskning är minimala har den betydande kliniska nyttan av IV NAD+-infusion vid alkoholavvänjning tidigare rapporterats (O’Holleran, 1961; Mestayer, 2019). Överraskande nog, medan oral administrering av NAD+-prekursorer som nikotinamidribosid (NR) eller nikotinamidmononukleotid (NMN) undersöks entusiastiskt för deras inverkan på NAD+-nivåerna (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), har det metabola ödet och de farmakokinetiska egenskaperna för IV NAD+-administration ännu inte rapporterats hos människor. I den här studien presenteras därför för första gången förändringarna i koncentrationerna av NAD+ och dess metaboliter under en IV-infusion av NAD+ i en kohort av friska manliga deltagare.
Material och metoder
Deltagare
Eleven (Test n = 8, Kontroll n = 3) manliga deltagare i åldrarna 30-55 år rekryterades via annonser på radio, TV och sociala medier. Alla deltagare hade ett BMI under 30 kg/m2 (testens genomsnittliga BMI = 27,5 ± 2,5 kg/m2; kontrollens genomsnittliga BMI = 24,6 ± 6,5 kg/m2), var inte diabetiker, rökte mindre än en cigarett och konsumerade mindre än två alkoholhaltiga standarddrycker per dag. Individer som tog lipidsänkande eller antiinflammatoriska läkemedel, som hade en historia av lever- eller njursvikt eller nyligen genomgått en mikrobiell infektion, trauma eller andra betydande eller obehandlade medicinska störningar uteslöts från studien. Försökspersonerna fick monetär ersättning för sin tid och sitt deltagande, oavsett om de fullföljde försöket eller inte. Deltagarna fick inte använda naturliga hälsoprodukter som innehöll NAD+, NR eller nikotinamid inom 14 dagar före och under studiens gång.
Diet standardisering
Dagen före NAD+ IV-infusionen konsumerade deltagarna en identisk niacinreducerad diet och drack endast vatten.
Ingen mat konsumerades på studiens dag förrän efter det att det sista 8 timmars blod-/urinprovet hade tagits. Deltagarna uppmuntrades att dricka vatten för att hålla sig normalt hydrerade. Inga andra dryckestyper var tillåtna.
För att säkerställa att adekvat energiintag upprätthölls för deltagarna under den 6 timmar långa infusionen innehöll IV-lösningen också 0,1 % druvsocker, vilket gav cirka 2 000 kalorier under den 6 timmar långa infusionsperioden.
Infusionsprotokoll
Deltagarna slumpades till antingen test- (n = 8) eller kontrollgruppen (n = 3). Deltagarna i testgruppen fick intravenöst 750 mg NAD+ i normal koksaltlösning (Archway Apothecary, Covington, LA, USA) under en sextimmarsperiod (infusionshastighet = ~2 mg/min ≡ 3 μmol/min). Denna dosering av NAD+ härleddes empiriskt och återspeglar en vanlig doseringsregim på kliniker (t.ex. Springfield Wellness Clinic, Springfield, LA, USA) som regelbundet tillhandahåller IV-infusioner av NAD+ i klinisk praxis. Deltagarna i kontrollgruppen fick intravenöst normal koksaltlösning under 6 timmar.
Klinisk administrering och övervakning av IV-infusionerna och provinsamlingen utfördes vid Springfield Wellness Center, Springfield, LA, USA.
Blodprovsinsamling
Baseline (TO)-blodprover samlades in på alla deltagare efter 12 timmars fastande under en natt, med en tidsplan som infaller omedelbart innan infusionen påbörjas. Ytterligare prover samlades sedan in 30, 60, 120 (2 h), 360 (6 h) och 480 (8 h) minuter efter infusionsstart.
Helblod samlades in via standard venpunktion (motsatt arm till infusionsstället) i ett 5 ml hepariniserat rör utan gel. Omedelbart efter insamlingen centrifugerades blodet vid 4 °C i 10 minuter vid 1 409× g.
Plasma- och röda blodkroppsfraktionerna separerades omedelbart och fördelades i 5 × 500 μL alikvot vardera. Alla alikvotar frystes sedan omedelbart och förvarades vid -80 °C fram till analys.
Urinprovinsamling
Efter insamling av ett baslinjeurinprov i mitten av urinstråket ombads deltagarna att tömma all urin i de behållare som tillhandahölls vid 30 minuter, 2 timmar, 6 timmar och 8 timmar efter det att NAD+-infusionen påbörjats. Om deltagarna behövde avlägsna urin mellan dessa tidpunkter ombads de att göra det i den nästföljande behållaren. Alla prover alikvoterades och förvarades vid -80 °C omedelbart efter mottagandet.
Analysmetod
Kromatografisk separation av NAD+ och relaterade metaboliter och MS-detektion Vätskekromatografi kopplad till tandem-masspektrometri (LC/MS/MS) utfördes med hjälp av en Sciex QTRAP 5500-masspektrometer (Sciex, Redwood City, CA, USA) enligt tidigare beskrivning (Clement et al., 2018). Kortfattat extraherades 100 μL human plasma eller urin i 400 μL iskall metanol, centrifugerades vid 4 °C i 10 minuter och filtrerades genom 3 kDa-membranpatroner. Provextrakten torkades under vakuum, rekonstituerades i 200 μL 100 mM NH4OAc-buffert och överfördes till 200 μL glasflaskor med lock före LC/MS/MS-analys. Standarder och prover (20 μL) injicerades på en Phenomenex NH2-kolonn (150 mm- 2 mm- 3 mm) enligt tidigare beskrivning. En binär lösningsmedelsgradient bestående av 5 mM NH4OAc pH 9,5 justerat med ammoniak (mobil fas A) och acetonitril (mobil fas B) med en flödeshastighet på 250 μL/min användes. Den initiala lösningsmedelsammansättningen vid injektionen var 25 % A, följt av en 2-minuters gradient till 45 % A och en snabb gradientramp till 80 % A (0,1 min) som bibehölls i 5,9 min, A ökades igen till 95 % (2 min), bibehölls i 13 min och återgick sedan till de initiala förhållandena (0,1 min) för ekvilibrering, med en total körtid på 30 min. Kolonnflödet leddes in i MS-detektorn. Kalibreringskurvor för enskilda metaboliter konstruerades med hjälp av förhållandet mellan topparean (metabolitens topparean dividerad med topparean av den valda IS) för varje kalibrator i förhållande till dess koncentration.
Interna standarder bestod av 2H2NAM (för NAM, metylNAM och ADPR) och 13C5;-Cyclic AMP (för NMN och NAD+). Observera att eftersom isotopmärken inte finns kommersiellt tillgängliga för alla NAD-metaboliter kan en nära besläktad molekyl (strukturell analog) också användas (Yamada et al., 2006) under förutsättning att den bedöms ha liknande stabilitet och joniseringseffektivitet under analysen. De interna standarder som valdes i denna studie har tidigare optimerats för den relaterade metaboliten (Bustamante et al., 2017).
Säkerhet
Säkerheten med IV NAD+ bedömdes med hjälp av leverfunktionstester och klinisk observation av eventuella biverkningar. Leverfunktionstesterna bestod av serum, totalt bilirubin (bili), alkaliskt fosfatas (ALP), alaninaminotransferas (ALT), gammaglutamyltransferas (GGT), laktatdehydrogenas (LD) och aspartataminotransferas (AST).
Statistisk analys
Den statistiska analysen genomfördes med hjälp av SPSS version 24 och GraphPad Prism version 8 för Windows. Ett oviktat medelvärde, tvåvägs ANOVA med Bonferronis post hoc-test för multipel jämförelse användes för att avgöra om medelkoncentrationen för testade analytiker skiljde sig åt under 8-timmarsperioden och mellan test- och kontrollgrupperna. Wilcoxon Signed Ranks-testet användes för att avgöra om skillnaderna i medelkoncentrationer av leverfunktionstest var signifikanta mellan baslinjen och tidpunkterna efter 8 timmar. Skillnader ansågs statistiskt signifikanta när p < 0,05.
Etik
Denna studie genomfördes i enlighet med The Code of Ethics of the World Medical Association (Helsingforsdeklarationen) för experiment med människor. Etiskt godkännande erhölls från William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Informerat samtycke erhölls från alla deltagare.
Resultat
Säkerhet
Inga biverkningar observerades under den 6 timmar långa infusionen med antingen placebo (saltlösning) eller testkohorten (NAD+).
En signifikant minskning av aktiviteten (1,3, 57, 3,6 enheter/L) för leverfunktionsenzymerna GGT, LD respektive AST observerades 8 timmar efter påbörjad NAD+-infusion (tabell 1). Ingen signifikant förändring av aktiviteten för någon leverfunktionsmarkör var uppenbar vid 8 timmar i de placebobehandlade proverna (saltlösning), men ett lågt antal prover kan minska känsligheten för diskriminering. En signifikant ökning på 2,75 μmol/L i plasmabilirubin observerades också. Ingen av förändringarna ansågs dock vara kliniskt signifikant.

Tabell 1. Wilcoxon Signed Ranks-testet användes för att avgöra om skillnaderna i medelkoncentrationer av leverfunktionstest var signifikanta mellan baslinjen och tidpunkterna efter 8 timmar.
Plasma
En kontinuerlig infusion av NAD+ med en hastighet på 3 μmol/min resulterade i en signifikant (398 %) ökning av NAD+-nivåerna i plasma endast vid tidpunkten efter 6 timmar (dvs. i slutet av infusionen) i förhållande till baslinjen (p < 0,0001). Detta skilde sig signifikant från den 6 timmars saltvattenbehandlade kontrollen (p < 0,001).
NAD+-nivåerna förblev förhöjda vid 8 timmar (dvs, 2 h efter infusionen) i förhållande till baslinjen och saltlösningsbehandlade kontrollprover.
Plasma NAD+-nivåerna förändrades inte signifikant från baslinjen under bedömningsperioden på 8 h i de saltlösningsbehandlade kontrollproverna (figur 1A).
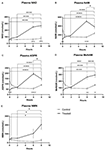
Figur 1. Förändringar i plasma nikotinamid adenin dinukleotid (NAD+) och metaboliter under 8 timmar . (A) NAD+, (B) nikotinamid (NAM), (C) adenosinfosforibos (ADPR), (D) metylnikotinamid (meNAM), (E) nikotinamidmononukleotid (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, enligt uppgift. Tvåvägs ANOVA med Bonferronis post hoc-test för multipel jämförelse användes för att avgöra om medelkoncentrationen för testade analytiker skiljde sig åt under 8-timmarsperioden och mellan test- (n = 8) och kontrollgrupperna (n = 3).
I likhet med de förändringar som observerades för NAD+ ökade plasmanivåerna av NAD+-metaboliten nikotinamid (NAM) signifikant med 409 % i slutet av NAD+-infusionen (dvs, 6 timmar) jämfört med baslinjen (p < 0,0001). Detta skilde sig likaså signifikant från den 6 h saltvattenbehandlade kontrollen (p < 0,001).
Vid tidpunkten 8 h (dvs. 2 h efter avslutad infusion) skiljde sig NAM-nivåerna mellan kontroll- och behandlingsgrupperna inte längre signifikant från varandra (p > 0,05).
NAM-nivåerna för saltvattenbehandlade kontrollprover förändrades inte signifikant under hela tidsperioden 8 h (p > 0,05, figur 1B).
I överensstämmelse med de förändringar som observerades för NAM ökade plasmanivåerna av NAD+-metaboliten ADPR signifikant med 393 % i slutet av NAD+-infusionen (dvs. 6 timmar) jämfört med baslinjen (p < 0,0001). Detta skilde sig signifikant från den 6 timmars saltvattenbehandlade kontrollen (p < 0,0001).
Vid 8 timmars tidpunkt (dvs. 2 timmar efter slutet av infusionen) förblev ADPR-nivåerna 305 % över baslinjen (p < 0,0001). Detta var dock inte signifikant högre än ADPR-nivåerna i de saltvattenbehandlade kontrollproverna vid samma tidpunkt (p > 0,05).
ADPR-nivåerna för de saltvattenbehandlade kontrollproverna förändrades inte signifikant under den 8 timmar långa tidsperioden (p > 0,05, figur 1C).
En Spearmans korrelationsanalys mellan gruppernas medelvärden över tidpunkterna på 8 timmar för de två NAD+-kataboliska metaboliterna NAM och ADPR gav en korrelationskoefficient på 1,00 (p < 0.001).
I likhet med de förändringar som observerades för NAM ökade plasmanivåerna av NAM-metaboliten metyl-nikotinamid (meNAM) signifikant till 350 % i slutet av NAD+-infusionen (dvs, 6 timmar) jämfört med både baslinjen (p < 0,0001) och den 6 timmars saltvattenbehandlade kontrollen (p < 0,01).
Vid 8 timmars tidpunkt (dvs, 2 h efter avslutad infusion) förblev meNAM-nivåerna 393 % över baslinjen (p < 0,0001) och signifikant högre än de salinbehandlade kontrollproverna vid samma tidpunkt (p < 0,05).
meNAM-nivåerna för saltvattenbehandlade kontrollprover förändrades inte signifikant under den 8 timmar långa tidsperioden (p > 0,05, figur 1D).
Plasmanivåerna av NMN, en metabolit av NAM via den anabola återvinningsvägen, var signifikant förhöjda (472 %) endast vid den 8 timmar långa tidspunkten (dvs, 2 timmar efter avslutad infusion, p < 0,05).
NMN-nivåerna för saltvattenbehandlade kontrollprover förändrades inte signifikant under den 8 timmar långa tidsperioden (p > 0,05, figur 1E).
Urin
Den kontinuerliga intravenösa infusionen av NAD+ med en hastighet av 3 μmol/min resulterade i en signifikant (538 %) ökning av utsöndringshastigheten av NAD+ i urinen vid tidpunkten 6 h (dvs, slutet av infusionen) jämfört med den som utsöndrades vid 30 minuter (p < 0,001). Detta skilde sig också signifikant från den mängd NAD+ i urinen som utsöndrades vid 6 h av de saltvattenbehandlade kontrollerna (p < 0,05).
Mängden NAD+ som utsöndrades i urinen minskade med 43 % (p < 0,05) vid 8 h (dvs, 2 timmar efter infusionen) i förhållande till den högsta utsöndringen vid 6 timmars tidpunkt.
Ursöndringshastigheten för NAD+ i urinen förändrades inte signifikant under bedömningsperioden på 8 timmar i kontrollprover som behandlats med saltlösning (figur 2A).

Figur 2. Förändringar i NAD+ och metaboliter i urinen under 8 timmar (de första 6 timmarna bestod av en kontinuerlig, 3 μmol/min, NAD+ IV-infusion). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, enligt uppgift. Tvåvägs ANOVA med Bonferronis post hoc-test för multipel jämförelse användes för att avgöra om medelkoncentrationen för testade analytiker skiljde sig åt under 8-timmarsperioden och mellan test- (n = 8) och kontrollgrupperna (n = 3).
Utsöndringshastigheten av NAD+-metaboliten NAM förändrades inte signifikant under den 8 timmar långa testperioden och skiljde sig inte från den observerade NAM-utsöndringshastigheten för de saltlösningsbehandlade kontrollerna (figur 2B).
Ursöndringshastigheten i urinen av NAM-metaboliten meNAM var signifikant förhöjd (403 %) vid den 6 timmar långa tidspunkten (dvs, slutet av infusionen) jämfört med den som observerades vid 30 minuter (p < 0,01). Mängden meNAM som utsöndrades i urinen minskade med 43 % (p < 0,05) vid 8 h (dvs, 2 h efter infusionen) i förhållande till den högsta utsöndringen vid 6 h.
Urinutsöndringshastigheten för meNAM förändrades inte signifikant under den 8 h långa bedömningsperioden i saltlösningsbehandlade kontroller (figur 2C).
Diskussion
Ett ökande intresse för NAD+-baserade terapier, inklusive NAD+-infusioner, har framhävt behovet av en tydligare förståelse för vad som händer med NAD+ och dess metaboliter efter intravenös administrering. Den aktuella studien dokumenterar förändringar i nivåerna av NAD+ och viktiga metaboliter i både plasma och urin under 8 timmar med hjälp av en typisk klinisk doseringsregim på 750 mg NAD+ som administreras IV under en 6 timmars period.
Det är viktigt att infusion av NAD+ inte gav upphov till några observerbara biverkningar i testkohorten utan snarare minskade plasmaaktiviteterna av enzymer som indikerar hepatisk stress, t.ex. intrahepatisk LD och AST och det posthepatiska (gallgången) enzymet GGT, vilket tyder på att integriteten hos både intrahepatisk och posthepatisk vävnad förbättrades även inom den relativt korta tidsramen på 8 timmar. Ökningen av bilirubin, en nedbrytningsprodukt för röda blodkroppar, vid 8 timmar kan återspegla antingen en mycket liten ökning av omsättningen av röda blodkroppar, vilket kan inträffa på grund av infusionsinducerad hemolys, eller minskad hemmetabolism (tabell 1). Med tanke på den mycket låga storleken på denna förändring ansågs den dock inte vara kliniskt relevant.
Som väntat förblev plasmanivåerna av NAD+ och metaboliterna NAM och ADPR samt NAM-metaboliterna NMN och meNAM i stort sett oförändrade under hela 8-timmarsperioden hos deltagare som behandlats med saltlösning (dvs. kontroll). En uppenbar minskning av NAM, meNAM och ADPR observerades dock mellan 30 minuter och 6 timmar, vilket sannolikt berodde på en utspädningseffekt av saltlösning. I överensstämmelse med denna uppfattning sågs att värdena för dessa analyter återgick till grundnivåerna efter 8 timmar (dvs,
Oförväntat nog ökade dock inte NAD+-nivåerna i plasma i de deltagare som fick NAD+-infusion förrän efter 2 timmars tidpunkt och nådde ett maximum på ~400 % över baslinjen för NAD+ och metaboliterna NAM, meNAM och ADPR (398 %, 409 % respektive 393 %) först vid 6 timmars tidpunkt (figurerna 1A-E). Detta överensstämde internt med toppen av urinutsöndringen för både NAD+ och meNAM som också inträffade vid 6 timmar innan den snabbt minskade efter slutet av infusionen (figurerna 2A-C).
NAD+ infunderades med en konstant hastighet på 3 μmol/min. Därför infunderades 90 μmol NAD+ direkt i det vaskulära kompartmentet var 30:e minut, vilket gav totalt 1 080 μmol vid slutet av infusionen vid 6 timmar. Intravaskulär blandning från varje punkt i infusionen sker inom ~2 minuter; om man antar en genomsnittlig blodvolym på 5, skulle det tillsatta NAD+, i avsaknad av signifikant metabolism eller absorption, motsvara en ytterligare ökning av (NAD+) på minst 18 μM, var 30:e minut under de 6 timmarna av infusionen. Även om en ökning av denna storlek ligger väl inom denna undersöknings analytiska detektionsgränser observerades ingen ökning av vare sig NAD+ eller dess metaboliter förrän efter 2 timmar (dvs. vid 6 timmars tidpunkt) i vare sig plasma eller urin. Denna oväntade observation tyder på ett snabbt, och åtminstone under de första två timmarna, fullständigt vävnadsupptag och/eller metabolism av NAD+ och/eller dess metaboliter.
Ett antal enzymer kan åstadkomma en effektiv NAD+-katabolism, bland annat sirtuinerna (SIRT 1-7), adenosindifosfat (ADP)-ribosetransferaserna (ART) och poly(ADP-ribose)-polymeraserna (PARP 1-17) samt de cykliska ADP-ribosesynteserna (cADPR) (CD38, CD157). Extracellulära NAD+ pyrofosfataser som finns i humant serum kan också bryta ner NAD+ till AMP och NMN (Schmidt-Brauns et al., 2001). Cellytans protein CD73 omvandlar också NMN till NR, som lätt korsar cellmembranen för potentiell resyntes till NAD+. Det är viktigt att de NAD+-kataboliserande glykohydrolaserna CD38 och CD157, ektonukleotidpyrofosfatas (CD203a) och NMN-katabolisatorn CD73 är ektoenzymer som finns på en mängd olika celler, bland annat lymfocytära, granulocytära, neuronala och endotelceller (Wei et al., 2014), och plasmalösliga NAD-glykohydrolaser kan också förekomma (figur 3; Funaro et al., 2009). Den parallella ökningen av plasma NAM och ADPR (korrelationskoefficient på 1,000, p < 0,001, data visas inte) tyder starkt på att åtminstone vid 6 timmar är ett viktigt öde för NAD+ metabolism genom klyvning av den glykosidiska ADPribose-nikotinamidlänken till NAM och ADPR, biprodukter som är symtomatiska för NAD-glykohydrolas (t.ex. CD38) aktivitet. Detta stämmer överens med bevis från andra där framför allt CD38 har visat sig ha en primär roll i kontrollen av extracellulära NAD+-nivåer (Wei et al., 2014). Vuxna mänskliga erytrocyter är CD38-positiva och uttrycker höga nivåer av NAD+ glykohydrolasaktivitet, som klyver exogent NAD+ för att förse erytrocyter med ADP-ribose som effektivt kan tas upp i cellen (Kim et al., 1993; Albeniz et al., 2004). Avsaknaden av någon ökning av antingen NAD+ eller metaboliter, i plasma eller urin, förrän efter de första 2 timmarna av infusionen tyder på att NAD+ och/eller dess metaboliter transporteras ut ur det extracellulära kärlutrymmet och effektivt binds till vävnad eller extravaskulära kompartment som NAD+ och/eller dess metaboliter under denna tidsperiod.

Figur 3. Potentiell extracellulär katabolism av exogent tillfört NAD+ genom aktivitet av ektoenzymerna CD38 (ADP-ribosesyntas (ADPR)), CD203a (NAD+ pyrofosfatas), CD 73 (5′-nukleotidas), CD157-ADP-ribosylcyklas 2. Förkortningar: NAM, nikotinamid; NMN, nikotinamidmononukleotid; ADPR, adenosindifosfatribosid; meNAM, metylnikotinamid; 4PY, N-metyl-4-pyridon-3-karboxamid; 2PY, metyl-2-pyridon-5-karboxamid; ARPP, ADP-ribosepyrofosfatas, RPPK, ribosylpyrofosfokinas, NAmpt, nikotinamidfosforibosyltransferras, NMNAT, nikotinamidmononukleotidadenyltransferas, CX-43, connexin 43.
Tyvärr är PARP och sirtuiner involverade i NAD+-katabolismen, men som intracellulära enzymer med representanter i cytoplasma, kärna och mitokondrier är det osannolikt att de direkt påverkar extracellulära NAD+-nivåer. Dessa enzymer kan dock förväntas reagera på förändringar i intracellulära koncentrationer av NAD+, NAM och NR som kan uppstå vid exogen tillförsel av NAD+. I figur 4 sammanfattas schematiskt de möjliga ödena för exogent NAD+.
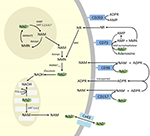
Figur 4. Potentiellt intra- och extracellulärt öde för exogent tillfört NAD+. Förkortningar: CD38 , CD203a (NAD+ pyrofosfatas), CD 73 (5′-nukleotidas). NAM, nikotinamid; NMN, nikotinamidmononukleotid; ADPR, adenosindifosfatribosid; meNAM, metylnikotinamid; 4PY, N-metyl-4-pyridon-3-karboxamid; 2PY, metyl-2-pyridon-5-karboxamid; ARPP, ADP-ribosepyrofosfatas, RPPK, ribosylpyrofosfokinas, NAmpt, nikotinamidfosforibosyltransferras, NMNAT, nikotinamidmononukleotidadenyltransferas, PARP, NRK .
Som det finns en betydande kapacitet för snabb nedbrytning av det exogent tillförda IV NAD+ till ingående metaboliter, är det också värt att notera att upptag av extracellulärt NAD+ också kan förekomma. Eftersom NAD+ har en negativ laddning kan det inte passivt passera cellmembran och måste därför aktivt transporteras över membranen. Att detta sker har visats av ett antal forskare som har rapporterat att exogent NAD+ applicerat på en rad olika mänskliga celltyper faktiskt resulterar i en betydande ökning av intracellulärt NAD+ (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Även om den eller de mekanismer som är inblandade ännu inte är fullständigt karakteriserade har Alano et al. (2010) rapporterat att exogent NAD+ kan tränga in i neuronerna genom P2X7-styrda kanaler och andra har konsekvent observerat att NAD+ transporteras genom membranen genom connexin 43 (CX43)-hemikanaler, till och med vid koncentrationer som är så låga som 250 pM (Billington et al., 2008). Eftersom connexiner har en stor spridning i mänsklig vävnad och CX43 verkar vara det mest allestädes närvarande connexinet i många celltyper kan man inte bortse från potentialen för ett snabbt upptag av NAD+.
Det cellulära upptaget och/eller metabolismen av NAD+ och metaboliterna NAM och ADPR samt de sekundära metaboliterna meNAM och NMN tycktes alltså fortsätta i samma takt som NAD+-infusionen på 3 μmol/min under åtminstone de första två timmarna. Antingen binds NAD+ och/eller de testade primära metaboliterna effektivt under denna första 2-6 timmars period eller så bildas också sekundära metaboliter. ADPR kan återvinnas för att producera NAD+ från NAM (figur 4) eller metaboliseras ytterligare via ektoenzymer som CD203a (NAD+ pyrofosfatas) för att producera AMP som ytterligare snabbt kan metaboliseras till adenosin av CD73 a 5′-nukleotidas (Bogan och Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). Till stöd för denna hypotes har en ökning av blodets adenosinnivåer erkänts av andra som en följd av extracellulär NAD+-infusion (Szczepañska-Konkel et al., 2003). NAM kan också metaboliseras till NMN via räddningsvägen före resyntes till NAD+ (figurerna 3 och 4) eller påverkas av hepatiska metyltransferaser för att producera N1-metylnicotinamid som antingen kan utsöndras direkt eller omvandlas ytterligare till N-metyl-2-pyridon-5-karboxamid (2PY, +99 % av meNAM) och N-metyl-4-pyridon-3-karboxamid (4PY, ~0.25 % av meNAM) före utsöndring (Shibata och Matsuo, 1989; Okamoto et al, 2003).
Det är uppenbart att vid den doseringsregim som använts har de mekanismer som är involverade i metabolism och sekvensering av NAD+ och metaboliter nått mättnad någon gång efter 2 timmar, vilket resulterar i en signifikant förhöjning av NAD+ i plasma och ackumulering av alla testade metaboliter (NMA, ADPR, meNAM och NMN) vid 6 timmar. Som tidigare nämnts stöder dessa data uppfattningen att en viktig väg för NAD+-metabolismen under dessa förhållanden är klyvningen av den glykosidiska bindningen av ektoenzymer som CD38 för att producera NAM och ADPR. Ökningen av plasma-NMN efter 2 timmar tyder dock också på att exogent NAD+ sannolikt påverkas av extracellulära NAD+ pyrofosfataser, vilket höjer plasma-NMN och frigör AMP som en ytterligare metabolit.
Sammanfattningsvis avslöjade denna studie för första gången att: (a) vid en flödeshastighet på 3 μmole/min all exogent infunderad NAD+ avlägsnades snabbt och fullständigt från plasma under åtminstone de första 2 timmarna; (b) ökningen av metaboliska bi-produkter som analyserats är förenlig med NAD+-glykohydrolaser och NAD+-pyrofosfatasaktivitet; och (c) de urinutsöndringsprodukter som uppkommer vid NAD+-infusion innefattar nativ NAD+ och meNAM men inte NAM.
Och även om resultaten av denna undersökning är nya och i viss mån bidrar till att öka vår förståelse av det tidsbestämda ödet för exogent NAD+ hos människor, har begränsningar identifierats. För att förbättra den övergripande metaboliska beräkningen bör framtida studier undersöka förändringar av NAD+ och metaboliter i röda blodkroppar och urinutsöndring av de sekundära meNAM-metaboliterna 2PY och 4PY. Dessutom kommer det sannolikt att vara användbart att bedöma effekten av exogent NAD+ på förändringar i purinmetabolismen, vilket åtminstone bör inbegripa en bedömning av AMP och adenosin i plasma och röda blodkroppar. Användning av djurmodeller kan också bidra till att klargöra den relativa inblandningen av de olika metaboliska vägarna genom användning av lämpliga farmakologiska hämmare och vävnadsprovtagning.
Sammanfattningsvis kunde denna studie för första gången avslöja en del mycket användbar, tidigare okänd, information om vad som händer med exogent intravenöst NAD+ hos människor, inklusive den övergripande säkerheten och tolerabiliteten av en intravenös NAD+-infusion med en hastighet på 3 μmol/min, den snabba utskiljningen av NAD+ från plasma, det troliga bidraget från både NAD+-glykohydrolas och NAD+-pyrofosfataktivitet i metabolismen av NAD+ och den uppenbart effektiva renala tubulära reabsorptionen av NAM. Det krävs dock ytterligare forskning för att fullt ut avslöja denna viktiga molekyls komplexa metaboliska öde. Vidare kommer karakteriseringen av dessa förändringar att bidra till utvecklingen och förbättringen av NAD+-baserade behandlingsregimer för sjukdomar som sannolikt kommer att gynnas av ökad NAD+ -tillgång, inklusive tillstånd som kräver ökad cellulär regeneration och reparation, t.ex. Alzheimers sjukdom och andra neurodegenerativa demenssjukdomar.
Datatillgänglighet
De dataset som genererades för denna studie är tillgängliga på begäran till motsvarande författare.
Etikutlåtande
Studierna som involverar mänskliga deltagare granskades och godkändes av William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Patienterna/deltagarna gav sitt skriftliga informerade samtycke till att delta i denna studie.
Författarbidrag
RG deltog i studiens utformning och övervakning, kritisk diskussion och manuskriptförfattarskap. JBer deltog i studiedesign, kritisk diskussion, datainsamling, statistisk analys, manuskriptutformning och manuskriptgranskning. RM deltog i studiens utformning, kritisk diskussion, klinisk övervakning och granskning av manuskript. NB deltog i biokemisk analys och granskning av manuskriptet. JW deltog i studiens utformning, kritisk diskussion och granskning av manuskriptet. JBen deltog i datainsamling och granskning av manuskript. SB deltog i studiens utformning och granskning av manuskript. Alla författare har granskat, läst och godkänt den slutliga versionen av manuskriptet och instämmer i författarnas presentationsordning.
Finansiering
Denna studie finansierades gemensamt av NAD+ Research Inc, (LA, USA) och Australasian Research Institute Incorporation (Sydney, Australien) och genomfördes på Springfield Wellness Center, Springfield, LA, USA.
Intressekonfliktförklaring
RM är direktör för NAD+ Research Inc. och medicinsk chef för Springfield Wellness Center som använder IV NAD som klinisk behandling. SB har fått konsultarvoden från NAD+ Research Inc.
De övriga författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi vill tacka Archway Apothecary Pty Limited, LA, USA, för deras gratis leverans av IV NAD+ för detta projekt.
Abeti, R., och Duchen, M. R. (2012). Aktivering av PARP av oxidativ stress inducerad av β-amyloid: implikationer för Alzheimers sjukdom. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). En öppen, icke-randomiserad studie av farmakokinetiken hos näringstillskottet nikotinamidribosid (NR) och dess effekter på NAD+-nivåer i blodet hos friska frivilliga. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). NAD+-depletion är nödvändig och tillräcklig för PARP-1-medierad neurondöd. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R. och Bermek, E. (2004). NAD-glykohydrolasaktiviteter och adp-riboseupptag i erytrocyter från normala personer och cancerpatienter. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Karakterisering av upptag av NAD+ i däggdjursceller. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nukleotidaser och deras nya roller i NAD+- och fosfatmetabolismen. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A. och Grant, R. (2011). Åldersrelaterade förändringar i NAD+-metabolism oxidativ stress och sirt1-aktivitet hos wistarråttor. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Kartläggning av NAD+-metabolismen i hjärnan hos åldrande Wistar-råttor: potentiella mål för att påverka senescens i hjärnan. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Kvantifiering av den cellulära NAD+-metabolismen med hjälp av en tandemvätskekromatografisk masspektrometrimetod. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P. och Braidy, N. (2018). Plasma NAD+-metabolomet är dysreglerat vid ”normalt” åldrande. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rollen av endotelial NAD+-brist i åldersrelaterad vaskulär dysfunktion. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A. och Milbrandt, J. (2017). SARM1 toll/interleukin-1-receptordomänen besitter en inneboende NAD+-klyvningsaktivitet som främjar patologisk axonal degeneration. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M. och Chiarugi, A. (2013). Insikt i molekylära och funktionella egenskaper hos NMNAT3 avslöjar nya tips om NAD homeostas inom mänskliga mitokondrier. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ektoenzymer och medfödd immunitet: den humana CD157:s roll i leukocyttrafiken. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). Pellagras etiologi: betydelsen av vissa epidemiologiska observationer i samband med detta. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A. och Croft, K. D. (2014). Förändringar av oxidativa skador, inflammation och med åldern i cerebrospinalvätska. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenosin som genereras i benmärgsnischen genom en CD38-medierad väg korrelerar med progression av humant myelom. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R. och An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S. och Schuh, R. A. (2015). Effekt av nikotinamidmononukleotid på hjärnans mitokondriella respiratoriska brister i en Alzheimers sjukdom-relevant murinmodell. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Åldersassocierade förändringar i oxidativ stress och NAD+-metabolism i mänsklig vävnad. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Addiction the Dark Night of the Soul, NAD+ the Light of Hope. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Långvarig administrering av nikotinamidmononukleotid mildrar åldersassocierad fysiologisk nedgång hos möss. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R. och Malavasi, F. (2018). Den extracellulära adenosingenereringens roll i utvecklingen av autoimmuna sjukdomar. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN i förebyggande, diagnos och behandling av narkotikamissbruk. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Dagliga variationer i människans urinutsöndring av nikotinamidkataboliter: effekter av stress på nikotinamidmetabolismen. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S. och Gupta, M. P. (2005). Poly(ADP-ribose)polymeras-1-beroende celldöd av hjärtmuskelceller under hjärtsvikt medieras av NAD+-depletion och minskad Sir2α-deacetylasaktivitet. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Farmakologiska effekter av exogent NAD på mitokondriell bioenergetik, DNA-reparation och apoptos. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S. och Reidl, J. (2001). Är en NAD-pyrofosfatasaktivitet nödvändig för multiplikation av Haemophilus influenzae typ b i blodet? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K. och Matsuo, H. (1989). Korrelation mellan intag av niacinekvivalenter och urinutsöndring av dess metaboliter, N’-metylnicotinamid, N’-metyl-2-pyridon-5-karboxamid och N’-metyl-4-pyridon-3-karboxamid, hos människor som konsumerar ett självvalt livsmedel. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Signalering av oxidativ stress vid Alzheimers sjukdom. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M. och Angielski, S. (2003). Renal hemodynamik och natriuretiska reaktioner på intravenös administrering av diadenosintetrafosfat (ap4a) och nikotinamidadenindinukleotid (NAD) hos råtta. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R. och Yue, J. (2014). Roller och mekanismer för CD38/cykliskt adenosindifosfatribose/Ca2+-signalvägen. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H. och Yan, L. J. (2016). Källor och konsekvenser av NADH/NAD+ redoxobalans vid diabetes och dess komplikationer. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H. och Tsuchiya, M. (2006). Samtidig mätning av nikotinamid-adenin-dinukleotid och relaterade föreningar med hjälp av vätskekromatografi/elektrosprayjoniseringstandemasspektrometri. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Roller av NAD+, PARP-1 och sirtuiner i celldöd, ischemisk hjärnskada och synkrotronstrålning röntgeninducerad vävnadsskada. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P. och Swanson, R. A. (2003). NAD+-tillförsel förhindrar PARP-1-inducerad glykolytisk blockering och celldöd i odlade astrocyter från mus. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G.. (2010). Oxidativ stress och NAD+ vid ischemisk hjärnskada: aktuella framsteg och framtida perspektiv. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). NAD+ intermediärer: NMN:s och NR:s biologi och terapeutiska potential. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J. och Imai, S. (2011). Nikotinamidmononukleotid, en viktig NAD+-intermediär, behandlar patofysiologin vid diet- och åldersinducerad diabetes hos möss. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Neuronal död inducerad av felveckat prionprotein beror på NAD+ utarmning och kan lindras in vitro och in vivo av NAD+ påfyllning. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A. och Ying, W. (2005). NADH kan komma in i astrocyter för att blockera PARP-1-medierad astrocytdöd. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A. och Perry, G. (2007). Orsaker till oxidativ stress vid Alzheimers sjukdom. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s0000018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar