- Introduction
- Materiaalit ja menetelmät
- Osallistujat
- Ruokavalion vakiointi
- Infuusion protokolla
- Verinäytteiden keruu
- Virtsanäytteiden keruu
- Analyyttinen menetelmä
- Turvallisuus
- Statistinen analyysi
- Etiikka
- Tulokset
- Turvallisuus
- Plasma
- Virtsa
- Keskustelu
- Tietojen saatavuus
- Eettiset periaatteet
- Author Contributions
- Rahoitus
- Erittely eturistiriidoista
- Kiitokset
Introduction
Pyridiini-nukleotidin emoainesosa nikotiiniamidi-adeniinidinukleotidi (NAD+) on läsnä elimistön kaikissa soluissa, ja se on välttämätön solujen elinkyvylle ja elinkelpoisuudelle.
Hengitysketjun elektroninkuljetuksesta vastaavana kofaktorina NAD+ ja sen redox-pari NADH ovat keskeisiä energian (ATP) tuotannossa mitokondrioissa oksidatiivisen fosforylaation kautta. NAD+:n fosforyloitu metaboliitti NADP+ ja sen redox-pari NADPH tuottavat myös pelkistävää voimaa useiden anabolisten reaktioiden, kuten kolesteroli- ja nukleiinihapposynteesin, rasvahappojen pidentämisen ja glutationin (GSH), yhden elimistön tärkeimmän antioksidantin, regeneroinnin käynnistämiseen. Kaiken kaikkiaan tämä pyridiininukleotidiperhe osallistuu yli 400 entsyymireaktion redox-vaihtoon. Tärkeää on, että toimiessaan redox-parina NAD+ ei kulu. NAD+ toimii kuitenkin myös monien muiden tärkeiden aineenvaihduntaprosessien substraattina, ja siksi sitä kuluu niiden kemiallisten reaktioiden seurauksena, mikä saattaa tyhjentää kudoksen NAD+:sta. Tähän joukkoon kuuluvat reaktiot, joita ohjaavat DNA:n korjausta ja ydinvakautta kontrolloivat polyadenosiinifosforiboosi-riboosi (ADPR) -entsyymiperheen entsyymit (PARP 1-17), epigeneettisen kontrollin entsyymit (Sirt1-7), solujen välinen immuuniviestintä (CD38/CD157) ja neuronaalinen regeneroituminen (SARM1; Essuman ym., 2017). On siis mahdollista, että solujen aineenvaihdunta häiriintyy useilla tasoilla olosuhteissa, joissa näiden entsyymien NAD+:n kulutus ylittää NAD+:n tarjonnan tai synteesin.
Solujen NAD+-tasojen ylläpitämisen kliininen merkitys todettiin viime vuosisadan alkupuolella, kun havaittiin, että pellagraa, tautia, jolle oli ominaista ripuli, ihotulehdus, dementia ja kuolema, voitiin parantaa elintarvikkeilla, jotka sisälsivät NAD+:n esiasteena toimivaa niasiinia (joka tunnetaan myös nimellä B3-vitamiini; Goldberger, 1914). Vaikka pellagra on harvinaista kehittyneissä maissa, NAD+:n solupitoisuuksien on osoitettu vähenevän olosuhteissa, joissa oksidatiiviset vauriot lisääntyvät, kuten ikääntymisen aikana (Braidy ym., 2011; Massudi ym., 2012; Guest ym., 2014). Muuttuneiden NAD+-pitoisuuksien on havaittu liittyvän useisiin häiriöihin, jotka liittyvät lisääntyneisiin oksidatiivisiin/vapaiden radikaalien aiheuttamiin vaurioihin, kuten diabetekseen (Wu ym., 2016), sydänsairauksiin (Pillai ym., 2005), ikään liittyviin verisuonten toimintahäiriöihin (Csiszar ym., 2019), iskeemiseen aivovaurioon (Ying ja Xiong, 2010), vääristyneisiin neuronaalisiin proteiineihin (Zhou et al., 2015) ja Alzheimerin dementia (Abeti ja Duchen, 2012).
Aβ-plakkien ja neurofibrillaaristen tau-kudosten patologisten tunnusmerkkien lisäksi oksidatiiviset vauriot ovat johdonmukainen löydös Alzheimerin taudissa, ja ne tunnustetaan laajalti patogeenisen prosessin varhaiseksi tapahtumaksi, joka edeltää jopa Aβ:n laskeumaa (Su ym., 2008). Vaikka näitä vaurioita aiheuttavat reaktiiviset happilajit (ROS) ovat todennäköisesti peräisin useista eri lähteistä, mitokondrioiden toimintahäiriöillä ja redox-aktiivisten metallien, kuten Fe++ ja Cu+, saatavuudella uskotaan olevan hallitseva rooli (Zhua ym., 2007).
Solujen oksidatiivisen stressin tärkeimpiä seurauksia niin aivoissa kuin muuallakin ovat DNA:n yksi- tai kaksoissäikeiset katkokset. Vastauksena DNA-vaurioon PARP1 hydrolysoi NAD+:ta tuottaakseen ADP-riboosin polymeerejä (Ying, 2013). Osoitimme aiemmin, että NAD+-tasot korreloivat käänteisesti oksidatiivisen stressin mittauksiin ihmiskudoksessa (Massudi ym., 2012) ja rotan aivoissa (Braidy ym., 2014). Näin ollen, vaikka elävien Alzheimerin tautia sairastavien aivojen alentuneet NAD+-tasot odottavat vahvistusta ei-invasiivisilla tekniikoilla, johdonmukaiset havainnot oksidatiivisista vaurioista post mortem -aivoissa tukevat vahvasti näkemystä, jonka mukaan kiihtynyt NAD+:n vaihtuvuus ja ehtyminen myötävaikuttavat neurologiseen toimintahäiriöön tässä taudissa. Koska NAD+:n palauttamiseen tähtäävien toimenpiteiden on osoitettu eläinmalleissa tukevan tervettä ikääntymistä ja parantavan aineenvaihdunnan toimintaa (Yoshino ym., 2011; Mills ym., 2016) ja dementiaa (Long ym., 2015), tutkitaan aktiivisesti strategioita NAD+-tasojen nostamiseksi ihmisillä.
Suoraviivaisin menetelmä NAD+-tasojen nostamiseksi on suonensisäinen (IV) anto. Vaikka kokeellisista tutkimuksista saadut tiedot ovat vähäisiä, IV NAD+ -infuusion merkittävästä kliinisestä hyödystä alkoholin vieroituksessa on raportoitu aiemmin (O’Holleran, 1961; Mestayer, 2019). Yllättävää kyllä, vaikka NAD+-esiasteiden, kuten nikotiiniamidi-ribosidin (NR) tai nikotiiniamidi-mononukleotidin (NMN), oraalista antoa tutkitaan innokkaasti niiden vaikutuksesta NAD+-tasoihin (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), IV NAD+ -annostelun metabolista kohtaloa ja farmakokineettisiä ominaisuuksia ei ole vielä raportoitu ihmisillä. Siksi tässä tutkimuksessa esitellään ensimmäistä kertaa NAD+:n ja sen metaboliittien pitoisuuksien muutokset NAD+:n IV-infuusion aikana terveiden miesosallistujien kohortissa.
Materiaalit ja menetelmät
Osallistujat
Ensitoista (testi n = 8, kontrolli n = 3) 30-55-vuotiasta miesosallistujaa (testi n = 8, kontrollointi n = 3) rekrytoitiin radiossa, TV:ssä ja sosiaalisessa mediassa julkaistujen mainosten avulla. Kaikkien osallistujien painoindeksi oli alle 30 kg/m2 (testin keskimääräinen painoindeksi = 27,5 ± 2,5 kg/m2; kontrollin keskimääräinen painoindeksi = 24,6 ± 6,5 kg/m2), he eivät olleet diabeetikkoja, he polttivat alle yhden savukkeen ja käyttivät alle kaksi tavallista alkoholijuomaa päivässä. Tutkimuksesta suljettiin pois henkilöt, jotka käyttivät lipidejä alentavia tai tulehduskipulääkkeitä, joilla oli aiemmin ollut maksan tai munuaisten vajaatoiminta tai joilla oli hiljattain ollut mikrobiperäinen infektio, trauma tai jokin muu merkittävä tai hoitamaton lääketieteellinen häiriö. Koehenkilöt saivat rahallisen korvauksen ajastaan ja osallistumisestaan riippumatta siitä, suorittivatko he kokeen loppuun. Osallistujat eivät saaneet käyttää NAD+:aa, NR:ää tai nikotiiniamidia sisältäviä luontaistuotteita 14 päivän aikana ennen tutkimusta ja sen aikana.
Ruokavalion vakiointi
NAD+:n infuusiota edeltävänä päivänä osallistujat nauttivat identtisen niasiinipitoisen, vähärasvaisen ruokavalion, ja he joivat vain vettä.
Tutkimuspäivänä ruoka-aineiden nauttiminen oli kiellettyä vasta viimeisen, 8 tunnin mittaisen veri-/virusnäytteenoton jälkeen. Osallistujia kannustettiin juomaan vettä, jotta he pysyisivät normaalisti nesteytettyinä. Muita juomatyyppejä ei sallittu.
Takatakseen, että osallistujien riittävä energiansaanti säilyi kuuden tunnin infuusion aikana, infuusioliuos sisälsi myös 0,1 % dekstroosia, joka tarjosi noin 2000 kaloria kuuden tunnin infuusion aikana.
Infuusion protokolla
Osallistujat satunnaistettiin joko Testi- (n = 8) tai Kontrolliryhmään (n = 3). Testiryhmän osallistujille annettiin suonensisäisesti 750 mg NAD + normaalissa suolaliuoksessa (Archway Apothecary, Covington, LA, USA) 6 h:n aikana (infuusionopeus = ~ 2 mg / min ≡ 3 μmoles / min). Tämä NAD+-annos johdettiin empiirisesti, ja se vastaa yleistä annosteluohjelmaa klinikoilla (esim. Springfield Wellness Clinic, Springfield, LA, USA), jotka antavat säännöllisesti IV NAD+-infuusioita kliinisessä käytännössä. Kontrolliryhmän osallistujille annettiin suonensisäisesti normaalia keittosuolaliuosta 6 tunnin ajan.
Kliininen infuusioiden ja näytteiden keruun kliininen anto ja valvonta suoritettiin Springfield Wellness Centerissä, Springfield, LA, USA.
Verinäytteiden keruu
Verinäytteet kerättiin kaikilta osanottajilta sen jälkeen, kun he olivat olleet 12 tuntia paastossa yön yli ja ne ajoitettiin siten, että ne olivat juuri ennen infuusion aloittamista. Lisänäytteet kerättiin 30, 60, 120 (2 h), 360 (6 h) ja 480 (8 h) minuutin kuluttua infuusion aloittamisesta.
Kokonaisveri kerättiin tavallisella laskimopunktiolla (infuusiokohdan vastakkaisesta kädestä) 5 ml:n geelittömään heparinoituun putkeen. Välittömästi keräyksen jälkeen veri sentrifugoitiin 4 °C:ssa 10 minuutin ajan 1 409 × g:n voimakkuudella.
Plasma- ja punasolufraktiot erotettiin välittömästi toisistaan ja jaettiin kumpikin 5 × 500 μl:n alivoiteisiin. Kaikki alikotit pakastettiin välittömästi ja säilytettiin -80 °C:ssa analyysiin asti.
Virtsanäytteiden keruu
Keskivirtsanäytteen keräämisen jälkeen osallistujia pyydettiin tyhjentämään kaikki virtsa niille varattuihin astioihin 30 minuutin, 2 tunnin, 6 tunnin ja 8 tunnin kuluttua NAD+-infuusion aloittamisesta. Jos osallistujien oli näiden ajankohtien välillä poistettava virtsaa ajoittain, heitä pyydettiin poistamaan virtsa seuraavaan peräkkäiseen astiaan. Kaikki näytteet aliquotoitiin ja säilytettiin -80 °C:ssa välittömästi niiden vastaanottamisen jälkeen.
Analyyttinen menetelmä
NAD+:n ja siihen liittyvien aineenvaihduntatuotteiden kromatografinen erottelu ja MS-havaitseminen Nestekromatografia, joka on kytketty tandem-massaspektrometriaan (LC/MS/MS), suoritettiin käyttämällä Sciex QTRAP 5500 -massaspektrometriaa (Sciex, Redwood Cityn kaupunki, Kalifornian osavaltiopiiri, CA, Yhdysvallat, USA), kuten on jo aiemmin kuvattu (Clement et ai., 2018). Lyhyesti sanottuna 100 μL ihmisen plasmaa tai virtsaa uutettiin 400 μL jääkylmään metanoliin, sentrifugoitiin 4 °C:ssa 10 minuutin ajan ja suodatettiin 3 kDa:n kalvopatruunoiden läpi. Näyteuutteet kuivattiin tyhjiössä, palautettiin 200 μl:aan 100 mM NH4OAc-puskuria, siirrettiin 200 μl:n lasipulloihin ja suljettiin ennen LC/MS/ MS-analyysiä. Standardit ja näytteet (20 μl) injektoitiin Phenomenex NH2 -kolonniin (150 mm- 2 mm- 3 mm) aiemmin kuvatulla tavalla. Käytettiin binääriliuotingradienttia, joka koostui 5 mM NH4OAc pH 9,5:stä, joka oli korjattu ammoniakilla (liikkuva faasi A) ja asetonitriilistä (liikkuva faasi B) virtausnopeudella 250 μL/min. Alkuperäinen liuottimen koostumus injektiohetkellä oli 25 % A, jota seurasi 2 minuutin gradientti 45 %:iin A:ta ja nopea gradienttiramppi 80 %:iin A:ta (0,1 min), jota pidettiin yllä 5,9 minuutin ajan, A:ta nostettiin jälleen 95 %:iin (2 min), sitä pidettiin yllä 13 minuutin ajan ja sen jälkeen palattiin alkuolosuhteisiin (0,1 min) tasapainottamista varten, jolloin ajoaika oli yhteensä 30 minuuttia. Kolonnin virtaus ohjattiin MS-detektoriin. Yksittäisten metaboliittien kalibrointikäyrät muodostettiin käyttämällä kunkin kalibraattorin piikin pinta-alan suhdetta (metaboliitin piikin pinta-ala jaettuna valitun IS:n piikin pinta-alalla) sen konsentraation suhteen.
Sisäiset standardit koostuivat 2H2NAM:stä (NAM:n, metyyliNAM:n ja ADPR:n osalta) ja 13C5;-syklisestä AMP:stä (NMN:n ja NAD+:n osalta). On huomattava, että koska isotooppileimoja ei ole kaupallisesti saatavilla kaikille NAD-metaboliiteille, voidaan käyttää myös läheisesti sukua olevaa molekyyliä (rakenteellista analogia) (Yamada et al., 2006) edellyttäen, että sillä katsotaan olevan samanlainen stabiilisuus ja ionisaatiotehokkuus analyysin aikana. Tässä tutkimuksessa valitut sisäiset standardit on aiemmin optimoitu sukulaismetaboliitille (Bustamante ym., 2017).
Turvallisuus
Infuusiona annetun NAD+:n turvallisuutta arvioitiin maksan toimintakokeiden ja mahdollisten haittavaikutusten kliinisen havainnoinnin avulla. Maksan toimintakokeet koostuivat seerumin kokonaisbilirubiinista (bili), emäksisestä fosfataasista (ALP), alaniiniaminotransferaasista (ALT), gammaglutamyylitransferaasista (GGT), laktaattidehydrogenaasista (LD) ja aspartaattiaminotransferaasista (AST).
Statistinen analyysi
Tilastollinen analyysi suoritettiin SPSS-ohjelman versiolla 24 ja GraphPad Prismin versiolla 8 Windowsille. Painottamattomia keskiarvoja, kaksisuuntaista ANOVA-analyysia ja Bonferronin moninkertaisen vertailun post hoc -testiä käytettiin sen määrittämiseksi, erosivatko testattujen analyyttien keskimääräiset pitoisuudet toisistaan 8 tunnin jakson aikana sekä testi- ja kontrolliryhmien välillä. Wilcoxonin merkityt rivit -testiä käytettiin sen määrittämiseksi, olivatko erot maksan toimintakokeiden keskimääräisissä pitoisuuksissa merkitseviä lähtötilanteen ja 8 tunnin aikapisteiden välillä. Eroja pidettiin tilastollisesti merkitsevinä, kun p < 0.05.
Etiikka
Tämä tutkimus toteutettiin Maailman lääkäriliiton eettisten ohjeiden (Helsingin julistus) mukaisesti ihmisillä tehtävissä kokeissa. Eettinen hyväksyntä saatiin William Carey University Institutional Review Boardilta, Hattiesburg, MS (Protocol #2017-12). Kaikilta osallistujilta saatiin tietoinen suostumus.
Tulokset
Turvallisuus
Haittatapahtumia ei havaittu 6 tunnin infuusion aikana lumelääkkeellä (suolaliuos) tai testikohortilla (NAD+).
Maksan toimintaentsyymien GGT:n, LD:n ja AST:n aktiivisuuden merkittävää vähenemistä (1,3, 57, 3,6 yksikköä/l) havaittiin 8 tunnin kuluttua NAD+-infuusion aloittamisesta (taulukko 1). Lumelääkkeellä (suolaliuoksella) käsitellyissä näytteissä ei havaittu merkittävää muutosta minkään maksan toimintamerkkiaineen aktiivisuudessa 8 tunnin kohdalla, mutta näytteiden vähäinen määrä saattaa vähentää erotteluherkkyyttä. Plasman bilirubiinissa havaittiin myös merkittävää 2,75 μmol/l:n nousua. Mitään muutosta ei kuitenkaan pidetty kliinisesti merkittävänä.

TAULUKKO 1. Wilcoxonin merkityt rivit -testiä käytettiin sen määrittämiseksi, olivatko erot keskimääräisissä maksan toimintakokeiden pitoisuuksissa merkitseviä lähtötilanteen ja 8 h:n aikapisteiden välillä.
Plasma
Jatkuva NAD+-infuusio nopeudella 3 μmoolia/min johti plasman NAD+-pitoisuuksien merkitsevään (398 %:n) nousuun vain 6 h:n aikapisteessä (eli infuusion lopussa) lähtötilanteeseen nähden (p < 0,0001). Tämä erosi merkittävästi 6 h suolaliuoksella käsitellystä kontrollista (p < 0,001).
NAD+-tasot pysyivät koholla 8 h (ts, 2 h infuusion jälkeen) suhteessa lähtötilanteeseen ja suolaliuoksella käsiteltyihin kontrollinäytteisiin.
Plasman NAD+-tasot eivät muuttuneet merkittävästi lähtötilanteesta 8 h:n arviointijakson aikana suolaliuoksella käsitellyissä kontrollinäytteissä (kuva 1A).
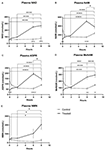
Kuva 1. Plasman nikotiiniamidiadeniinidinukleotidin (NAD+) ja metaboliittien muutokset 8 tunnin aikana . (A) NAD+, (B) nikotiiniamidi (NAM), (C) adenosiinifosforiboosi (ADPR), (D) metyylinikotiiniamidi (meNAM), (E) nikotiiniamidimononukleotidi (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, kuten ilmoitettu. Kaksisuuntaista ANOVA-analyysiä Bonferronin moninkertaisen vertailun post hoc -testillä käytettiin sen määrittämiseksi, erosivatko testattujen analyyttien keskimääräiset pitoisuudet 8 h:n aikana sekä testi- (n = 8) ja kontrolliryhmien (n = 3) välillä.
NAD+:n osalta havaittujen muutosten tapaan NAD+ -metaboliitin nikotiiniamidin (NAM) plasmapitoisuudet kasvoivat merkittävästi 409% NAD+-infuusion lopussa (ts, 6 h) lähtötilanteeseen verrattuna (p < 0,0001). Tämä oli niin ikään merkitsevästi erilainen kuin 6 h suolaliuoksella käsitellyssä kontrollissa (p < 0,001).
Ajankohtana 8 h (eli 2 h infuusion päättymisen jälkeen) NAM-pitoisuudet kontrolli- ja käsiteltyjen ryhmien välillä eivät enää eronneet merkitsevästi toisistaan (p > 0,05).
Suolaliuoksella käsiteltyjen kontrollinäytteiden NAM-pitoisuudet eivät muuttuneet merkitsevästi 8 h:n aikajakson aikana (p < 0,001) (p <
, kuva 1B).
Yhteensopivasti NAM:n osalta havaittujen muutosten kanssa NAD+-metaboliitin ADPR:n plasmapitoisuudet kasvoivat merkittävästi 393 % NAD+-infuusion lopussa (eli 6 h) suhteessa lähtötasoon (p < 0,0001). Tämä erosi merkittävästi 6 h suolaliuoksella käsitellystä kontrollista (p < 0.0001).
Ajankohtana 8 h (eli 2 h infuusion päättymisen jälkeen) ADPR-tasot pysyivät 305 % lähtötason yläpuolella (p < 0.0001). Tämä ei kuitenkaan ollut merkitsevästi suurempi kuin ADPR-tasot suolaliuoksella käsitellyissä kontrollinäytteissä samana ajankohtana (p > 0,05).
Suolaliuoksella käsiteltyjen kontrollinäytteiden ADPR-tasot eivät muuttuneet merkitsevästi 8 h:n aikajakson aikana (p > 0,05, kuva 1C).
Spearmanin korrelaatioanalyysi kahden NAD + -katabolisen aineenvaihduntatuotteen, NAM:n ja ADPR:n, ryhmien keskiarvojen välillä 8 h-aikapisteiden välillä tuotti korrelaatiokertoimen 1,00 (p < 0.001).
Seuraavasti NAM:n osalta havaittujen muutosten kanssa NAM-metaboliitin, metyylinikotiiniamidin (meNAM), plasmapitoisuudet nousivat merkittävästi 350 %:iin NAD+-infuusion lopussa (ts, 6 h) sekä lähtötilanteeseen (p < 0,0001) että 6 h suolaliuoksella käsiteltyyn kontrolliin (p < 0,01) nähden.
Ajankohtana 8 h (ts, 2 h infuusion päättymisen jälkeen) meNAM-pitoisuudet pysyivät 393 % lähtötason yläpuolella (p < 0.0001) ja olivat merkittävästi suuremmat kuin suolaliuoksella käsitellyt kontrollinäytteet samassa aikapisteessä (p < 0.05).
meNAM-tasot suolaliuoksella käsitellyissä kontrollinäytteissä eivät muuttuneet merkittävästi 8 h:n ajanjakson aikana (p > 0.05, kuva 1D).
Plasman NMN-tasot, joka on NAM:n metaboliitti anabolisten pelastusväylien kautta, olivat merkitsevästi koholla (472%) vain 8 h:n aikapisteessä (ts, 2 h infuusion päättymisen jälkeen, p < 0,05).
NMN-tasot suolaliuoksella käsitellyissä kontrollinäytteissä eivät muuttuneet merkitsevästi 8 h:n aikajaksolla (p > 0,05, kuva 1E).
Virtsa
Jatkuva NAD+:n IV-infuusio nopeudella 3 μmol/min johti merkittävään (538 %) NAD+:n erittymisnopeuden lisääntymiseen virtsaan 6 h:n aikapisteessä (ts, infuusion lopussa) suhteessa 30 minuutin kohdalla erittyneeseen määrään (p < 0,001). Tämä oli myös merkittävästi erilainen kuin suolaliuosta saaneiden kontrollien 6 tunnin kohdalla erittämä virtsan NAD+ -määrä (p < 0,05).
Virtsaan erittyvän NAD+ -määrän määrä väheni 43 % (p < 0,05) 8 tunnin kohdalla (ts, 2 h infuusion jälkeen) suhteessa huippuerittymiseen 6 h:n aikapisteessä.
NAD+:n erittymisnopeus virtsaan ei muuttunut merkittävästi 8 h:n arviointijaksolla suolaliuoksella käsitellyissä kontrollinäytteissä (kuva 2A).

Kuva 2. NAD+:n erittyminen virtsaan. Virtsan NAD+:n ja aineenvaihduntatuotteiden muutokset 8 tunnin aikana (ensimmäiset 6 tuntia koostuvat jatkuvasta, 3 μmoles/min, NAD+-infuusion infuusiosta). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, kuten ilmoitettu. Kaksisuuntaista ANOVA-analyysiä Bonferronin moninkertaisen vertailun post hoc -testillä käytettiin sen määrittämiseksi, erosivatko testattujen analyyttien keskimääräiset pitoisuudet toisistaan 8 tunnin aikana sekä testi- (n = 8) ja kontrolliryhmien (n = 3) välillä.
NAD+ -metaboliitti NAM:n erittymisnopeus ei muuttunut merkitsevästi 8 h:n testijakson aikana, eikä se eronnut havaitusta NAM:n erittymisnopeudesta suolaliuoksella käsitellyissä kontrolleissa (kuva 2B).
NAM-metaboliitti meNAM:n erittymisnopeus virtsaan lisääntyi merkitsevästi (403 %) 6 h:n aikapisteessä (ts, infuusion lopussa) verrattuna 30 minuutin kohdalla havaittuun (p < 0,01). Virtsaan erittyvän meNAM:n määrä väheni 43 % (p < 0,05) 8 tunnin kohdalla (ts, 2 h infuusion jälkeen) suhteessa huippuerittymiseen 6 h:n aikapisteessä.
MeNAM:n erittymisnopeus virtsaan ei muuttunut merkittävästi 8 h:n arviointijaksolla suolaliuosta saaneissa kontrolleissa (kuva 2C).
Keskustelu
Kasvava kiinnostus NAD+-pohjaisiin hoitoihin, mukaan lukien NAD+-infuusioihin, on korostanut, että on tarpeen ymmärtää tarkemmin NAD+:n kohtaloa ja aineenvaihduntatuotteita laskimonsisäisen annostelun jälkeen. Tässä tutkimuksessa dokumentoidaan muutokset NAD+:n ja keskeisten metaboliittien pitoisuuksissa sekä plasmassa että virtsassa 8 tunnin aikana, kun käytetään tyypillistä kliinistä annosteluohjelmaa, jossa 750 mg NAD+:aa annostellaan laskimoon 6 tunnin aikana.
Huomionarvoista on, että NAD+:n infuusio ei aiheuttanut havaittavia haittavaikutuksia koekohortissa, vaan pikemminkin vähensi maksan rasitusta indikoivien entsyymien, kuten maksansisäisen LD:n ja AST:n sekä maksan (sappiteiden) jälkeisen entsyymin GGT:n, aktiivisuutta plasmassa, mikä viittaa siihen, että sekä maksansisäisen että -jälkeisen kudoksen koskemattomuus parani jopa suhteellisen lyhyen 8 tunnin aikajakson aikana. Bilirubiinin, punasolujen hajoamistuotteen, nousu 8 tunnin kohdalla voi heijastaa joko hyvin pientä punasolujen vaihtuvuuden lisääntymistä, kuten voi tapahtua infuusion aiheuttaman hemeolyysin seurauksena, tai heikentynyttä heme-metaboliaa (taulukko 1). Koska tämän muutoksen suuruus oli kuitenkin hyvin pieni, tätä ei pidetty kliinisesti merkityksellisenä.
Kuten odotettiin, suolaliuosta saaneilla (eli kontrolli) osallistujilla NAD+:n ja metaboliittien NAM ja ADPR sekä NAM:n metaboliittien NMN ja meNAM pitoisuudet plasmassa pysyivät olennaisilta osin muuttumattomina 8 tunnin ajan. NAM:n, meNAM:n ja ADPR:n näennäinen lasku havaittiin kuitenkin 30 minuutin ja 6 tunnin välillä, mikä johtui todennäköisesti suolaliuoksen laimennusvaikutuksesta. Tämän käsityksen mukaisesti näiden analyyttien arvojen nähtiin palaavan lähtötasolle 8 tunnin kuluttua (ts, 2 h suolaliuosinfuusion päättymisen jälkeen).
NAD+-infuusion saaneilla osallistujilla plasman NAD+-pitoisuudet eivät kuitenkaan odotetusti nousseet ennen kuin 2 h:n aikapisteen jälkeen ja saavuttivat maksimissaan ~400 % lähtötason yläpuolella NAD+:n ja aineenvaihduntatuotteiden NAM:n, meNAM:n ja ADPR:n kohdalla (398 %, 409 %, 393 %) vasta 6 h:n aikapisteen kohdalla (Kuvat 1A-E). Tämä oli sisäisesti johdonmukaista sen kanssa, että sekä NAD+:n että meNAM:n virtsaan erittymisen huippu tapahtui myös 6 tunnin kohdalla ennen kuin se laski nopeasti infuusion päätyttyä (kuvat 2A-C).
NAD+ infusoitiin vakionopeudella 3 μmol/min. Näin ollen 90 μmoolia NAD+:a infusoitiin suoraan verisuonikompartimenttiin 30 minuutin välein, jolloin infuusion päättyessä 6 h:ssa infuusion kokonaismääräksi tuli 1080 μmoolia. Intravaskulaarinen sekoittuminen mistä tahansa infuusiokohdasta tapahtuu ~2 minuutissa; olettaen, että keskimääräinen veritilavuus on 5, lisätyn NAD+:n lisäys vastaisi merkittävän metabolian tai imeytymisen puuttuessa (NAD+:n) lisäyksen nousua (NAD+:n) vähintään 18 μM:n verran joka 30. minuutti infuusion 6 h:n aikana. Vaikka tämän suuruinen nousu on hyvin tämän tutkimuksen analyyttisten havaitsemisrajojen sisällä, NAD+:n tai sen metaboliittien nousua ei havaittu plasmassa tai virtsassa ennen kuin 2 tunnin kuluttua (eli 6 tunnin aikapisteessä). Tämä odottamaton havainto viittaa NAD+:n ja/tai sen metaboliittien nopeaan ja ainakin ensimmäisten 2 tunnin aikana täydelliseen kudosten imeytymiseen ja/tai aineenvaihduntaan.
Tehokasta NAD+-kataboliaa voivat saada aikaan useat entsyymit, kuten sirtuiinit (SIRTit 1-7), adenosiinidifosfaatti (ADP)-riboositransferaasit (ARTit) ja poly(ADP-riboosi)polymeraasit (PARPit 1-17) sekä sykliset ADP-riboosin (cADPR) syntaasit (CD38, CD157). Ihmisen seerumissa esiintyvät ekstrasellulaariset NAD+-pyrofosfataasit voivat myös hajottaa NAD+:n AMP:ksi ja NMN:ksi (Schmidt-Brauns ym., 2001). Solupinnan proteiini CD73 muuntaa myös NMN:ää NR:ksi, joka helposti läpäisee solukalvot mahdollista uudelleen synteesiä varten NAD+:ksi. On tärkeää, että NAD+:aa kataboloivat glykohydrolaasit CD38 ja CD157, ektonukleotidipyrofosfataasi (CD203a) ja NMN:ää kataboloiva CD73 ovat ektoentsyymejä, joita esiintyy monenlaisissa soluissa, kuten lymfaattisissa, granulosyyttisissä, neuronaalisissa ja endoteelisoluissa (Wei ym., 2014), ja myös plasman liukenevia NAD:aa hajottavia NAD:aa kataboloivia glykohydrolaaseja voi esiintyä plasman pinnalla (kuva 3; Funaro ym., 2009). Plasman NAM:n ja ADPR:n samansuuntainen nousu (korrelaatiokerroin 1,000, p < 0,001, tietoja ei ole esitetty) viittaa vahvasti siihen, että ainakin 6 h:iin mennessä NAD+:n pääasiallinen kohtalo on aineenvaihdunta pilkkomalla glykosidinen ADPriboosi-nikotiiniamidisidos NAM:ksi ja ADPR:ksi, jotka ovat NAD-glykohydrolaasiaktiivisuudelle (esim. CD38) tyypillisiä sivutuotteita. Tämä on johdonmukaista muiden antamien todisteiden kanssa, joissa erityisesti CD38:lla on osoitettu olevan ensisijainen rooli solunulkoisen NAD + -tasojen säätelyssä (Wei ym., 2014). Aikuisen ihmisen erytrosyytit ovat CD38-positiivisia ja ilmentävät runsaasti NAD+ -glykohydrolaasiaktiivisuutta, joka pilkkoo eksogeenista NAD+:a tarjotakseen erytrosyyteihin ADP-riboosia, joka voidaan ottaa tehokkaasti soluun (Kim ym., 1993; Albeniz ym., 2004). Se, että joko NAD+:n tai metaboliittien pitoisuus plasmassa tai virtsassa ei nouse ennen infuusion kahden ensimmäisen tunnin jälkeen, viittaa siihen, että NAD+ ja/tai sen metaboliitit kulkeutuvat ulos solunulkoisesta verisuonitilasta ja sekventoituvat tehokkaasti kudokseen tai ekstravaskulaarisiin kompartimentteihin NAD+:ksi ja/tai sen metaboliiteiksi tänä aikana.

KUVA3. Eksogeenisesti annetun NAD+:n mahdollinen solunulkoinen katabolia ekoentsyymien CD38 (ADP-riboosi (ADPR)-syntaasi), CD203a (NAD+-pyrofosfataasi), CD 73 (5′-nukleotidaasi), CD157-ADP-ribosyylisyklaasi 2 aktiivisuuden kautta. Lyhenteet: NAM, nikotiiniamidi; NMN, nikotiiniamidimononukleotidi; ADPR, adenosiinidifosfaattribosidi; meNAM, metyylinikotiiniamidi; 4PY, N-metyyli-4-pyridoni-3-karboksamidi; 2PY, metyyli-2-pyridoni-5-karboksamidi; ARPP, ADP-riboosipyrofosfataasi; RPPK, ribosyylipyrofosfokinaasi; NAmpt, nikotiiniamidi-fosforibosyylitransferraasi; NMNAT, nikotiiniamidi-mononukleotidiadenyylitransferaasi; CX-43, konneksiini 43.
Vaikka PARP ja sirtuiinit osallistuvat NAD+-kataboliaan, solunsisäisinä entsyymeinä, joilla on edustajia sytoplasmassa, ytimessä ja mitokondrioissa, ne eivät todennäköisesti vaikuta suoraan solunulkoiseen NAD+-tasoon. Näiden entsyymien voidaan kuitenkin olettaa reagoivan NAD+:n, NAM:n ja NR:n solunsisäisten pitoisuuksien muutoksiin, jotka voivat johtua eksogeenisesti annetusta NAD+:sta. Kuvassa 4 esitetään kaavamaisesti yhteenveto eksogeenisen NAD+:n mahdollisista kohtaloista.
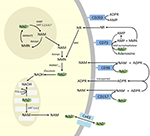
Kuva 4. Eksogeenisesti annetun NAD+:n mahdollinen solunsisäinen ja solunulkoinen kohtalo. Lyhenteet: CD38 , CD203a (NAD+-pyrofosfataasi), CD 73 (5′-nukleotidaasi). NAM, nikotiiniamidi; NMN, nikotiiniamidimononukleotidi; ADPR, adenosiinidifosfaattribosidi; meNAM, metyylinikotiiniamidi; 4PY, N-metyyli-4-pyridoni-3-karboksamidi; 2PY, metyyli-2-pyridoni-5-karboksamidi; ARPP, ADP-riboosipyrofosfataasi; RPPK, ribosyylipyrofosfokinaasi; NAmpt, nikotiiniamidi-fosforibosyylitransferraasi; NMNAT, nikotiiniamidi-mononukleotidiadenyylitransferaasi; PARP ; NRK .
Vaikka eksogeenisesti annostellun IV NAD+:n nopeaan hajoamiseen aineenvaihduntatuotteiksi on olemassa merkittävää kapasiteettia, on myös syytä huomata, että solunulkoisen NAD+:n imeytymistä voi myös tapahtua. Koska NAD+:lla on negatiivinen kokonaisvaraus, se ei pysty kulkemaan solukalvojen läpi passiivisesti, vaan se on kuljetettava aktiivisesti kalvon läpi. Tämän ovat osoittaneet useat tutkijat, jotka ovat raportoineet, että ihmisen eri solutyyppeihin annosteltu eksogeeninen NAD+ johtaa todellakin solunsisäisen NAD+:n merkittävään lisääntymiseen (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Vaikka asiaan liittyviä mekanismeja ei ole vielä täysin karakterisoitu, Alano et al. (2010) raportoivat, että eksogeeninen NAD+ voi päästä neuroneihin P2X7-portattujen kanavien kautta, ja muut ovat johdonmukaisesti havainneet NAD+:n kulkeutumista kalvojen läpi connexin 43 (CX43) -hemikanavilla, jopa niinkin alhaisilla pitoisuuksilla kuin 250 pM (Billington et al., 2008). Koska konneksiineilla on laaja levinneisyys ihmiskudoksessa ja CX43 näyttää olevan yleisin konneksiini monissa solutyypeissä, ei voida sulkea pois NAD+:n nopean imeytymisen mahdollisuutta.
NAD+:n ja aineenvaihduntatuotteiden NAM ja ADPR sekä sekundaaristen aineenvaihduntatuotteiden meNAM ja NMN soluihin imeytyminen ja/tai aineenvaihdunta näytti siis etenevän 3 μmol/min NAD+-infuusion tahdissa ainakin ensimmäiset 2 h. Joko NAD+ ja/tai testatut primaariset aineenvaihduntatuotteet sekventoituvat tehokkaasti tämän ensimmäisen 2-6 tunnin jakson aikana tai myös sekundaarisia aineenvaihduntatuotteita muodostuu. ADPR voidaan kierrättää tuottamaan NAD+:a NAM:sta (kuva 4) tai metaboloida edelleen ektoentsyymien, kuten CD203a:n (NAD+-pyrofosfataasi), välityksellä tuottamaan AMP:tä, jonka CD73 a 5′-nukleotidaasi voi edelleen metaboloida nopeasti adenosiiniksi (Bogan ja Brenner, 2010; Horenstein ym., 2016; Morandi ym., 2018). Tämän hypoteesin tueksi muut ovat tunnistaneet veren adenosiinipitoisuuden nousun solunulkoisen NAD+-infuusion seurauksena (Szczepañska-Konkel ym., 2003). NAM voi myös metaboloitua NMN:ksi pelastusreitin kautta ennen uudelleensynteesiä NAD+:ksi (kuvat 3, 4) tai maksan metyylitransferaasien vaikutuksesta tuottaa N1-metyylinikotiiniamidia, joka voi joko erittyä suoraan tai muuntua edelleen N-metyyli-2-pyridoni-5-karboksamidiksi (2PY, +99 % meNAM:sta) ja N-metyyli-4-pyridoni-3-karboksamidiksi (4PY, ~0.25 % meNAM:sta) ennen erittymistä (Shibata ja Matsuo, 1989; Okamoto et al., 2003).
On ilmeistä, että käytetyllä annosteluohjelmalla NAD+:n ja aineenvaihduntatuotteiden aineenvaihduntaan ja sitomiseen osallistuvat mekanismit ovat saavuttaneet kyllästymisen joskus 2 tunnin kuluttua, mikä johtaa plasman NAD+:n merkittävään kohoamiseen ja kaikkien testattujen aineenvaihduntatuotteiden (NMA, ADPR, meNAM ja NMN) kertymiseen 6 tunnin kuluttua. Kuten aiemmin mainittiin, nämä tiedot tukevat näkemystä, jonka mukaan yksi tärkeimmistä NAD+-metabolian reiteistä näissä olosuhteissa on glykosidisidoksen pilkkominen ektoentsyymien, kuten CD38:n, toimesta NAM:n ja ADPR:n tuottamiseksi. Plasman NMN:n nousu 2 tunnin kuluttua viittaa kuitenkin myös siihen, että solunulkoiset NAD+-pyrofosfataasit vaikuttavat todennäköisesti eksogeeniseen NAD+:aan, mikä nostaa plasman NMN:ää ja vapauttaa AMP:tä ylimääräisenä aineenvaihduntatuotteena.
Yhteenvetona voidaan todeta, että tämä tutkimus paljasti ensimmäistä kertaa, että: (a) virtausnopeudella 3 μmol/min kaikki eksogeenisesti infusoitu NAD+ poistui nopeasti ja kokonaan plasmasta ainakin ensimmäisten 2 tunnin ajan; (b) analysoitujen metabolisten biotuotteiden lisääntyminen on yhdenmukainen NAD+ -glykohydrolaasi- ja NAD+-pyrofosfataasiaktiivisuuden kanssa; ja (c) NAD+ -infuusiosta syntyviin virtsaan erittyviin erittymistuotteisiin kuuluu natiivia NAD+:a ja meNAM:ia, mutta ei NMN:a.
Vaikka tämän tutkimuksen havainnot ovat uusia ja edistävät jonkin verran käsitystämme eksogeenisen NAD+:n ajoitetusta kohtalosta ihmisessä, havaittiin rajoituksia. Metabolisen kokonaislaskennan parantamiseksi tulevissa tutkimuksissa olisi tutkittava punasolujen NAD+:n ja metaboliittien muutoksia sekä sekundaaristen meNAM-metaboliittien, 2PY:n ja 4PY:n, erittymistä virtsaan. Lisäksi on todennäköisesti hyödyllistä arvioida eksogeenisen NAD+:n vaikutusta puriinimetabolian muutoksiin, mihin tulisi sisältyä ainakin plasman ja punasolujen AMP:n ja adenosiinin arviointi. Eläinmallien käyttö voi myös auttaa selvittämään eri metaboliareittien suhteellista osallisuutta käyttämällä sopivia farmakologisia inhibiittoreita ja ottamalla kudosnäytteitä.
Johtopäätöksenä voidaan todeta, että tässä tutkimuksessa pystyttiin ensimmäistä kertaa paljastamaan joitakin erittäin hyödyllisiä, aiemmin tuntemattomia tietoja eksogeenisen IV NAD+:n kohtalosta ihmisillä, mukaan lukien IV NAD+ -infuusion yleinen turvallisuus ja siedettävyys nopeudella 3 μmol/min, NAD+:n nopea sitoutuminen plasmasta, sekä NAD+-glykohydrolaasi- että NAD+-pyrofosfaattiaktiivisuuden todennäköinen osuus NAD+:n metaboliassa ja NAM:n ilmeisen tehokas munuaistubulaarinen reabsorptio. Tarvitaan kuitenkin lisätutkimuksia, jotta tämän tärkeän molekyylin monimutkainen metabolinen kohtalo saadaan täysin selville. Lisäksi näiden muutosten karakterisointi auttaa edistämään NAD+-pohjaisten hoitomuotojen kehittämistä ja parantamista sairauksiin, jotka todennäköisesti hyötyvät NAD+:n lisääntyneestä saatavuudesta, mukaan lukien tilat, jotka edellyttävät lisääntynyttä solujen uudistumista ja korjautumista, kuten Alzheimerin tauti ja muut neurodegeneratiiviset dementiat.
Tietojen saatavuus
Tässä tutkimuksessa tuotetut tietokokonaisuudet ovat saatavissa pyynnöstä vastaavalta kirjoittajalta.
Eettiset periaatteet
Tutkimukset, joihin liittyy ihmisosallistujia, tarkistettiin ja hyväksyttiin William Carey University Institutional Review Boardissa, Hattiesburgissa, MS:ssä (Protocol #2017-12). Potilaat/osallistujat antoivat kirjallisen tietoon perustuvan suostumuksensa osallistua tähän tutkimukseen.
Author Contributions
RG osallistui tutkimuksen suunnitteluun ja valvontaan, kriittiseen keskusteluun ja käsikirjoituksen kirjoittamiseen. JBer osallistui tutkimuksen suunnitteluun, kriittiseen keskusteluun, tiedonkeruuseen, tilastolliseen analyysiin, käsikirjoituksen laatimiseen ja käsikirjoituksen tarkastamiseen. RM osallistui tutkimuksen suunnitteluun, kriittiseen keskusteluun, kliiniseen valvontaan ja käsikirjoituksen tarkistukseen. NB osallistui biokemialliseen analyysiin ja käsikirjoituksen tarkistukseen. JW osallistui tutkimuksen suunnitteluun, kriittiseen keskusteluun ja käsikirjoituksen tarkistukseen. JBen osallistui tiedonkeruuseen ja käsikirjoituksen tarkistamiseen. SB osallistui tutkimuksen suunnitteluun ja käsikirjoituksen tarkistamiseen. Kaikki kirjoittajat ovat tarkastaneet, lukeneet ja hyväksyneet käsikirjoituksen lopullisen version ja ovat samaa mieltä kirjoittajien esitysjärjestyksestä.
Rahoitus
Tämän tutkimuksen rahoitti yhdessä NAD+ Research Inc, (LA, USA) ja Australasian Research Institute Incorporation (Sydney, Australia), ja se suoritettiin Springfield Wellness Centerissä, Springfieldissä, LA:ssa, USA:ssa.
Erittely eturistiriidoista
RM on NAD+ Research Inc:n johtaja ja Springfield Wellness Centerin lääketieteellinen johtaja, joka käyttää NAD:n infuusiohoitoa kliinisenä hoitona. SB on saanut konsulttipalkkioita NAD+ Research Inc:ltä.
Muut kirjoittajat ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Haluamme kiittää Archway Apothecary Pty Limitediä, LA, USA, IV NAD+:n maksuttomasta toimittamisesta tätä hanketta varten.
Abeti, R., ja Duchen, M. R. (2012). PARP:n aktivoituminen β-amyloidin aiheuttaman oksidatiivisen stressin vaikutuksesta: vaikutukset Alzheimerin tautiin. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Avoin, satunnaistamaton tutkimus nikotiiniamidiribosidin (NR) ravintolisän farmakokinetiikasta ja sen vaikutuksista veren NAD+-tasoihin terveillä vapaaehtoisilla. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M. ja Swanson, R. A. (2010). NAD+:n ehtyminen on välttämätöntä ja riittävää PARP-1-välitteisen hermosolukuoleman kannalta. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R. ja Bermek, E. (2004). NAD-glykohydrolaasiaktiivisuus ja adp-riboosin otto normaalien henkilöiden ja syöpäpotilaiden erytrosyyteissä. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B. C. B., Grolla, A. A., et al. (2008). NAD+:n oton karakterisointi nisäkässoluissa. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., ja Brenner, C. (2010). 5′-nukleotidaasit ja niiden uudet roolit NAD+- ja fosfaattiaineenvaihdunnassa. New J. Chem. 34, 845-853. doi: 10.1039/b9njj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A. ja Grant, R. (2011). Ikään liittyvät muutokset NAD + -metabolian oksidatiivisessa stressissä ja sirt1-aktiivisuudessa wistar-rotilla. PLoS One 6:e19194. doi: 10.1371/journal.pone.001919194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). NAD+-aineenvaihdunnan kartoitus vanhenevien Wistar-rottien aivoissa: mahdolliset kohteet aivojen vanhenemiseen vaikuttamiseksi. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Solujen NAD+-metabolomin kvantifiointi tandem-nestekromatografian massaspektrometriamenetelmällä. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). Plasman NAD + -metabloomi on häiriintynyt ”normaalissa” ikääntymisessä. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Endoteelin NAD+-puutteen rooli ikään liittyvässä verisuonten toimintahäiriössä. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A. ja Milbrandt, J. (2017). SARM1-tulli/interleukiini-1-reseptoridomeenilla on luontainen NAD+-hajautusaktiivisuus, joka edistää patologista aksonidegeneraatiota. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M. ja Chiarugi, A. (2013). NMNAT3:n molekulaaristen ja toiminnallisten ominaisuuksien tarkastelu paljastaa uusia vihjeitä NAD-homeostaasista ihmisen mitokondrioissa. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ektoentsyymit ja synnynnäinen immuniteetti: ihmisen CD157:n rooli leukosyyttien liikenteessä. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). Pellagran etiologia: eräiden epidemiologisten havaintojen merkitys siihen nähden. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Muutokset oksidatiivisissa vaurioissa, tulehduksessa ja iän myötä aivo-selkäydinnesteessä. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). CD38-välitteisen reitin kautta luuytimen kapeikossa syntyvä adenosiini korreloi ihmisen myelooman etenemisen kanssa. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R. ja An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). Nikotiiniamidi-mononukleotidin vaikutus aivojen mitokondrioiden hengitysvajauksiin Alzheimerin taudin kannalta merkityksellisessä hiirimallissa. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Ikään liittyvät muutokset hapetusstressissä ja NAD+-aineenvaihdunnassa ihmisen kudoksissa. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Riippuvuus sielun pimeä yö, NAD + toivon valo. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Nikotiiniamidi-mononukleotidin pitkäaikainen anto lieventää ikään liittyvää fysiologista heikkenemistä hiirillä. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R. ja Malavasi, F. (2018). Solunulkoisen adenosiinin synnyn rooli autoimmuunisairauksien kehittymisessä. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN huumeriippuvuuksien ehkäisyssä, diagnosoinnissa ja hoidossa. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Vuorokausivaihtelut ihmisen nikotiiniamidikataboliittien erittymisessä virtsaan: stressin vaikutukset nikotiiniamidin metaboliaan. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S. ja Gupta, M. P. (2005). Poly(ADP-riboosi)polymeraasi-1-riippuvainen sydämen sydänlihassolujen solukuolema sydämen vajaatoiminnan aikana välittyy NAD+:n köyhtymisen ja vähentyneen Sir2α-deasetylaasiaktiivisuuden kautta. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Eksogeenisen NAD:n farmakologiset vaikutukset mitokondrioiden bioenergetiikkaan, DNA:n korjaukseen ja apoptoosiin. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S. ja Reidl, J. (2001). Onko NAD-pyrofosfataasiaktiivisuus välttämätön Haemophilus influenzae tyyppi b:n lisääntymiselle verenkierrossa? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., ja Matsuo, H. (1989). Niasiiniekvivalentin saannin ja sen metaboliittien, N’-metyylinikotiiniamidin, N’-metyyli-2-pyridoni-5-karboksamidin ja N’-metyyli-4-pyridoni-3-karboksamidin, virtsaan erittymisen välinen korrelaatio ihmisillä, jotka nauttivat itse valittua ruokaa. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Oksidatiivisen stressin signalointi Alzheimerin taudissa. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M. ja Angielski, S. (2003). Munuaisten hemodynamiikka ja natriureettiset vasteet diadenosiinitetrafosfaatin (ap4a) ja nikotiiniamidiadeniinidinukleotidin (NAD) laskimonsisäiseen antoon rotalla. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R. ja Yue, J. (2014). CD38/syklisen adenosiinidifosfaattiriboosin/Ca2+-signalointireitin roolit ja mekanismit. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H. ja Yan, L. J. (2016). NADH / NAD + -redox-epätasapainon lähteet ja vaikutukset diabeteksessa ja sen komplikaatioissa. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H. ja Tsuchiya, M. (2006). Nikotiiniamidiadeniinidinukleotidin ja siihen liittyvien yhdisteiden samanaikainen mittaus nestekromatografia/elektrospray-ionisaatio tandem-massaspektrometrialla. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). NAD+:n, PARP-1:n ja sirtuiinien roolit solukuolemassa, iskeemisessä aivovauriossa ja synkrotronisäteilyn röntgensäteilyn aiheuttamassa kudosvauriossa. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., ja Swanson, R. A. (2003). NAD+-täydennys estää PARP-1:n aiheuttaman glykolyyttisen eston ja solukuoleman viljellyissä hiiren astrosyyteissä. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Oksidatiivinen stressi ja NAD + iskeemisessä aivovammassa: nykyiset edistysaskeleet ja tulevaisuuden näkymät. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). NAD + -välituotteet: NMN: n ja NR: n biologia ja terapeuttinen potentiaali. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J. ja Imai, S. (2011). Nikotiiniamidi-mononukleotidi, keskeinen NAD + -väliaine, hoitaa ruokavalion ja iän aiheuttaman diabeteksen patofysiologiaa hiirissä. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., ym. et al. (2015). Väärinmuodostuneen prioniproteiinin aiheuttama hermosolukuolema johtuu NAD+:n ehtymisestä ja sitä voidaan lievittää in vitro ja in vivo NAD+:n täydentämisellä. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., ja Ying, W. (2005). NADH voi päästä astrosyytteihin estämään PARP-1-välitteisen astrosyyttikuoleman. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., ja Perry, G. (2007). Hapetusstressin syyt Alzheimerin taudissa. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar