- Introduction
- Materialen en Methoden
- Deelnemers
- Dieetstandaardisatie
- Infusieprotocol
- Bloedmonsterafname
- Urine Sample Collection
- Analytische methode
- Veiligheid
- Statistische analyse
- Ethiek
- Resultaten
- Veiligheid
- Plasma
- Urine
- Discussie
- Beschikbaarheid van gegevens
- Ethische verklaring
- Bijdragen van auteurs
- Funding
- Conflict of Interest Statement
- Acknowledgments
Introduction
De pyridine nucleotide, nicotinamide adenine dinucleotide (NAD+) is aanwezig in alle cellen van het lichaam en is essentieel voor de levensvatbaarheid en functie van de cellen.
Als cofactor verantwoordelijk voor het elektronentransport in de ademhalingsketen, staan NAD+ en zijn redoxkoppel NADH centraal bij de productie van energie (ATP) in de mitochondriën via oxidatieve fosforylering. De gefosforyleerde metaboliet van NAD+, NADP+ met zijn redoxkoppel NADPH, levert ook het reducerend vermogen om een aantal anabole reacties aan te drijven, waaronder de synthese van cholesterol en nucleïnezuren, de verlenging van vetzuren en de regeneratie van glutathion (GSH), een van de belangrijkste antioxidanten van het lichaam. In totaal draagt deze familie van pyridinenucleotiden bij tot de redox-uitwisseling van meer dan 400 enzymreacties. Belangrijk is dat NAD+ niet wordt verbruikt wanneer het als redox-paar fungeert. NAD+ dient echter ook als substraat voor een aantal andere belangrijke stofwisselingsprocessen en wordt derhalve verbruikt als gevolg van hun chemische reacties, waardoor het weefsel mogelijk van NAD+ wordt beroofd. Tot dit aantal behoren reacties die worden aangestuurd door de poly-adenosine-fosforibose-ribose (ADPR)-familie van enzymen (PARP 1-17) die DNA-reparatie en nucleaire stabiliteit regelen, epigenetische controle-enzymen (Sirt1-7), intercellulaire immuuncommunicatie (CD38/CD157) en neuronale regeneratie (SARM1; Essuman et al., 2017). Het potentieel bestaat daarom voor de verstoring van het cellulaire metabolisme op meerdere niveaus in omstandigheden waarin het NAD+ verbruik door deze enzymen groter is dan de NAD+ toevoer of synthese.
Het klinische belang van het op peil houden van cellulaire NAD+ niveaus werd vroeg in de vorige eeuw vastgesteld met de bevinding dat pellagra, een ziekte die werd gekenmerkt door diarree, dermatitis, dementie en de dood, kon worden genezen met voedingsmiddelen die de NAD+ precursor niacine bevatten (ook bekend als vitamine B3; Goldberger, 1914). Hoewel pellagra zeldzaam is in ontwikkelde landen, is aangetoond dat cellulaire concentraties van NAD+ afnemen onder omstandigheden van verhoogde oxidatieve schade zoals die optreden bij veroudering (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Veranderde niveaus van NAD+ blijken gepaard te gaan met verschillende aandoeningen die geassocieerd worden met verhoogde oxidatieve/vrije radicalenschade, waaronder diabetes (Wu et al., 2016), hartaandoeningen (Pillai et al., 2005), leeftijdsgebonden vasculaire dysfunctie (Csiszar et al., 2019), ischemisch hersenletsel (Ying en Xiong, 2010), verkeerd gevouwen neuronale eiwitten (Zhou et al., 2015) en Alzheimer dementie (Abeti en Duchen, 2012).
Naast de pathologische kenmerken van Aβ-plaques en neurofibrillaire tau-tangles, is oxidatieve schade een consistente bevinding bij de ziekte van Alzheimer en wordt algemeen erkend als een vroege gebeurtenis in het pathogene proces, zelfs voorafgaand aan Aβ-afzetting (Su et al., 2008). Hoewel de reactieve zuurstofspecies (ROS) die deze schade veroorzaken waarschijnlijk afkomstig zijn van meerdere bronnen, wordt gedacht dat disfunctionele mitochondriën en de beschikbaarheid van redox-actieve metalen zoals Fe++ en Cu+ een dominante rol spelen (Zhua et al., 2007).
Een belangrijk gevolg van cellulaire oxidatieve stress, in de hersenen en elders, zijn enkel- of dubbelstrengs breuken in het DNA. In reactie op DNA-schade hydrolyseert PARP1 NAD+ om polymeren van ADP-ribose te produceren (Ying, 2013). We hebben eerder aangetoond dat NAD+ niveaus omgekeerd gecorreleerd zijn met metingen van oxidatieve stress in menselijk weefsel (Massudi et al., 2012) en in de hersenen van ratten (Braidy et al., 2014). Terwijl verminderde NAD+ niveaus in de hersenen van levende Alzheimerpatiënten nog moeten worden bevestigd door niet-invasieve technieken, ondersteunen de consistente bevindingen van oxidatieve schade in de post mortem hersenen dus sterk het standpunt dat versnelde NAD+ omzet en depletie bijdragen aan de neurologische disfunctie bij deze ziekte. Aangezien interventies gericht op het herstellen van NAD+ zijn aangetoond in diermodellen om gezond ouder worden te ondersteunen en de metabolische functie te verbeteren (Yoshino et al., 2011; Mills et al., 2016) en dementie (Long et al., 2015), worden strategieën om NAD+ niveaus in de mens te verhogen actief onderzocht.
De meest directe methode om NAD+ niveaus te verhogen is door intraveneuze (IV) toediening. Hoewel de gegevens uit experimenteel onderzoek minimaal zijn, is het significante klinische voordeel van IV NAD+ infusie bij alcoholontwenning eerder gemeld (O’Holleran, 1961; Mestayer, 2019). Verrassend genoeg, terwijl de orale toediening van NAD+ precursoren zoals nicotinamide riboside (NR) of nicotinamide mononucleotide (NMN) enthousiast worden onderzocht voor hun impact op NAD+ niveaus (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), zijn de metabole lotgevallen en farmacokinetische eigenschappen van IV NAD+ toediening nog niet gerapporteerd bij mensen. Deze studie presenteert daarom voor het eerst de veranderingen in concentraties van NAD+ en zijn metabolieten tijdens een IV-infusie van NAD+ in een cohort van gezonde mannelijke deelnemers.
Materialen en Methoden
Deelnemers
Elf (Test n = 8, Controle n = 3) mannelijke deelnemers in de leeftijd van 30-55 jaar werden gerekruteerd via advertenties op radio, tv en sociale media verkooppunten. Alle deelnemers hadden een BMI van minder dan 30 kg/m2 (gemiddelde BMI van de test = 27,5 ± 2,5 kg/m2; gemiddelde BMI van de controle = 24,6 ± 6,5 kg/m2), waren niet diabetisch, rookten minder dan 1 sigaret en consumeerden minder dan 2 standaard alcoholische dranken per dag. Personen die lipidenverlagende of ontstekingsremmende medicijnen gebruikten, een voorgeschiedenis van lever- of nierfalen hadden of recentelijk een microbiële infectie, trauma of andere significante of onbehandelde medische aandoeningen hadden doorgemaakt, werden uitgesloten van het onderzoek. De proefpersonen ontvingen een geldelijke vergoeding voor hun tijd en deelname, ongeacht of ze het experiment afmaakten. Deelnemers mochten geen natuurlijke gezondheidsproducten gebruiken die NAD+, NR of Nicotinamide bevatten binnen 14 dagen voor en tijdens de studie.
Dieetstandaardisatie
Op de dag voorafgaand aan de NAD+ IV-infuus gebruikten de deelnemers een identiek niacine-gereduceerd dieet en dronken ze alleen water.
Op de dag van de studie werd geen voedsel geconsumeerd tot na de laatste 8-uurs bloed-/urinestaal was verzameld. Deelnemers werden aangemoedigd om water te drinken om normaal gehydrateerd te blijven. Andere soorten dranken waren niet toegestaan.
Om ervoor te zorgen dat de deelnemers tijdens de 6 uur durende infusie voldoende energie innemen, bevatte de IV-oplossing ook 0,1% dextrose, wat ongeveer 2.000 calorieën leverde gedurende de 6 uur durende infusieperiode.
Infusieprotocol
Deelnemers werden gerandomiseerd naar ofwel de Test- (n = 8) of de Controlegroep (n = 3). Deelnemers in de Test groep kregen intraveneus 750 mg NAD+ toegediend in normale zoutoplossing (Archway Apothecary, Covington, LA, USA) over een periode van 6 uur (infusiesnelheid = ~2 mg/min ≡ 3 μmoles/min). Deze dosering van NAD+ werd empirisch afgeleid en weerspiegelt een gebruikelijk doseringsschema in klinieken (bv. Springfield Wellness Clinic, Springfield, LA, VS) die regelmatig IV NAD+ infusies geven in de klinische praktijk. Deelnemers in de controlegroep kregen intraveneus normale zoutoplossing toegediend over een periode van 6 uur.
De klinische toediening en supervisie van de IV infusies en monsterafname werden uitgevoerd in het Springfield Wellness Center, Springfield, LA, USA.
Bloedmonsterafname
Basislijn (TO) bloedmonsters werden afgenomen bij alle deelnemers na een vastenkuur van 12 uur ’s nachts, getimed om onmiddellijk voor de start van het infuus te gebeuren. Aanvullende monsters werden vervolgens verzameld op 30, 60, 120 (2 uur), 360 (6 uur) en 480 (8 uur) minuten na het begin van het infuus.
Het bloed werd verzameld via een standaard venepunctie (tegenovergestelde arm van de infusieplaats) in een 5 ml niet-gel heparinized buisje. Onmiddellijk na de verzameling werd het bloed gecentrifugeerd bij 4 ° C gedurende 10 minuten bij 1.409× g.
De plasma en rode bloedcellen fracties werden onmiddellijk gescheiden en verdeeld in 5 × 500 pi aliquots elk. Alle aliquots werden vervolgens onmiddellijk bevroren en opgeslagen bij -80 ° C tot analyse.
Urine Sample Collection
Na het verzamelen van een baseline midstream urinemonster, werden de deelnemers gevraagd om alle urine te lozen in de daarvoor bestemde recipiënt(en) op 30 min, 2 uur, 6 uur en 8 uur na het begin van de NAD + infusie. Als deelnemers tussen deze tijdstippen met tussenpozen urine moesten plassen, werd hen gevraagd dit in het volgende bakje te doen. Alle monsters werden onmiddellijk na ontvangst aliquoted en opgeslagen bij -80°C.
Analytische methode
Chromatografische scheiding van NAD+ en gerelateerde metabolieten en MS-detectie Vloeibare chromatografie gekoppeld aan tandem massaspectrometrie (LC/MS/MS) werd uitgevoerd met behulp van een Sciex QTRAP 5500 massaspectrometer (Sciex, Redwood City, CA, VS) zoals eerder beschreven (Clement et al., 2018). Kort gezegd werd 100 μl menselijk plasma of urine geëxtraheerd in 400 μl ijskoude methanol, gedurende 10 min gecentrifugeerd bij 4°C en gefiltreerd door 3 kDa membraanpatronen. Monsterextracten werden gedroogd onder vacuüm, gereconstitueerd in 200 pi van 100 mM NH4OAc buffer en overgebracht in 200 pi glazen flesjes en afgedekt vóór LC / MS / MS-analyse. Standaarden en monsters (20 pi) werden geïnjecteerd op een Phenomenex NH2-kolom (150 mm-2 mm-3 mm), zoals eerder beschreven. Er werd gebruik gemaakt van een binaire gradiënt van 5 mM NH4OAc pH 9,5, aangepast met ammoniak (mobiele fase A) en acetonitril (mobiele fase B) met een debiet van 250 μL/min. De initiële samenstelling van het oplosmiddel bij injectie was 25% A, gevolgd door een 2-minuten gradiënt tot 45% A en een snelle gradiënt helling tot 80% A (0,1 min), die werd gehandhaafd gedurende 5,9 min, A werd weer verhoogd tot 95% (2 min), gehouden gedurende 13 min, en vervolgens terug te keren naar de oorspronkelijke omstandigheden (0,1 min) voor evenwicht, met een totale looptijd van 30 min. De kolomstroom werd naar de MS-detector geleid. De kalibratiecurven van de afzonderlijke metabolieten werden geconstrueerd aan de hand van de piekgebiedsverhoudingen (piekgebied van de metaboliet gedeeld door het piekgebied van de geselecteerde IS) van elke kalibrator tegen de concentratie ervan.
Interne standaarden bestonden uit 2H2NAM (voor NAM, methylNAM en ADPR) en 13C5;-Cyclic AMP (voor NMN en NAD+). Aangezien niet voor alle NAD-metabolieten isotopenlabels in de handel verkrijgbaar zijn, kan ook een nauw verwante molecule (structureel analoog) worden gebruikt (Yamada et al., 2006), op voorwaarde dat deze tijdens de analyse even stabiel en ionisatie-efficiënt wordt geacht. De in deze studie geselecteerde interne standaarden zijn eerder geoptimaliseerd voor de verwante metaboliet (Bustamante et al., 2017).
Veiligheid
De veiligheid van IV NAD+ werd beoordeeld aan de hand van leverfunctietests en klinische observatie van eventuele ongewenste voorvallen. Leverfunctietests bestonden uit serum, totaal bilirubine (bili), alkalische fosfatase (ALP), alanine aminotransferase (ALT), gamma glutamyl transferase (GGT), lactaat dehydrogenase (LD) en aspartaat aminotransferase (AST).
Statistische analyse
Statistische analyse werd voltooid met behulp van SPSS versie 24 en GraphPad Prism versie 8 voor windows. Een ongewogen gemiddelde, twee-weg ANOVA met Bonferroni’s meervoudige vergelijking post hoc test werd gebruikt om te bepalen of de gemiddelde concentratie voor de geteste analisten verschillend was over de periode van 8 uur en tussen Test- en Controlegroepen. De Wilcoxon Signed Ranks test werd gebruikt om te bepalen of verschillen in gemiddelde leverfunctietestconcentraties significant waren tussen de basislijn en de 8-uurs tijdstippen. Verschillen werden als statistisch significant beschouwd wanneer p < 0,05.
Ethiek
Deze studie werd uitgevoerd in overeenstemming met de Code of Ethics van de World Medical Association (Verklaring van Helsinki) voor experimenten met mensen. Ethische goedkeuring werd verkregen van de William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). Van alle deelnemers werd geïnformeerde toestemming verkregen.
Resultaten
Veiligheid
Er werden geen ongewenste voorvallen waargenomen tijdens de 6 uur durende infusie met placebo (zoutoplossing) of test (NAD+) cohorten.
Een significante daling in activiteit (1,3, 57, 3,6 eenheden/L) voor de leverfunctie-enzymen GGT, LD en AST, respectievelijk, werd waargenomen om 8 uur na aanvang van de NAD+ infusie (tabel 1). Bij de met placebo (zoutoplossing) behandelde monsters was na 8 uur geen significante verandering in de activiteit voor enige leverfunctiemarker zichtbaar, hoewel het lage aantal monsters de gevoeligheid voor discriminatie kan verminderen. Er werd ook een significante stijging van 2,75 μmoles/L in plasma bilirubine waargenomen. Geen van de veranderingen werd echter als klinisch significant beschouwd.

Tabel 1. De Wilcoxon Signed Ranks test werd gebruikt om te bepalen of verschillen in de gemiddelde leverfunctietestconcentraties significant waren tussen de basislijn en de 8-uurs tijdstippen.
Plasma
Een continue infusie van NAD+ met een snelheid van 3 μmol/min resulteerde alleen op het 6-uurs tijdstip (d.w.z. het einde van de infusie) in een significante (398%) stijging van de plasma NAD+ niveaus ten opzichte van de basislijn (p < 0,0001). Dit was significant verschillend van de 6 uur met zout behandelde controle (p < 0.001).
NAD+ niveaus bleven verhoogd bij 8 uur (d.w.z., 2 uur na de infusie) ten opzichte van de uitgangswaarde en de met zoutoplossing behandelde controlemonsters.
Plasma NAD+ niveaus veranderden niet significant ten opzichte van de uitgangswaarde gedurende de beoordelingsperiode van 8 uur in met zoutoplossing behandelde controlemonsters (figuur 1A).
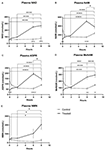
Figuur 1. Veranderingen in plasma nicotinamide adenine dinucleotide (NAD+) en metabolieten gedurende 8 uur. (A) NAD+, (B) nicotinamide (NAM), (C) adenosine fosforibose (ADPR), (D) methyl nicotinamide (meNAM), (E) nicotinamide mononucleotide (NMN). *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, zoals aangegeven. Tweeweg ANOVA met Bonferroni’s meervoudige vergelijking post hoc test werd gebruikt om te bepalen of de gemiddelde concentratie voor de geteste analisten verschillend waren over de 8 uur periode en tussen Test (n = 8) en Controle (n = 3) groepen.
Gelijkaardig aan de veranderingen waargenomen voor NAD+, stegen de plasma niveaus van de NAD+ metaboliet nicotinamide (NAM) significant met 409% aan het einde van de NAD+ infusie (i.e., 6 uur) ten opzichte van de uitgangswaarde (p < 0,0001). Dit was eveneens significant verschillend van de 6 uur met zoutoplossing behandelde controle (p < 0,001).
Op het 8 uur tijdstip (d.w.z. 2 uur na het einde van de infusie), waren de NAM-niveaus tussen de controle- en behandelde groepen niet langer significant verschillend (p > 0,05).
NAM-niveaus voor met zoutoplossing behandelde controlemonsters veranderden niet significant gedurende de 8 uur tijdsperiode (p > 0,05, figuur 1B).
In overeenstemming met de veranderingen die werden waargenomen voor NAM, stegen de plasmaniveaus van de NAD+ metaboliet ADPR aanzienlijk met 393% aan het einde van de NAD+ infusie (d.w.z. 6 uur) ten opzichte van de uitgangswaarde (p < 0,0001). Dit was significant verschillend van de 6 uur met zoutoplossing behandelde controle (p < 0,0001).
Op het 8 uur tijdstip (d.w.z. 2 uur na het einde van de infusie), bleven de ADPR niveaus 305% boven de uitgangswaarde (p < 0,0001). Dit was echter niet significant hoger dan ADPR niveaus in de met zoutoplossing behandelde controlemonsters op hetzelfde tijdstip (p > 0,05).
ADPR niveaus voor met zoutoplossing behandelde controlemonsters veranderden niet significant gedurende de 8 uur tijdsperiode (p > 0,05, figuur 1C).
Een Spearman’s correlatieanalyse tussen groepsgemiddelden over de 8 uur tijdstippen voor de twee NAD+ katabole metabolieten, NAM en ADPR, leverde een correlatiecoëfficiënt van 1,00 op (p < 0.001).
Opnieuw, consistent met de veranderingen waargenomen voor NAM, stegen de plasmaspiegels van de NAM-metaboliet, methyl-nicotinamide (meNAM) aanzienlijk tot 350% aan het einde van de NAD+ infusie (d.w.z, 6 uur) ten opzichte van zowel de basislijn (p < 0,0001) als de 6 uur met zoutoplossing behandelde controle (p < 0,01).
Op het 8 uur tijdstip (d.w.z., 2 uur na het einde van de infusie) bleven de meNAM-niveaus 393% boven de basislijn (p < 0,0001) en significant hoger dan de met zoutoplossing behandelde controlemonsters op hetzelfde tijdstip (p < 0,05).
meNAM-niveaus voor met zoutoplossing behandelde controlemonsters veranderden niet significant gedurende de 8-uurs tijdsperiode (p > 0,05, figuur 1D).
Plasmaspiegels van NMN, een metaboliet van NAM via de anabole salvage-route, was significant verhoogd (472%) alleen op het 8-uurs tijdspunt (d.w.z, 2 uur na het einde van de infusie, p < 0.05).
NMN-niveaus voor met zoutoplossing behandelde controlemonsters veranderden niet significant gedurende de 8 uur tijdsperiode (p > 0.05, figuur 1E).
Urine
De continue IV-infusie van NAD+ met een snelheid van 3 μmoles/min resulteerde in een significante (538%) toename van de uitscheidingsgraad van NAD+ in de urine op het tijdstip van 6 uur (d.w.z, einde van de infusie) ten opzichte van de uitscheiding bij 30 min (p < 0,001). Dit was ook significant verschillend van de hoeveelheid urine NAD+ die op 6 uur werd uitgescheiden door de met zoutoplossing behandelde controles (p < 0,05).
De hoeveelheid NAD+ die in de urine werd uitgescheiden daalde met 43% (p < 0,05) op 8 uur (d.w.z., 2 uur na de infusie) ten opzichte van de piekuitscheiding op het tijdstip van 6 uur.
De uitscheidingsgraad van NAD+ in de urine veranderde niet significant gedurende de beoordelingsperiode van 8 uur in met zoutoplossing behandelde controlemonsters (figuur 2A).

Figuur 2. Veranderingen in urine NAD+ en metabolieten gedurende 8 uur (eerste 6 uur bestaande uit een continue, 3 μmol/min, NAD+ IV-infuus). (A) NAD+, (B) NAM, (C) meNAM. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, zoals aangegeven. Tweeweg ANOVA met Bonferroni’s meervoudige vergelijking post hoc test werd gebruikt om te bepalen of de gemiddelde concentratie voor de geteste analisten verschillend waren over de periode van 8 uur en tussen Test (n = 8) en Controle (n = 3) groepen.
De uitscheidingssnelheid van de NAD+-metaboliet NAM veranderde niet significant gedurende de 8-uurs testperiode en verschilde niet van de waargenomen NAM-uitscheidingssnelheid voor de met zoutoplossing behandelde controles (Figuur 2B).
De uitscheidingssnelheid van de NAM-metaboliet meNAM in de urine was significant verhoogd (403%) op het tijdstip 6 uur (d.w.z, einde van de infusie) ten opzichte van die waargenomen bij 30 min (p < 0,01). De hoeveelheid meNAM die in de urine werd uitgescheiden, daalde met 43% (p < 0,05) bij 8 uur (d.w.z, 2 uur na de infusie) ten opzichte van de piekuitscheiding op het tijdstip van 6 uur.
De uitscheidingsgraad van meNAM in de urine veranderde niet significant gedurende de beoordelingsperiode van 8 uur bij met zoutoplossing behandelde controles (Figuur 2C).
Discussie
Een groeiende belangstelling voor op NAD+ gebaseerde therapieën, waaronder NAD+ infusies, heeft de behoefte aan een duidelijker begrip van het lot van NAD+ en zijn metabolieten na IV toediening aan het licht gebracht. De huidige studie documenteert veranderingen in niveaus van NAD+ en belangrijke metabolieten in zowel plasma als urine gedurende 8 uur bij gebruik van een typisch klinisch doseringsschema van 750 mg NAD+, IV toegediend over een periode van 6 uur.
Zoals verwacht bleven bij met zout behandelde (d.w.z. controle) deelnemers de plasmaspiegels van NAD+ en de metabolieten NAM en ADPR en de NAM-metabolieten, NMN en meNAM in wezen onveranderd gedurende de 8-uurs periode. Er werd echter een duidelijke afname van NAM, meNAM en ADPR waargenomen tussen 30 min en 6 h, waarschijnlijk als gevolg van een zoutverdunningseffect. In overeenstemming met dit idee waren de waarden voor deze analyten na 8 uur weer terug op de uitgangswaarden (d.w.z,
Onverwacht echter bij deelnemers die NAD+ toegediend kregen, stegen de plasma NAD+ niveaus niet tot na het 2 uur tijdstip en bereikten een maximum van ~400% boven de basislijn voor NAD+ en metabolieten NAM, meNAM en ADPR (respectievelijk 398%, 409%, 393%) pas op het 6 uur tijdstip (Figuren 1A-E). Dit was intern consistent met de piek van de urinaire uitscheiding voor zowel NAD+ als meNAM die ook om 6 uur optrad alvorens snel af te nemen na het einde van de infusie (figuren 2A-C).
NAD+ werd toegediend met een constante snelheid van 3 μmol/min. Daarom 90 pm van NAD + werd direct toegediend in het vasculaire compartiment elke 30 min het leveren van een totaal van 1.080 pm tegen het einde van de infusie op 6 uur. Intravasculaire vermenging van elk punt van infusie optreedt binnen ~ 2 min, uitgaande van een gemiddeld bloedvolume van 5, de toegevoegde NAD +, in de afwezigheid van significante metabolisme of absorptie, zou overeenkomen met een extra stijging van (NAD +) van ten minste 18 pM, elke 30 min over de 6 uur van infusie. Hoewel een stijging van deze grootte ruim binnen de analytische detectiegrenzen van deze studie ligt, werd er geen stijging van NAD+ of zijn metabolieten waargenomen tot na 2 uur (d.w.z. op het tijdstip van 6 uur) in hetzij plasma of urine. Deze onverwachte waarneming wijst op een snelle, en althans gedurende de eerste 2 uur, volledige weefselopname en/of metabolisme van NAD+ en/of de metabolieten daarvan.
Een aantal enzymen kan een effectief NAD+ katabolisme bewerkstelligen, waaronder de sirtuïnes (SIRT’s 1-7), de adenosinedifosfaat (ADP)-ribose-transferases (ART’s) en poly(ADP-ribose)-polymerases (PARP’s 1-17) en de cyclische ADP-ribose (cADPR)-synthases (CD38, CD157). Extracellulaire NAD+ pyrofosfatases die aanwezig zijn in menselijk serum kunnen ook NAD+ afbreken tot AMP en NMN (Schmidt-Brauns et al., 2001). Het cel-oppervlakte-eiwit CD73 zet NMN ook om in NR, dat gemakkelijk de celmembranen passeert voor mogelijke hersynthese tot NAD+. Belangrijk is dat de NAD+ kataboliserende glycohydrolasen, CD38 en CD157, ecto-nucleotide pyrofosfatase (CD203a) en de NMN kataboliseerder CD73 ectoenzymen zijn die worden aangetroffen op een grote verscheidenheid van cellen waaronder lymfoïde, granulocytaire, neuronale en endotheelcellen (Wei et al., 2014) en plasma oplosbare NAD glycohydrolasen kunnen ook aanwezig zijn (figuur 3; Funaro et al., 2009). De parallelle stijging van plasma NAM en ADPR (correlatiecoëfficiënt van 1,000, p < 0,001, gegevens niet weergegeven) suggereert sterk dat ten minste tegen 6 uur een belangrijk lot van NAD+ metabolisme is door splitsing van de glycosidische ADPribose-nicotinamide koppeling aan NAM en ADPR, bijproducten die symptomatisch zijn voor NAD-glycohydrolase (bv. CD38) activiteit. Dit is in overeenstemming met bewijsmateriaal van anderen waarvan is aangetoond dat met name CD38 een primaire rol speelt bij de controle van het extracellulaire NAD+-niveau (Wei et al., 2014). Volwassen menselijke erytrocyten zijn CD38-positief en brengen een hoge NAD+ glycohydrolase activiteit tot expressie, waardoor exogeen NAD+ wordt gekliefd om erytrocyten te voorzien van ADP ribose dat efficiënt in de cel kan worden opgenomen (Kim et al., 1993; Albeniz et al., 2004). De afwezigheid van een stijging van NAD+ of metabolieten, in plasma of urine, tot na de eerste 2 uur van de infusie geeft aan dat NAD+ en/of de metabolieten ervan uit de extracellulaire vasculaire ruimte worden getransporteerd en efficiënt worden vastgelegd in weefsel of extravasculaire compartimenten als NAD+ en/of de metabolieten ervan gedurende deze tijdsperiode.

Figuur 3. Potentieel extracellulair katabolisme van exogeen geleverd NAD+ door activiteit van de ectoenzymen CD38 (ADP-ribose (ADPR)-synthase), CD203a (NAD+-pyrofosfatase), CD 73 (5′-nucleotidase), CD157-ADP-ribosylcyclase 2. Afkortingen: NAM, nicotinamide; NMN, nicotinamidemononucleotide; ADPR, adenosinedifosfaatriboside; meNAM, methylnicotinamide; 4PY, N-methyl-4-pyridon-3-carboxamide; 2PY, methyl-2-pyridon-5-carboxamide; ARPP, ADP ribose pyrofosfatase; RPPK, ribosyl pyrofosfokinase; NAmpt, nicotinamide fosforibosyltransferrase; NMNAT, nicotinamide mononucleotideadenyltransferase; CX-43, connexine 43.
Hoewel PARP en sirtuïnes betrokken zijn bij NAD+ katabolisme, is het onwaarschijnlijk dat zij als intracellulaire enzymen met vertegenwoordigers in cytoplasma, kern en mitochondria een directe invloed hebben op de extracellulaire NAD+ niveaus. Van deze enzymen kan echter worden verwacht dat zij reageren op veranderingen in de intracellulaire concentraties van NAD+, NAM en NR die kunnen ontstaan door exogeen toegevoerd NAD+. Figuur 4 geeft een schematisch overzicht van de mogelijke lotgevallen van exogeen NAD+.
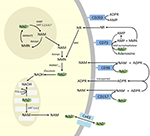
Figuur 4. Mogelijke intracellulaire en extracellulaire lotgevallen van exogeen geleverd NAD+. Afkortingen: CD38 , CD203a (NAD+ pyrofosfatase), CD 73 (5′-nucleotidase). NAM, nicotinamide; NMN, nicotinamidemononucleotide; ADPR, adenosinedifosfaatriboside; meNAM, methylnicotinamide; 4PY, N-methyl-4-pyridon-3-carboxamide; 2PY, methyl-2-pyridon-5-carboxamide; ARPP, ADP ribose pyrofosfatase; RPPK, ribosyl pyrofosfokinase; NAmpt, nicotinamide fosforibosyltransferrase; NMNAT, nicotinamide mononucleotideadenyltransferase; PARP ; NRK .
Terwijl er een aanzienlijke capaciteit bestaat voor de snelle afbraak van het exogeen toegevoerde IV NAD+ in samenstellende metabolieten, is het ook de moeite waard op te merken dat de opname van extracellulair NAD+ ook kan plaatsvinden. Aangezien NAD+ een algemene negatieve lading heeft, kan het de celmembranen niet passief passeren en moet het dus actief over het membraan worden getransporteerd. Dat dit gebeurt is aangetoond door een aantal onderzoekers die hebben gerapporteerd dat exogeen NAD+ toegepast op een verscheidenheid van menselijke celtypes inderdaad resulteert in een aanzienlijke verhoging van intracellulair NAD+ (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Hoewel het (de) betrokken mechanisme(n) nog niet volledig zijn gekarakteriseerd, meldden Alano et al. (2010) dat exogeen NAD+ neuronen kon binnendringen via P2X7 kanalen en anderen hebben consistent het transport van NAD+ over membranen waargenomen door connexine 43 (CX43) hemikanalen, zelfs bij concentraties zo laag als 250 pM (Billington et al., 2008). Aangezien connexines een brede verspreiding hebben in menselijk weefsel en CX43 de meest alomtegenwoordige connexine blijkt te zijn in vele celtypen, kan het potentieel voor snelle opname van NAD+ niet worden ontkend.
Dus de cellulaire opname en/of het metabolisme van NAD+ en de metabolieten NAM en ADPR en de secundaire metabolieten meNAM en NMN leken gelijke tred te houden met de 3 μmol/min NAD+ infusie gedurende ten minste de eerste 2 uur. Ofwel worden NAD+ en/of de geteste primaire metabolieten efficiënt vastgelegd gedurende deze eerste periode van 2-6 uur, ofwel worden er ook secundaire metabolieten gevormd. ADPR kan worden gerecycled om NAD+ te produceren uit NAM (figuur 4) of verder gemetaboliseerd via ectoenzymen zoals CD203a (NAD+ pyrofosfatase) om AMP te produceren dat verder snel gemetaboliseerd kan worden tot adenosine door CD73 een 5′-nucleotidase (Bogan en Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). Ter ondersteuning van deze hypothese is een verhoging van de adenosinespiegel in het bloed door anderen herkend als een gevolg van extracellulaire NAD+ infusie (Szczepañska-Konkel et al., 2003). NAM kan ook worden gemetaboliseerd tot NMN via de salvage pathway vóór de resynthese tot NAD+ (figuren 3, 4) of door hepatische methyltransferasen worden omgezet in N1-methylnicotinamide, dat ofwel direct kan worden uitgescheiden ofwel verder kan worden omgezet in N-methyl-2-pyridon-5-carboxamide (2PY, +99% van meNAM) en N-methyl-4-pyridon-3-carboxamide (4PY, ~0,25% van meNAM) vóór de excretie.25% van meNAM) vóór de uitscheiding (Shibata en Matsuo, 1989; Okamoto et al,
Het is duidelijk dat bij het gebruikte doseringsschema de mechanismen die betrokken zijn bij het metabolisme en de sequestratie van NAD+ en metabolieten ergens na 2 uur verzadiging hebben bereikt, wat resulteert in een significante verhoging van plasma NAD+ en accumulatie van alle geteste metabolieten (NMA, ADPR, meNAM en NMN) na 6 uur. Zoals eerder vermeld ondersteunen deze gegevens de opvatting dat een belangrijke route voor NAD+ metabolisme onder deze omstandigheden de splitsing van de glycosidebinding is, door ectoenzymen zoals CD38 om NAM en ADPR te produceren. De stijging van plasma-NMN na 2 uur suggereert echter ook dat exogeen NAD+ waarschijnlijk wordt beïnvloed door extracellulaire NAD+ pyrofosfatasen, waardoor plasma-NMN wordt verhoogd en AMP vrijkomt als een extra metaboliet.
Samenvattend heeft deze studie voor de eerste keer aangetoond dat: (a) bij een stroomsnelheid van 3 μmole/min alle exogeen toegediende NAD+ snel en volledig uit het plasma werd verwijderd gedurende ten minste de eerste 2 uur; (b) de toename van geanalyseerde metabolische bijproducten consistent is met NAD+ glycohydrolasen en NAD+ pyrofosfatase activiteit; en (c) de urinaire uitscheidingsproducten als gevolg van NAD+ infusie natief NAD+ en meNAM maar geen NAM bevatten.
Hoewel de bevindingen van dit onderzoek nieuw zijn en ons begrip van de tijdige bestemming van exogeen NAD+ bij mensen enigszins vooruit helpen, zijn er beperkingen vastgesteld. Om de totale metabole afrekening te verbeteren, moeten toekomstige studies veranderingen in NAD+ en metabolieten in de rode cel en de uitscheiding in de urine van de secundaire meNAM-metabolieten, 2PY en 4PY, onderzoeken. Bovendien zal het waarschijnlijk nuttig zijn om de invloed van exogeen NAD+ op veranderingen in het purinemetabolisme te beoordelen, wat ten minste een beoordeling van plasma en rode cel AMP en adenosine moet omvatten. Het gebruik van diermodellen kan ook helpen om de relatieve betrokkenheid van de verschillende metabolische routes te verduidelijken door het gebruik van geschikte farmacologische remmers en weefselbemonstering.
Concluderend was deze studie in staat om voor de eerste keer een aantal zeer nuttige, voorheen onbekende, informatie te onthullen over het lot van exogeen IV NAD+ bij mensen, waaronder, de algemene veiligheid en verdraagbaarheid van een IV NAD+ infusie met een snelheid van 3 μmoles/min, de snelle sekwestratie van NAD+ uit het plasma, de waarschijnlijke bijdrage van zowel NAD+ glycohydrolase als NAD+ pyrofosfaatactiviteit in het metabolisme van NAD+ en de schijnbaar efficiënte renale tubulaire reabsorptie van NAM. Aanvullend onderzoek is echter vereist om de complexe metabolische lotgevallen van deze belangrijke molecule volledig te onthullen. Verder zal de karakterisering van deze veranderingen helpen bij de ontwikkeling en verbetering van op NAD+ gebaseerde behandelingsregimes voor aandoeningen die waarschijnlijk baat hebben bij een verhoogde beschikbaarheid van NAD+, waaronder aandoeningen die meer celregeneratie en -herstel vereisen, zoals de ziekte van Alzheimer en andere neurodegeneratieve vormen van dementie.
Beschikbaarheid van gegevens
De datasets die voor deze studie zijn gegenereerd, zijn op verzoek beschikbaar voor de corresponderende auteur.
Ethische verklaring
De studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). De patiënten/deelnemers gaven hun schriftelijke geïnformeerde toestemming om deel te nemen aan deze studie.
Bijdragen van auteurs
RG nam deel aan studieontwerp en toezicht, kritische discussie en auteurschap van het manuscript. JBer heeft deelgenomen aan de onderzoeksopzet, kritische discussie, gegevensverzameling, statistische analyse, manuscript redigeren en manuscript review. RM heeft deelgenomen aan de onderzoeksopzet, kritische discussie, klinische supervisie en manuscriptreview. NB heeft deelgenomen aan de biochemische analyse en de manuscriptbeoordeling. JW heeft deelgenomen aan de onderzoeksopzet, kritische discussie en manuscriptreview. JBen heeft deelgenomen aan dataverzameling en manuscriptreview. SB heeft deelgenomen aan de onderzoeksopzet en de beoordeling van het manuscript. Alle auteurs hebben de definitieve versie van het manuscript beoordeeld, gelezen en goedgekeurd, en zijn het eens met de volgorde van presentatie van de auteurs.
Funding
Deze studie werd gezamenlijk gefinancierd door de NAD+ Research Inc, (LA, USA) en het Australasian Research Institute Incorporation (Sydney, Australië) en werd uitgevoerd in het Springfield Wellness Center, Springfield, LA, USA.
Conflict of Interest Statement
RM is directeur van NAD+ Research Inc., en medisch directeur van het Springfield Wellness Center dat IV NAD gebruikt als klinische therapie. SB ontving adviesvergoedingen van NAD+ Research Inc.
De overige auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij danken Archway Apothecary Pty Limited, LA, USA voor hun gratis levering van IV NAD+ voor dit project.
Abeti, R., and Duchen, M. R. (2012). Activation of PARP by oxidative stress induced by β-amyloid: implications for Alzheimer’s disease. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Een open-label, niet-gerandomiseerd onderzoek naar de farmacokinetiek van het voedingssupplement nicotinamide riboside (NR) en de effecten ervan op de NAD+ niveaus in het bloed bij gezonde vrijwilligers. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). NAD+ depletie is noodzakelijk en voldoende voor PARP-1 gemedieerde neuronale dood. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). NAD glycohydrolase activities and adp-ribose uptake in erythrocytes from normal subjects and cancer patients. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Karakterisering van NAD+ opname in zoogdiercellen. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nucleotidases and their new roles in NAD+ and phosphate metabolism. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Leeftijdsgerelateerde veranderingen in NAD+ metabolisme oxidatieve stress en sirt1 activiteit bij wistar ratten. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Mapping NAD+ metabolism in the brain of ageing Wistar rats: potential targets for influencing brain senescence. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Kwantificeren van het cellulaire NAD+ metaboloom met behulp van een tandem vloeistofchromatografie massaspectrometrie aanpak. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). Het plasma NAD+ metaboloom is ontregeld bij “normale” veroudering. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rol van endotheliale NAD+ deficiëntie in leeftijdsgerelateerde vasculaire disfunctie. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., and Milbrandt, J. (2017). Het SARM1 tol/interleukine-1 receptor domein bezit intrinsieke NAD+ splitsingsactiviteit die pathologische axonale degeneratie bevordert. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., and Chiarugi, A. (2013). Inzicht in de moleculaire en functionele eigenschappen van NMNAT3 onthult nieuwe hints van NAD homeostase binnen de menselijke mitochondriën. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ectoenzymen en aangeboren immuniteit: de rol van menselijke CD157 in leukocyten trafficking. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). The etiology of Pellagra: the significance of certain epidemiological observations with respect to thereto. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Changes in oxidative damage, inflammation and with age in cerebrospinal fluid. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenosine gegenereerd in de beenmergnis via een CD38-gemedieerde pathway correleert met progressie van humaan myeloom. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Function of NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). Effect van nicotinamide mononucleotide op mitochondriale respiratoire tekorten in de hersenen in een voor de ziekte van Alzheimer relevant muizenmodel. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Leeftijdsgeassocieerde veranderingen in oxidatieve stress en NAD+ metabolisme in menselijk weefsel. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Verslaving de donkere nacht van de ziel, NAD+ het licht van de hoop. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Langdurige toediening van nicotinamide mononucleotide mitigeert leeftijdsgeassocieerde fysiologische achteruitgang bij muizen. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). De rol van extracellulaire adenosine generatie in de ontwikkeling van auto-immuunziekten. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN in the prevention, diagnosis, and treatment of drug addictions. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Diurnal variations in human urinary excretion of nicotinamide catabolites: effecten van stress op het metabolisme van nicotinamide. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., and Gupta, M. P. (2005). Poly(ADP-ribose) polymerase-1-afhankelijke cardiale myocyt celdood tijdens hartfalen wordt gemedieerd door NAD+-depletie en verminderde Sir2α deacetylase activiteit. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Farmacologische effecten van exogeen NAD op mitochondriale bio-energetica, DNA reparatie, en apoptose. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., and Reidl, J. (2001). Is een NAD pyrofosfatase activiteit noodzakelijk voor Haemophilus influenzae type b vermenigvuldiging in de bloedstroom? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., and Matsuo, H. (1989). Correlation between niacin equivalent intake and urinary excretion of its metabolites, N’-methylnicotinamide, N’-methyl-2-pyridone-5-carboxamide and N’-methyl-4-pyridone-3-carboxamide, in humans consuming a self-selected food. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Oxidatieve stress signalering bij de ziekte van Alzheimer. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). Renale hemodynamica en natriuretische responsen op intraveneuze toediening van diadenosinetetrafosfaat (ap4a) en nicotinezuuramide-adenine-dinucleotide (NAD) bij de rat. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). Rollen en mechanismen van de CD38/cyclische adenosine difosfaat ribose/Ca2+ signaleringsroute. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). Bronnen en implicaties van NADH/NAD+ redox onbalans in diabetes en zijn complicaties. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., and Tsuchiya, M. (2006). The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Rollen van NAD+, PARP-1, en sirtuïnes in celdood, ischemisch hersenletsel, en synchrotron straling X-ray-geïnduceerde weefselschade. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). NAD+ suppletie voorkomt PARP-1-geïnduceerde glycolytische blokkade en celdood in gekweekte muizenastrocyten. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Oxidatieve stress en NAD+ in ischemisch hersenletsel: huidige vorderingen en toekomstperspectieven. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). NAD+ tussenproducten: de biologie en het therapeutisch potentieel van NMN en NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). Nicotinamide mononucleotide, een belangrijk NAD+ intermediair, behandelt de pathofysiologie van dieet- en ouderdomsgeïnduceerde diabetes bij muizen. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Neuronale dood geïnduceerd door verkeerd gevouwen prioneiwit is te wijten aan NAD+ depletie en kan in vitro en in vivo worden verlicht door NAD+ suppletie. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). NADH kan astrocyten binnendringen om PARP-1-gemedieerde astrocytendood te blokkeren. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., and Perry, G. (2007). Oorzaken van oxidatieve stress bij de ziekte van Alzheimer. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar