はじめに
親ピリジンヌクレオチド、ニコチンアミド・アデニンジヌクレオチド(NAD+)は身体のすべての細胞に存在し、細胞の生存と機能にとって不可欠である。
呼吸鎖への電子輸送を担う補因子として、NAD+とその酸化還元カップルであるNADHは、酸化的リン酸化によるミトコンドリアでのエネルギー(ATP)産生の中心を担っています。 NAD+のリン酸化代謝物であるNADP+とそのレドックスカップルであるNADPHは、コレステロールや核酸の合成、脂肪酸の伸長、身体の主要な抗酸化物質の1つであるグルタチオン(GSH)の再生といった多くの同化反応を促進する還元力を提供する。 このピリジンヌクレオチドのファミリーは、全体で400以上の酵素反応の酸化還元に寄与している。 重要なことは、レドックスカップルとして働くとき、NAD+は消費されないということです。 しかし、NAD+は他の多くの重要な代謝プロセスの基質としても機能するため、それらの化学反応の結果として消費され、組織内のNAD+を枯渇させる可能性があります。 この数に含まれるのは、DNA修復と核の安定性を制御するポリアデノシンホスホリボース(ADPR)ファミリー酵素(PARP1-17)、エピジェネティック制御酵素(Sirt1-7)、細胞間免疫コミュニケーション(CD38/CD157)およびニューロン再生(SARM1; Essuman et al, 2017)によって駆動する反応である。 したがって、これらの酵素によるNAD+消費がNAD+の供給または合成を上回る状況では、複数のレベルで細胞代謝が崩壊する可能性が存在する。
細胞のNAD+レベルを維持することの臨床的重要性は、前世紀初頭に、下痢、皮膚炎、認知症および死亡を特徴とする病気であるペラグラが、NAD+前駆体のナイアシン(ビタミンB3としても知られ、ゴールドバーガー、1914)を含む食品によって治癒できることを見出しによって確立された。 ペラグラは先進国では稀ですが、加齢に伴って生じるような酸化的損傷が増加する条件下では、NAD+の細胞内濃度が低下することが示されています(Braidyら、2011年、Massudiら、2012年、Guestら、2014年)。 NAD+のレベルの変化は、糖尿病(Wuら、2016)、心臓病(Pillaiら、2005)、加齢による血管機能障害(Csiszarら、2019)、虚血性脳損傷(YingおよびXiong、2010)、神経細胞タンパク質の誤折れ(Zhouら、2016)など酸化的/フリーラジカル損傷の増加に伴ういくつかの障害に伴うことが見出されてきた。 2015)及びアルツハイマー型認知症(Abeti and Duchen, 2012)。
Aβプラーク及び神経原線維タウ絡みの病理学的特徴に加えて、酸化的損傷はアルツハイマー型認知症の一貫した発見であり、Aβ沈着よりもさらに前の、発症プロセスの初期イベントとして広く認識されている(Su et al.、2008)。 この損傷を引き起こす活性酸素種 (ROS) は複数の原因に由来すると考えられますが、ミトコンドリアの機能不全と、Fe++ および Cu+ などの酸化還元活性金属の利用が主要な役割を果たすと考えられています (Zhua et al.、2007)。 PARP1 は DNA の損傷に応答して NAD+ を加水分解し、ADP-リボースのポリマーを生成します (Ying, 2013)。 我々は以前、ヒト組織(Massudi et al., 2012)およびラット脳(Braidy et al., 2014)において、NAD+レベルが酸化ストレスの指標と逆相関することを示しました。 したがって、生存中のアルツハイマー病患者の脳におけるNAD+レベルの低下は、非侵襲的手法による確認が待たれるが、死後の脳における酸化的損傷の一貫した所見は、NAD+の回転の加速と枯渇がこの疾患における神経機能障害に寄与するという見解を強く支持するものである。 NAD+の回復を目標とした介入は、動物モデルにおいて健康的な加齢をサポートし、代謝機能(Yoshinoら、2011;Millsら、2016)および認知症(Longら、2015)を改善することが示されているので、ヒトにおけるNAD+レベルを上げる戦略が活発に検討されている<7400><1144>NAD+レベルを上げる最も直接的な方法は、静脈内(IV)投与である。 実験研究のデータはわずかであるが、アルコール離脱におけるNAD+の静脈内注入の重要な臨床的有用性は以前から報告されている(O’Holleran, 1961; Mestayer, 2019)。 驚くべきことに、ニコチンアミドリボシド(NR)またはニコチンアミドモノヌクレオチド(NMN)などのNAD+前駆体の経口投与は、NAD+レベルへの影響について熱心に研究されているが(吉野ら、2011、2018;ミルズら、2016;エアハートら、2017)、NAD+静脈投与による代謝運命および薬物動態特性はヒトでまだ報告されていない。 そこで本研究では、健康な男性参加者のコホートにおけるNAD+の静脈内注入中のNAD+とその代謝物の濃度変化を初めて紹介する。
材料と方法
参加者
ラジオ、テレビ、ソーシャルメディア上の広告で30~55歳の男性11人(テストn=8、コントロールn=3)を募集した。 参加者は全員、BMIが30kg/m2未満(Test平均BMI=27.5 ± 2.5 kg/m2、Control平均BMI=24.6 ± 6.5 kg/m2)、糖尿病ではない、タバコは1本未満、アルコール飲料は1日2本未満であった。 脂質低下剤や抗炎症剤を服用している人,肝不全や腎不全の既往がある人,最近微生物感染症や外傷,その他の重大または未治療の医療障害を経験した人は,この研究から除外された。 被験者は、実験を完了したかどうかにかかわらず、時間と参加に対して金銭的な補償を受けた。
食事の標準化
NAD+静脈注入の前日に、参加者は同一のナイアシン低減食を消費し、水のみを飲んだ。
研究当日は、最後の8時間の血液/尿サンプルを採取した後まで、いかなる食物も消費されなかった。 参加者は、通常の水分補給を維持するために水を飲むよう奨励された。 6時間の輸液の間、参加者に十分なエネルギー摂取が維持されるように、輸液には0.1%のブドウ糖も含まれ、6時間の輸液期間にわたって約2000カロリーが提供された。 Test群では、750mgのNAD+を生理食塩水(Archway Apothecary, Covington, LA, USA)で6時間かけて静脈内投与した(注入速度=〜2mg/min ≡ 3μmoles/min)。 この NAD+ の投与量は経験的に導き出されたもので、臨床現場で定期的に NAD+ の静脈内注入を行っているクリニック(例:スプリングフィールド ウェルネス クリニック、スプリングフィールド、LA、米国)で一般的に行われている投与法を反映している。 対照群の参加者は、6時間にわたって通常の生理食塩水を静脈内投与された。
IV輸液およびサンプル収集の臨床管理および監督は、米国、LA、スプリングフィールドのスプリングフィールドウェルネスセンターで行われた。 その後、点滴開始後30分、60分、120分(2時間)、360分(6時間)、480分(8時間)に追加採取した。
全血は標準的な静脈穿刺(点滴部位と反対の腕)で5mLの非ゲル化ヘパリンチューブに採取した。 採血後直ちに4℃、1,409×gで10分間遠心分離した。
血漿および赤血球画分を直ちに分離し、それぞれ5×500μLのアリコートに分配した。
尿サンプル採取
ベースライン中流尿サンプルの採取後、参加者はNAD+注入開始後30分、2時間、6時間、8時間に備え付けの容器にすべての尿を排泄するよう求められた。 これらの時点の間に断続的に排尿する必要がある場合は、次の連続したレセプタクルに排尿するよう被験者に求めた。 すべてのサンプルは、受領後直ちに分注し、-80℃で保存した。
分析方法
NAD+および関連代謝物のクロマトグラフィー分離およびMS検出液体クロマトグラフィー結合タンデム質量分析(LC/MS/MS)は、以前に記載したようにSciex QTRAP 5500質量分析計(Sciex、レッドウッドシティ、カリフォルニア、米国)を使用して実施した(Clement et al.、2018年)。 簡単に言えば、100μLのヒト血漿または尿を400μLの氷冷メタノールで抽出し、4℃で10分間遠心分離し、3kDa膜カートリッジで濾過した。 サンプル抽出物を真空下で乾燥させ、200μLの100mM NH4OAcバッファで再構成し、200μLのガラスバイアルに移し、LC/MS/MS分析前にキャップをした。 標準品とサンプル (20 μLL) は、前述のように Phenomenex NH2 カラム (150 mm- 2 mm- 3 mm) に注入しました。 アンモニアで調整した5 mM NH4OAc pH 9.5 (移動相A) とアセトニトリル (移動相B) からなる二相溶媒グラジエントを250 μL/minの流速で使用しました。 注入時の初期溶媒組成は25%A、その後45%Aへの2分間のグラジエントと80%Aへの高速グラジエント(0.1分)で5.9分間維持、Aは再び95%に上昇(2分)、13分間保持後、平衡化のために初期条件(0.1分)に戻し、総運転時間は30分であった。 カラムフローはMS検出器に導かれた。 代謝物の検量線は、各キャリブレーターのピーク面積比 (代謝物のピーク面積を選択したISのピーク面積で割ったもの) とその濃度を用いて作成しました。
内部標準物質は、2H2NAM (NAM, methylNAM, ADPR) と 13C5;-Cyclic AMP (NMN, NAD+) からなります。 すべての NAD 代謝物について同位体ラベルが市販されているわけではないので、分析中の安定性とイオン化効率が同程度とみなされる場合は、近縁の分子(構造類似物)を使用することもできます (Yamada et al.、2006 年)。 本研究で選択された内部標準は、関連代謝物について以前に最適化されている(Bustamanteら、2017)
安全性
IV NAD+の安全性は、肝機能検査およびあらゆる有害事象の臨床観察を用いて評価された。 肝機能検査は、血清、総ビリルビン(bili)、アルカリホスファターゼ(ALP)、アラニンアミノトランスフェラーゼ(ALT)、ガンマグルタミルトランスフェラーゼ(GGT)、乳酸脱水素酵素(LD)、アスパラギン酸アミノ基転移酵素(AST)から成る。
統計分析
統計分析はSPSSバージョン24とWindows用グラフパッドPRismバージョン8で完了させた。 非加重平均、Bonferroniの多重比較ポストホックテストを用いた二元配置分散分析は、テストされたアナリストの平均濃度が8時間にわたって、テストグループとコントロールグループ間で異なるかどうかを決定するために使用されました。 Wilcoxon Signed Ranks 検定を用いて、ベースラインと 8 時間の時点の肝機能検査濃度の平均値に有意な差があるかどうかを判定した。 p < 0.05のとき、差は統計的に有意とみなされた。
倫理
この研究は、人間を含む実験に関する世界医師会の倫理規定(ヘルシンキ宣言)に従って実施された。 William Carey University Institutional Review Board, Hattiesburg, MSから倫理的承認を得た(プロトコル#2017-12)。 すべての参加者からインフォームドコンセントを得た。
Results
Safety
プラセボ(食塩水)またはテスト(NAD+)コホートで6時間の点滴中に有害事象は観察されなかった。
肝機能酵素であるGGT、LD、ASTの活性は点滴開始後8時間でそれぞれ1.3、57、3.6単位/Lと有意に低下していた(表1)。 プラセボ(生理食塩水)投与サンプルでは、いずれの肝機能マーカーも8時間後の活性に有意な変化は認められなかったが、サンプル数が少ないため、識別感度が低下している可能性がある。 また、血漿ビリルビンの2.75μmoles/Lの有意な増加が観察された。 しかし、いずれの変化も臨床的に重要なものとは考えられなかった。

Table 1. Wilcoxon Signed Ranks試験は、平均肝機能検査濃度の差がベースラインと8時間の時点の間で有意であるかどうかを決定するために使用された。
血漿
NAD+を3μmoles/minの速度で連続注入すると、血漿NAD+レベルがベースラインに比べて6時間の時点(すなわち、注入の終了)でだけ有意(398%)増加した(p < 0.0001)。 これは、6時間の生理食塩水で処理した対照と有意に異なっていた(p < 0.001)。
NAD+レベルは、8時間(すなわち, ベースラインおよび生理食塩水処理対照試料と比較して、注入後2時間)。
血漿NAD+レベルは、生理食塩水処理対照試料における8時間の評価期間にわたってベースラインから有意に変化しなかった(図1A)。 血漿中ニコチンアミドアデニンジヌクレオチド (NAD+) および代謝物の 8 時間にわたる変化 . (A) NAD+, (B) ニコチンアミド (NAM), (C) アデノシンホスホリボース (ADPR), (D) メチルニコチンアミド (meNAM), (E) ニコチンアミドモノヌクレオチド (NMN). *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, 指示のとおり。 ボンフェローニの多重比較ポストホックテストを用いた二元配置分散分析により、試験した分析物の平均濃度が8時間にわたり、Test(n=8)群とControl(n=3)群の間で異なるかどうかを判断した。
NAD+について観察された変化と同様に、NAD+代謝物のニコチンアミド(NAM)のプラズマレベルはNAD+注入終了時(すなわち、。 6時間)において、ベースラインに対して409%有意に上昇した(p < 0.0001)。 これは、同様に、6時間の生理食塩水処理対照に対して有意に異なっていた(p<8648> 0.001)。<7400><1144>8時間の時点(すなわち、注入終了の2時間後)で、対照群と処理群の間のNAMレベルはもはや有意に異なっていなかった(p<3873> 0.05)。<7400><1144>生理食塩水処理対照サンプルのNAMレベルは8時間の時間期間にわたって有意には変化しなかった(p<3873> 0.05、図1B)。
NAMについて観察された変化と同様に、NAD+代謝物ADPRの血漿レベルは、NAD+注入の終了時(すなわち6時間)にベースラインに対して393%有意に増加した(p < 0.0001)。 これは、6時間の生理食塩水処理対照と有意に異なっていた(p < 0.0001)。
8時間の時点(すなわち、注入終了の2時間後)でも、ADPRレベルはベースラインより305%のままであった(p < 0.0001)。 しかしながら、これは、同じ時点における生理食塩水処理対照サンプルのADPRレベルよりも有意に大きくなかった(p<3873> 0.05)。<7400><1144>生理食塩水処理対照サンプルのADPRレベルは、8時間の時間帯にわたって有意に変化しなかった(p<3873> 0.05、図1C)。
2つのNAD+異化代謝物であるNAMおよびADPRの8時間の時点にわたるグループ平均間のスピアマンの相関分析は、相関係数1.00を生じた(p < 0.
また、NAMについて観察された変化と一致して、NAM代謝物であるメチルニコチンアミド(meNAM)の血漿レベルは、NAD+注入の終了時(すなわち, 6時間)、ベースライン(p < 0.0001)および6時間の生理食塩水処理対照(p < 0.01)の両方と比較して、350%にまで有意に増加した。 8時間の時点(すなわち、注入終了の2時間後)において、meNAMレベルはベースラインより393%高いままであり(p < 0.0001)、同じ時点の生理食塩水処理対照試料より有意に大きかった(p < 0.05)。
生理食塩水処理対照サンプルのmeNAMレベルは、8時間の時間期間にわたって有意に変化しなかった(p > 0.05、図1D)。
同化救済経路を介したNAMの代謝物であるNMNの血漿レベルは、8時間の時点でのみ有意に上昇した(472%)(すなわち、, 注入終了後2時間、p<8648> 0.05)。
生理食塩水処理対照サンプルのNMNレベルは、8時間の時間期間にわたって有意に変化しなかった(p<3873> 0.05、図1E)。
尿
NAD+を3μmoles/minの速度で連続静脈注入した結果、6時間の時点(すなわち、。 の尿中NAD+排泄率は、30分後に排泄されたものと比較して538%増加した(p < 0.001)。 これはまた、生理食塩水を投与した対照群による6時間の尿中NAD+排泄量と有意に異なっていた(p < 0.05)。
尿中NAD+排泄量は、8時間(すなわち, 注入後2時間)において、6時間時点のピーク排泄量と比較して43%減少した。
NAD+の尿排泄率は、生理食塩水処理対照試料において8時間の評価期間にわたって有意に変化しなかった(図2A)。 8時間にわたる尿中NAD+および代謝物の変化(最初の6時間は、3μモル/分のNAD+の連続静脈内注入で構成される)。 (A) NAD+、(B) NAM、(C) meNAM。 *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, 指示のとおりである。 Bonferroniの多重比較ポストホックテストを用いた二元配置分散分析により、試験した分析物の平均濃度が8時間にわたり、Test(n = 8)群とControl(n = 3)群で異なるかどうかを判定した。
NAD+代謝物NAMの排泄率は、8時間の試験期間にわたって有意に変化せず、生理食塩水処理対照について観察されたNAM排泄率と変わらなかった(図2B)。
NAM代謝物meNAMの尿排泄率が6時間の時点(すなわち。 30分後に比べ、6時間後(点滴終了時)の尿中排泄率は403%と有意に増加した(p < 0.01)。 尿中に排泄されたmeNAMの量は、8時間後(すなわち、8648> 0.05)で43%減少した。
考察
NAD+注入を含むNAD+ベースの治療への関心の高まりは、静脈内投与後のNAD+およびその代謝物の運命についてのより明確な理解の必要性を強調している。 本研究では、750 mgのNAD+を6時間かけて静脈内投与する典型的な臨床投与レジメンを用いて、8時間にわたる血漿および尿中のNAD+および主要代謝物のレベルの変化を記録しています。
重要なことは、NAD+の注入はテストコホートにおいて観察可能な有害事象を生じさせず、むしろ肝内LDおよびAST、肝後(胆管)酵素GGTなどの肝ストレスを示す酵素の血漿活性を低下させ、比較的短い8時間枠内でも肝内および肝後組織の完全性が高められたことを示唆したことである。 8時間後の赤血球分解産物であるビリルビンの上昇は、輸液による溶血で起こりうる赤血球回転数の非常に小さな増加、またはヘム代謝の減少のいずれかを反映していると考えられる(表1)。 しかし、この変化の大きさが非常に小さいことから、これは臨床的な関連性はないと考えられた。
予想通り、生理食塩水処理(すなわち、対照)被験者の血漿レベルは、NAD+、代謝物のNAMおよびADPR、NAM代謝物のNMNおよびmeNAMは8時間を通して本質的に変化しなかった。 しかし、30分から6時間の間にNAM、meNAM、ADPRの明らかな減少が観察されたが、これは生理食塩水の希釈効果によるものと思われる。 この考えと一致して、これらの分析物の値は8時間後にベースラインレベルに戻ることが確認された(すなわち。 しかし、予想外に、NAD+ を注入した参加者では、血漿 NAD+ レベルは 2 時間の時点まで上昇せず、NAD+ および代謝物 NAM、meNAM、ADPR (それぞれ 398%、409%、393%) のベースラインからの最大値は 6 時間の時点にのみ達した (Fig. 1A-E). これは、NAD+とmeNAMの尿中排泄量のピークが6時間後に発生し、点滴終了後に急速に減少したことと内部的に一致していた(図2A-C)。 したがって、90 μモルの NAD+ が 30 分ごとに血管区画に直接注入され、6 時間の注入終了時には合計 1,080 μモルとなった。平均血液量を 5 とすると、追加された NAD+ は、有意な代謝または吸収がなければ、6 時間の注入の間、30 分ごとに少なくとも 18 μM の (NAD+) の追加上昇に相当する。 この大きさの増加は、この研究の分析検出限界の範囲内であるが、NAD+およびその代謝物の増加は、2時間後(すなわち、6時間後の時点)まで血漿または尿のいずれにおいても観察されなかった。 この予想外の観察結果は、NAD+および/またはその代謝物が、迅速かつ少なくとも最初の2時間は完全に組織に取り込まれ、および/または代謝されることを示す。
サーチュイン (SIRTs 1-7) アデノシン二リン酸 (ADP) リボース転移酵素 (ARTs) およびポリ (ADP-ribose) ポリメラーゼ (PARPs 1-17) および環状ADPリボース (cADPR) 合成酵素 (CD38, CD157) など多くの酵素が効果的にNAD+異化を達成することが可能である。 ヒト血清中に存在する細胞外NAD+ピロホスファターゼは、NAD+をAMPおよびNMNに分解することもできる(Schmidt-Braunsら、2001年)。 細胞表面タンパク質CD73はまた、NMNをNRに変換し、これは容易に細胞膜を通過してNAD+に再合成される可能性がある。 重要なことは、NAD+異化グリコヒドロラーゼ、CD38およびCD157、エクトヌクレオチドピロホスファターゼ(CD203a)およびNMN異化酵素CD73は、リンパ球、顆粒球、神経細胞および内皮細胞を含む多種多様な細胞に見られる外酵素(Wei et al, 2014)およびプラズマ可溶NADグリコヒドロラーゼも存在する場合がある(図3; Funaro et al, 2009)ことだ。 血漿NAMおよびADPRの並列上昇(相関係数1.000、p < 0.001、データ示さず)は、少なくとも6時間までにNAD+の主要な運命が、グリコシドADPribose-ニコチンアミド結合の開裂によるNAMおよびADPR、NADグリコヒドロラーゼ(例えばCD38)活性の副産物に特徴付けられる代謝にあることを強く示唆している。 これは、特にCD38が細胞外NAD+レベルの制御において主要な役割を有することが示されている他の者による証拠と一致する(Wei et al.、2014)。 成体ヒト赤血球はCD38陽性であり、高レベルのNAD+グリコヒドロラーゼ活性を発現し、外来NAD+を切断して、赤血球に、細胞内に効率的に取り込まれるADPリボースを供給する(キムら、1993;アルベニズら、2004)。 輸液の最初の2時間後まで、血漿または尿中のNAD+または代謝物のいずれも上昇しないことは、NAD+および/またはその代謝物が細胞外血管空間から輸送され、この期間中にNAD+および/またはその代謝物として組織または血管外のコンパートメントに効率的に隔離されることを示している。 外来酵素CD38(ADP-リボース(ADPR)合成酵素)、CD203a(NAD+ピロホスファターゼ)、CD73(5′-ヌクレオチダーゼ)、CD157-ADP-リボシルサイクラーゼ2の活性による外因供給NAD+の細胞外異化作用の可能性。 略語。 NAM、ニコチンアミド;NMN、ニコチンアミドモノヌクレオチド;ADPR、アデノシン二リン酸リボシド;meNAM、メチルニコチンアミド;4PY、N-メチル-4-ピリドン-3-カルボキサミド;2PY、メチル-2-ピリドン-5-カルボキサミド。 ARPP、ADPリボースピロホスファターゼ;RPPK、リボシルピロホスホキナーゼ;NAmpt、ニコチンアミドホスホリボシルトランスフェラーゼ;NMNAT、ニコチンアミドモノヌクレオチドアデニルトランスフェラーゼ;CX-43、コネキシン43。
PARPとサーチュインはNAD+の異化に関与しているが、細胞質、核、ミトコンドリアに代表者を持つ細胞内酵素として、細胞外のNAD+レベルに直接影響を与えることはないだろうと考えられる。 しかし、これらの酵素は、外因的に供給されたNAD+から生じる可能性のあるNAD+、NAMおよびNRの細胞内濃度の変化に反応することが予想される。 図4は、外因性NAD+の考えられる運命を模式的にまとめたものである
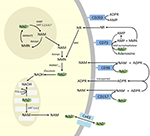
Figure 4. 外因的に供給されたNAD+の潜在的な細胞内および細胞外の運命。 略号は CD38 , CD203a (NAD+ ピロホスファターゼ), CD73 (5′-nucleotidase). NAM、ニコチンアミド;NMN、ニコチンアミドモノヌクレオチド;ADPR、アデノシン二リン酸リボシド;meNAM、メチルニコチンアミド;4PY、N-methyl-4-pyridone-3-carboxamid;2PY、methyl-2-pyridone-5-carboxamid。 ARPP、ADPリボースピロホスファターゼ;RPPK、リボシルピロホスホキナーゼ;NAmpt、ニコチンアミドホスホリボシルトランスフェラーゼ;NMNAT、ニコチンアミドモノヌクレオチドアデニルトランスフェラーゼ;PARP;NRK .
外因的に供給されたIV NAD+は速やかに分解されて構成代謝物となるが、細胞外のNAD+の取り込みも起こっている可能性があることは注目される。 NAD+は全体的に負電荷を帯びているため、受動的に細胞膜を通過することができず、膜を通過して能動的に輸送される必要がある。 このことは、様々なヒトの細胞タイプに適用された外因性NAD+が、実際に細胞内NAD+の著しい上昇をもたらすことを報告した多くの研究者によって示されている(Yingら、2003;Zhuら、2005;Billingtonら、2008;Pittelliら、2011;Feliciら、2013)。 そのメカニズムはまだ完全には解明されていないが、Alanoら(2010)は外因性のNAD+がP2X7ゲートチャネルを介してニューロンに入ることを報告し、他の研究者は250 pMという低濃度でもコネキシン43(CX43)ヘミチャネルによるNAD+の膜横断輸送を常に観察している(Billingtonら、2008)。 コネキシンはヒトの組織に広く分布しており、CX43は多くの細胞種に最も偏在するコネキシンであるようなので、NAD+の急速な取り込みの可能性は否定できない。
使用された投与レジメンでは、NAD+および代謝物の代謝および隔離に関与するメカニズムが、2時間後にいつか飽和に達し、6時間後に血漿NAD+の有意な上昇および試験したすべての代謝物(NMA、ADPR、meNAMおよびNMN)の蓄積が生じたことが明らかである。 先に述べたように、これらのデータは、これらの条件下でのNAD+代謝の主要な経路の1つは、CD38などの外部酵素によるグリコシド結合の開裂で、NAMとADPRを生成するという見方を支持している。 しかし、2 時間後の血漿 NMN の上昇は、外因性 NAD+ が細胞外の NAD+ ピロホスファターゼによって作用され、血漿 NMN を上昇させ、追加の代謝物として AMP を放出すると思われることも示唆している
結論として、本研究により初めて、以下のことが明らかにされた。 (a) 3 μmole/min の流速では、すべての外因性注入 NAD+ は、少なくとも最初の 2 時間、迅速かつ完全に血漿から除去された。(b) 分析した代謝副産物の増加は、NAD+ グリコヒドロラーゼおよび NAD+ ピロホスファターゼ活性と一致している。(c) NAD+ 注入によって生じる尿排泄物はネイティブ NAD+ および meNAM が含まれるが NAM とは無関係である。
この研究の知見は新規のものであり、ヒトにおける外因性NAD+の時間的な運命についての理解を前進させるものであるが、限界があることが明らかにされた。 全体的な代謝計算を改善するために、今後の研究では、赤血球の NAD+ と代謝物の変化、および二次的な meNAM代謝物である 2PY と 4PY の尿中排泄を調査する必要があります。 さらに、プリン代謝の変化に対する外因性NAD+の影響を評価することは、少なくとも血漿および赤血球のAMPとアデノシンの評価を含むことが有用であると思われる。 また、動物モデルを用いることで、適切な薬理学的阻害剤の使用や組織サンプリングによる様々な代謝経路の相対的な関与を明らかにすることができるかもしれない。
結論として、本研究は、ヒトにおける外因性NAD+の静脈内投与の運命について、これまで知られていなかった非常に有益な情報を初めて明らかにすることができた。 NAD+の代謝にはNAD+グリコヒドロラーゼとNAD+ピロリン酸活性の両方が寄与していると考えられ、NAMの腎尿細管再吸収が効率的に行われていることが明らかになった。 しかし、この重要な分子の複雑な代謝の運命を完全に明らかにするためには、さらなる研究が必要である。 さらに、これらの変化の特徴は、アルツハイマー病や他の神経変性認知症など、細胞の再生と修復を必要とする状態を含む、NAD+の利用可能性の増加から恩恵を受けると考えられる疾患に対するNAD+ベースの治療レジメンの開発および改良を進める上で役立つであろう。
Data Availability
この研究のために生成されたデータセットは、対応する著者に要求に応じて利用可能です。
Ethics Statement
ヒト参加者を含む研究は、MS州ハティスバーグのウィリアムキャリー大学機関審査委員会によって審査および承認されています(プロトコル#2017-12)。 患者/参加者は、本研究に参加するために書面によるインフォームドコンセントを提供した。
Author Contributions
RGは研究デザインと監督、重要な議論、原稿執筆で参加した。 JBerは研究デザイン、重要な議論、データ収集、統計分析、原稿の起草、原稿審査に参加した。 RMは、研究デザイン、重要な議論、臨床監督、原稿審査に参加した。 NBは、生化学的解析と原稿のレビューに参加した。 JWは、研究デザイン、重要な議論、原稿審査に参加した。 JBenはデータ収集と原稿審査に参加した。 SBは研究デザインと原稿審査に参加した。 また、著者の発表順にも同意している。
Funding
この研究は、NAD+ Research Inc.から共同出資された。 (米国、LA) と Australasian Research Institute Incorporation (オーストラリア、シドニー) の共同出資で、米国、LA、スプリングフィールドのスプリングフィールドウェルネスセンターで行われました。
利益相反声明
RMはNAD+リサーチ社のディレクターで、臨床治療としてNADを静脈注射するスプリングフィールドウェルネスセンターの医療ディレクターです。 SBはNAD+ Research Inc.から顧問料を受け取った。
残りの著者は、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
謝辞
我々は、このプロジェクトのために無償でIV NAD+を供給した米国LAのArchway Apothecary Pty Limitedに感謝したい。
Abeti, R. , および Duchen, M. R. (2012). β-アミロイドによって誘発される酸化ストレスによる PARP の活性化:アルツハイマー病への示唆。 Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al (2017). 健康なボランティアにおける栄養補助食品ニコチンアミドリボシド(NR)の薬物動態と血中NAD+濃度への影響に関する非盲検非ランダム化研究(An open-label, nonrandomized study of the pharmacokinetics of the nutritional supplement nicotinamide riboside (NR) and its effects on blood NAD+ levels in healthy volunteers. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T.M., and Swanson, R.A. (2010). NAD+の枯渇は、PARP-1を介した神経細胞死に必要かつ十分である。 J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | Cross Ref Full Text | Google Scholar
Albeniz, I.Demir, O.Nurten,R., and Bermek,E. (2004). 健常者と癌患者の赤血球におけるNADグリコヒドロラーゼ活性とadp-リボースの取り込み。 Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A.、他 (2008). 哺乳類細胞におけるNAD+の取り込みの特性評価。 J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-ヌクレオチダーゼとそのNAD+およびリン酸代謝における新たな役割. ニュー・ジェイ・ケム. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). ウィスターラットにおけるNAD+代謝酸化ストレスおよびsirt1活性の加齢変化。 PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T. , Mansour, H. , Chan-Ling, T. , et al(2014).。 加齢したWistarラットの脳におけるNAD+代謝のマッピング:脳の老化に影響を与えるための潜在的なターゲット。 Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al(2017).。 タンデム液体クロマトグラフィー質量分析法を用いた細胞内NAD+メタボロームの定量化。 Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018).メタボロミクスを用いた細胞内NAD+メタボロームの定量化。 血漿NAD+メタボロームは「正常」な加齢で制御不全に陥る。 Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al.(2019).血漿中のNAD+代謝系は、正常な加齢において制御不能である。 加齢に伴う血管機能障害における内皮性NAD+欠乏の役割. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y. , Mao, X. , DiAntonio, A., and Milbrandt, J.(2017).,内皮NAD+の欠損は、加齢に伴う血管機能障害に関与する。 SARM1 toll/interleukin-1受容体ドメインは、病的な軸索変性を促進する内在性NAD+開裂活性を有している。 Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M. , and Chiarugi, A. (2013). NMNAT3の分子的・機能的特性の解明により、ヒトミトコンドリア内のNADホメオスタシスの新しいヒントが明らかになりました。 PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R.ほか(2009). エクトエンザイムと自然免疫:白血球輸送におけるヒトCD157の役割。 Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger、J.(1914). ペラグラの病因:それに関するある疫学的観測の意義。 Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). 脳脊髄液における酸化的損傷、炎症、加齢に伴う変化。 PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al.(2016).の項参照。 CD38を介した経路で骨髄ニッチに生成されたアデノシンは、ヒト骨髄腫の進行と相関する。 Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M.K., Park, B.H., Kim, H.R., and An, N.H. (1993). ヒト赤血球からのADP-リボース取り込みにおけるNADグリコヒドラーゼの機能. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A.N., Owens, K., Schlappal, A.E., Kristian, T., Fishman, P.S., and Schuh, R.A. (2015). アルツハイマー病関連マウスモデルにおける脳内ミトコンドリア呼吸障害に対するニコチンアミドモノヌクレオチドの効果。 BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J.、他 (2012).。 ヒト組織における酸化ストレスとNAD+代謝の加齢変化。 PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer,P. N. (2019). アディクション・ザ・ダーク・ナイト・オブ・ザ・ソウル、NAD+ザ・ライト・オブ・ホープ. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al.(2016).グーグルシュラール(G). ニコチンアミドモノヌクレオチドの長期投与は、マウスの加齢に伴う生理的な衰えを緩和する。 Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R. and Malavasi, F. (2018).モランディ(モランディ), F., A. L., Rizzo, R., and Malavasi (2018). 自己免疫疾患の発症における細胞外アデノシン生成の役割. メディエーター・インフラム. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract |Ref Full Text | Google Scholar
O’Holleran,P.(1961). 薬物中毒の予防、診断、治療におけるDPN。 West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T.et al. (2003). ヒト尿中ニコチンアミド異化体排泄量の日内変動:ニコチンアミドの代謝に及ぼすストレスの影響. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S. および Gupta, M. P. (2005). 心不全におけるポリ(ADP-リボース)ポリメラーゼ-1依存性の心筋細胞死は、NAD+の枯渇とSir2αデアセチラーゼ活性の減少によって媒介される。 J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F.、et al. (2011). ミトコンドリアの生体エネルギー、DNA修復、アポトーシスに対する外因性NADの薬理効果。 Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., and Reidl, J. (2001). 血流中のインフルエンザ菌b型の増殖にNADピロホスファターゼ活性は必要か? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., and Matsuo, H. (1989). 自己選択した食品を摂取するヒトにおけるナイアシン相当摂取量とその代謝物であるN’-メチルニコチンアミド、N’-メチル-2-ピリドン-5-カルボキサミドおよびN’-メチル-4-ピリドン-3-カルボキサミドとの尿中排泄量の相関関係. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G.、他 (2008).Nu. アルツハイマー病における酸化ストレスシグナル。 Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). ラットにおけるジアデノシン四リン酸(ap4a)およびニコチンアミドアデニンジヌクレオチド(NAD)の静脈内投与に対する腎臓の血行動態およびナトリウム利尿応答。 J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract|Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). CD38/環状アデノシン二リン酸リボース/Ca2+シグナル伝達経路の役割と機序. ワールドJ.Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z. , Zheng, H. , and Yan, L. J. (2016). 糖尿病とその合併症におけるNADH/NAD+のレドックスインバランスのソースと意味合い。 Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N. , Shibata, T. , Osago, H., and Tsuchiya, M. (2006). 液体クロマトグラフィー/エレクトロスプレーイオン化タンデム質量分析法によるニコチンアミドアデニンジヌクレオチドおよび関連化合物の同時測定. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying、W. (2013). 細胞死、虚血性脳損傷、放射光X線誘発組織傷害におけるNAD+、PARP-1、サーチュインの役割. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). NAD+の補充はPARP-1による解糖系の遮断と培養マウスアストロサイトの細胞死を防ぐ。 Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). 虚血性脳損傷における酸化ストレスとNAD+:現在の進歩と将来の展望。 Curr. Med. Chem. 17, 2152-2158.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J, Baur, J. A., and Imai, S. I. (2018)(2018). NAD+中間体:NMNとNRの生物学と治療の可能性. セル・メタブ. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. I. (2011). ニコチンアミドモノヌクレオチド、重要なNAD +中間体は、マウスのダイエットと年齢誘導糖尿病の病態生理を治療する。 Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al(2015)による。 ミスフォールドしたプリオンタンパク質によって誘発される神経細胞死はNAD+枯渇に起因し、in vitroおよびin vivoでNAD+補充により緩和されうる。 Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). NADHはアストロサイトに入り込み、PARP-1を介したアストロサイトの死をブロックすることができる。 Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., and Perry, G. (2007). アルツハイマー病における酸化ストレスの原因。 Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar