- Introduzione
- Materiali e metodi
- Partecipanti
- Standardizzazione della dieta
- Protocollo di infusione
- Raccolta dei campioni di sangue
- Raccolta dei campioni di urina
- Metodo analitico
- Sicurezza
- Analisi statistica
- Etica
- Risultati
- Sicurezza
- Plasma
- Urina
- Discussione
- Data Availability
- Dichiarazione etica
- Contributi degli autori
- Finanziamento
- Dichiarazione di conflitto di interessi
- Riconoscimenti
Introduzione
Il nucleotide piridinico capostipite, nicotinamide adenina dinucleotide (NAD+) è presente in tutte le cellule del corpo ed è essenziale per la vitalità e la funzione cellulare.
Come cofattore responsabile del trasporto di elettroni nella catena respiratoria, NAD+ e la sua coppia redox NADH sono centrali per la produzione di energia (ATP) nei mitocondri attraverso la fosforilazione ossidativa. Il metabolita fosforilato del NAD+, NADP+ con la sua coppia redox NADPH fornisce anche il potere riducente per guidare una serie di reazioni anaboliche, compresa la sintesi del colesterolo e degli acidi nucleici, l’allungamento degli acidi grassi e la rigenerazione del glutatione (GSH), uno dei principali antiossidanti del corpo. Nel complesso questa famiglia di nucleotidi piridinici, , contribuisce allo scambio redox di oltre 400 reazioni enzimatiche. È importante notare che quando agisce come coppia redox il NAD+ non viene consumato. Tuttavia, il NAD+ serve anche come substrato per una serie di altri importanti processi metabolici e viene quindi consumato come conseguenza delle loro reazioni chimiche, impoverendo potenzialmente il tessuto di NAD+. Sono incluse in questo numero le reazioni guidate dalla famiglia di enzimi poli adenosina fosforibosio-ribosio (ADPR) (PARP 1-17) che controllano la riparazione del DNA e la stabilità nucleare, gli enzimi di controllo epigenetico (Sirt1-7), la comunicazione immunitaria intercellulare (CD38/CD157) e la rigenerazione neuronale (SARM1; Essuman et al., 2017). Esiste quindi il potenziale per l’interruzione del metabolismo cellulare a più livelli in condizioni in cui il consumo di NAD+ da parte di questi enzimi supera la fornitura o la sintesi di NAD+.
L’importanza clinica del mantenimento dei livelli di NAD+ cellulare è stata stabilita all’inizio del secolo scorso con la scoperta che la pellagra, una malattia caratterizzata da diarrea, dermatite, demenza e morte, poteva essere curata con alimenti contenenti il precursore NAD+ niacina (nota anche come vitamina B3; Goldberger, 1914). Sebbene la pellagra sia rara nei paesi sviluppati, è stato dimostrato che le concentrazioni cellulari di NAD+ diminuiscono in condizioni di aumentato danno ossidativo, come accade durante l’invecchiamento (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Livelli alterati di NAD+ sono stati trovati per accompagnare diversi disturbi associati a un aumento del danno ossidativo/radicali liberi tra cui il diabete (Wu et al., 2016), malattie cardiache (Pillai et al., 2005), disfunzione vascolare legata all’età (Csiszar et al., 2019), lesioni cerebrali ischemiche (Ying e Xiong, 2010), proteine neuronali misfolded (Zhou et al, 2015) e demenza di Alzheimer (Abeti e Duchen, 2012).
Oltre ai tratti distintivi patologici delle placche Aβ e dei grovigli neurofibrillari tau, il danno ossidativo è un dato costante nella malattia di Alzheimer ed è ampiamente riconosciuto come un evento precoce nel processo patogenetico, anche precedente alla deposizione di Aβ (Su et al., 2008). Mentre le specie reattive dell’ossigeno (ROS) che causano questo danno provengono probabilmente da più fonti, i mitocondri disfunzionali e la disponibilità di metalli redox attivi come Fe++ e Cu+ si pensa giochino ruoli dominanti (Zhua et al., 2007).
Una conseguenza importante dello stress ossidativo cellulare, nel cervello e altrove, sono rotture a singolo o doppio filamento del DNA. In risposta al danno al DNA, PARP1 idrolizza NAD+ per produrre polimeri di ADP-ribosio (Ying, 2013). Abbiamo dimostrato in precedenza che i livelli di NAD+ erano inversamente correlati alle misure di stress ossidativo nei tessuti umani (Massudi et al., 2012) e nel cervello di ratto (Braidy et al., 2014). Quindi, mentre i livelli ridotti di NAD+ nel cervello dei malati di Alzheimer viventi attendono la conferma con tecniche non invasive, i risultati coerenti del danno ossidativo nel cervello post mortem supportano fortemente l’idea che il turnover accelerato e l’esaurimento di NAD+ contribuiscano alla disfunzione neurologica in questa malattia. Poiché gli interventi mirati al ripristino di NAD+ hanno dimostrato in modelli animali di sostenere l’invecchiamento sano e migliorare la funzione metabolica (Yoshino et al., 2011; Mills et al., 2016) e la demenza (Long et al., 2015), le strategie per aumentare i livelli di NAD+ nell’uomo sono attivamente esplorate.
Il metodo più diretto per aumentare i livelli di NAD+ è attraverso la somministrazione intravenosa (IV). Sebbene i dati della ricerca sperimentale siano minimi, il significativo beneficio clinico dell’infusione di NAD+ per via endovenosa nell’astinenza da alcol è stato precedentemente riportato (O’Holleran, 1961; Mestayer, 2019). Sorprendentemente, mentre la somministrazione orale di precursori di NAD+ come il riboside di nicotinamide (NR) o il mononucleotide di nicotinamide (NMN) vengono studiati con entusiasmo per il loro impatto sui livelli di NAD+ (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), il destino metabolico e le proprietà farmacocinetiche della somministrazione IV di NAD+ non sono ancora stati riportati nell’uomo. Questo studio, quindi, presenta per la prima volta i cambiamenti nelle concentrazioni di NAD+ e dei suoi metaboliti durante un’infusione IV di NAD+ in una coorte di partecipanti maschi sani.
Materiali e metodi
Partecipanti
Sono stati reclutati sette (Test n = 8, Controllo n = 3) partecipanti maschi di 30-55 anni tramite pubblicità su radio, TV e social media. Tutti i partecipanti avevano un BMI inferiore a 30 kg/m2 (Test BMI medio = 27,5 ± 2,5 kg/m2; Controllo BMI medio = 24,6 ± 6,5 kg/m2), non erano diabetici, fumavano meno di 1 sigaretta e consumavano meno di 2 bevande alcoliche standard al giorno. Sono stati esclusi dallo studio i soggetti che assumevano farmaci per la riduzione dei lipidi o antinfiammatori, che avevano una storia di insufficienza epatica o renale o che avevano recentemente subito un’infezione microbica, un trauma o qualsiasi altro disturbo medico significativo o non trattato. I soggetti hanno ricevuto un compenso in denaro per il loro tempo e la loro partecipazione, indipendentemente dal fatto che abbiano completato l’esperimento. I partecipanti non erano autorizzati a usare prodotti naturali per la salute contenenti NAD+, NR o Nicotinamide nei 14 giorni precedenti e durante il corso dello studio.
Standardizzazione della dieta
Il giorno prima dell’infusione IV di NAD+ i partecipanti hanno consumato una dieta identica, a basso contenuto di niacina e hanno bevuto solo acqua.
Nessun cibo è stato consumato il giorno dello studio fino a dopo la raccolta dell’ultimo campione di sangue/urina di 8 ore. I partecipanti sono stati incoraggiati a bere acqua per rimanere normalmente idratati. Non erano permessi altri tipi di bevande.
Per garantire un adeguato apporto energetico ai partecipanti durante le 6 ore di infusione, la soluzione IV conteneva anche lo 0,1% di destrosio, fornendo circa 2.000 calorie durante le 6 ore di infusione.
Protocollo di infusione
I partecipanti sono stati randomizzati al gruppo Test (n = 8) o Controllo (n = 3). Ai partecipanti del gruppo Test sono stati somministrati per via endovenosa 750 mg di NAD+ in soluzione fisiologica normale (Archway Apothecary, Covington, LA, USA) per un periodo di 6 ore (velocità di infusione = ~2 mg/min ≡ 3 μmoli/min). Questo dosaggio di NAD+ è stato derivato empiricamente e riflette un regime di dosaggio comune nelle cliniche (ad esempio, Springfield Wellness Clinic, Springfield, LA, USA) che forniscono regolarmente infusioni IV NAD+ nella pratica clinica. Ai partecipanti del gruppo di controllo è stata somministrata per via endovenosa una normale soluzione fisiologica per un periodo di 6 ore.
La somministrazione clinica e la supervisione delle infusioni endovenose e la raccolta dei campioni sono state effettuate presso lo Springfield Wellness Center, Springfield, LA, USA.
Raccolta dei campioni di sangue
I campioni di sangue di base (TO) sono stati raccolti su tutti i partecipanti dopo un digiuno notturno di 12 ore che doveva avvenire immediatamente prima dell’inizio dell’infusione. Ulteriori campioni sono stati poi raccolti a 30, 60, 120 (2 h), 360 (6 h) e 480 (8 h) minuti dopo l’inizio dell’infusione.
Il sangue intero è stato raccolto tramite venipuntura standard (braccio opposto al sito di infusione) in un tubo da 5 mL non gel eparinizzato. Subito dopo la raccolta, il sangue è stato centrifugato a 4°C per 10 minuti a 1.409× g.
Le frazioni di plasma e globuli rossi sono state immediatamente separate e distribuite in aliquote da 5 × 500 μL ciascuna. Tutte le aliquote sono state immediatamente congelate e conservate a -80°C fino all’analisi.
Raccolta dei campioni di urina
Dopo la raccolta di un campione intermedio di urina di base, ai partecipanti è stato chiesto di svuotare tutta l’urina nei recipienti forniti a 30 min, 2 h, 6 h e 8 h dopo l’inizio dell’infusione di NAD+. Se i partecipanti avevano bisogno di urinare a intermittenza tra questi punti, è stato chiesto loro di farlo nel recipiente successivo. Tutti i campioni sono stati aliquotati e conservati a -80°C immediatamente dopo il ricevimento.
Metodo analitico
Separazione cromatografica di NAD+ e dei relativi metaboliti e rilevamento MS La cromatografia liquida accoppiata alla spettrometria di massa tandem (LC/MS/MS) è stata effettuata utilizzando uno spettrometro di massa Sciex QTRAP 5500 (Sciex, Redwood City, CA, USA) come precedentemente descritto (Clement et al., 2018). Brevemente, 100 μL di plasma umano o urina sono stati estratti in 400 μL di metanolo ghiacciato, centrifugati a 4°C per 10 min e filtrati attraverso cartucce a membrana da 3 kDa. Gli estratti dei campioni sono stati essiccati sotto vuoto, ricostituiti in 200 μL di tampone NH4OAc 100 mM e trasferiti in fiale di vetro da 200 μL e tappati prima dell’analisi LC/MS/ MS. Standard e campioni (20 μL) sono stati iniettati su una colonna Phenomenex NH2 (150 mm- 2 mm- 3 mm) come precedentemente descritto. Un gradiente di solvente binario costituito da 5 mM NH4OAc pH 9,5 regolata con ammoniaca (fase mobile A) e acetonitrile (fase mobile B) con una velocità di flusso di 250 μL/min è stato utilizzato. Composizione iniziale del solvente all’iniezione era 25% A, seguita da un gradiente di 2 minuti al 45% A e una rampa di gradiente veloce al 80% A (0,1 min) che è stato mantenuto per 5,9 min, A è stato aumentato di nuovo al 95% (2 min), tenuto per 13 min, e poi tornò alle condizioni iniziali (0,1 min) per l’equilibrio, con un tempo totale di esecuzione di 30 min. Il flusso della colonna è stato diretto al rivelatore MS. Curve di calibrazione dei singoli metaboliti sono stati costruiti utilizzando i rapporti di area di picco (area di picco del metabolita diviso per area di picco del selezionato IS) di ogni calibratore contro la sua concentrazione.
Gli standard interni consistevano di 2H2NAM (per NAM, methylNAM e ADPR) e 13C5;-Cyclic AMP (per NMN e NAD +). Si noti che come etichette isotopiche non sono disponibili in commercio per tutti i metaboliti NAD, una molecola strettamente correlati (analogo strutturale) può anche essere utilizzato (Yamada et al., 2006) a condizione che è ritenuto di stabilità simile e l’efficienza di ionizzazione durante l’analisi. Gli standard interni selezionati in questo studio sono stati precedentemente ottimizzati per il relativo metabolita (Bustamante et al., 2017).
Sicurezza
La sicurezza di IV NAD+ è stata valutata utilizzando test di funzionalità epatica e osservazione clinica di eventuali eventi avversi. I test di funzionalità epatica consistevano in siero, bilirubina totale (bili), fosfatasi alcalina (ALP), alanina aminotransferasi (ALT), gamma glutamil transferasi (GGT), lattato deidrogenasi (LD) e aspartato aminotransferasi (AST).
Analisi statistica
L’analisi statistica è stata completata utilizzando SPSS versione 24 e GraphPad Prism versione 8 per windows. Una media non ponderata, ANOVA a due vie con test di confronto multiplo di Bonferroni è stata utilizzata per determinare se la concentrazione media per gli analisti testati fosse diversa durante il periodo di 8 ore e tra i gruppi Test e Controllo. Il test Wilcoxon Signed Ranks è stato utilizzato per determinare se le differenze nelle concentrazioni medie dei test di funzionalità epatica fossero significative tra i punti di riferimento e le 8 ore. Le differenze sono state considerate statisticamente significative quando p < 0,05.
Etica
Questo studio è stato condotto in conformità al Codice Etico dell’Associazione Medica Mondiale (Dichiarazione di Helsinki) per gli esperimenti che coinvolgono gli esseri umani. L’approvazione etica è stata ottenuta dal William Carey University Institutional Review Board, Hattiesburg, MS (Protocollo #2017-12). Consenso informato è stato ottenuto da tutti i partecipanti.
Risultati
Sicurezza
Nessun evento avverso è stato osservato durante l’infusione 6 h sia con placebo (salina) o test (NAD +) coorti.
Una diminuzione significativa dell’attività (1,3, 57, 3,6 unità/L) degli enzimi di funzionalità epatica GGT, LD e AST, rispettivamente, è stata osservata a 8 ore dall’inizio dell’infusione di NAD+ (Tabella 1). Nessun cambiamento significativo nell’attività di alcun marcatore di funzionalità epatica è stato evidente a 8 ore nei campioni trattati con placebo (soluzione salina), tuttavia il basso numero di campioni può ridurre la sensibilità alla discriminazione. È stato osservato anche un aumento significativo di 2,75 μmoles/L nella bilirubina plasmatica. Tuttavia, nessuno dei cambiamenti è stato considerato clinicamente significativo.

Tabella 1. Il test di Wilcoxon Signed Ranks è stato utilizzato per determinare se le differenze nelle concentrazioni medie dei test di funzionalità epatica erano significative tra il basale e i punti temporali di 8 ore.
Plasma
Un’infusione continua di NAD+ a una velocità di 3 μmoli/min ha portato a un aumento significativo (398%) dei livelli di NAD+ nel plasma solo al punto temporale di 6 ore (cioè, fine dell’infusione) rispetto al basale (p < 0.0001). Questo era significativamente diverso dal controllo trattato con soluzione salina 6 h (p < 0,001).
I livelli di NAD+ sono rimasti elevati a 8 h (cioè, 2 ore dopo l’infusione) rispetto alla linea di base e ai campioni di controllo trattati con soluzione salina.
I livelli plasmatici di NAD+ non sono cambiati significativamente dalla linea di base durante il periodo di valutazione di 8 ore nei campioni di controllo trattati con soluzione salina (Figura 1A).
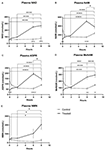
Figura 1. Variazioni nel plasma nicotinamide adenina dinucleotide (NAD+) e metaboliti nel corso di 8 ore. (A) NAD+, (B) Nicotinamide (NAM), (C) adenosina fosforibosio (ADPR), (D) nicotinamide metile (meNAM), (E) nicotinamide mononucleotide (NMN). *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, come indicato. ANOVA a due vie con test di confronto multiplo di Bonferroni post hoc è stato utilizzato per determinare se la concentrazione media per gli analisti testati erano diversi nel corso del periodo di 8 h e tra Test (n = 8) e controllo (n = 3) gruppi.
Simile ai cambiamenti osservati per NAD +, i livelli plasmatici del metabolita NAD + nicotinamide (NAM) aumentato significativamente del 409% alla fine del NAD + infusione (cioè, 6 h) rispetto alla linea di base (p < 0,0001). Questo era anche significativamente diverso dal controllo trattato con soluzione salina 6 h (p < 0.001).
Al punto di tempo 8 h (cioè, 2 h dopo la fine dell’infusione), i livelli di NAM tra il controllo e i gruppi trattati non erano più significativamente diversi (p > 0.05).
I livelli di NAM per i campioni di controllo trattati con soluzione salina non è cambiato significativamente attraverso il periodo di 8 h (p > 0.05, Figura 1B).
Consistente con i cambiamenti osservati per NAM, i livelli plasmatici del metabolita NAD+ ADPR sono aumentati significativamente del 393% alla fine dell’infusione di NAD+ (cioè, 6 ore) rispetto al basale (p < 0.0001). Questo era significativamente diverso dal controllo trattato con soluzione salina 6 h (p < 0.0001).
Al punto di tempo 8 h (cioè, 2 h dopo la fine dell’infusione), i livelli di ADPR sono rimasti 305% sopra il basale (p < 0.0001). Tuttavia, questo non era significativamente maggiore di ADPR livelli nei campioni di controllo trattati con soluzione salina allo stesso punto di tempo (p > 0,05).
livelli ADPR per i campioni di controllo trattati con soluzione salina non è cambiato significativamente attraverso il periodo di tempo 8 h (p > 0,05, Figura 1C).
Un’analisi di correlazione di Spearman tra le medie di gruppo attraverso i punti di tempo 8 h per i due metaboliti catabolici NAD +, NAM e ADPR, prodotto un coefficiente di correlazione di 1,00 (p < 0. 001).001).
Ancora una volta, coerente con i cambiamenti osservati per NAM, i livelli plasmatici del metabolita NAM, metil-nicotinamide (meNAM) aumentato significativamente al 350% alla fine dell’infusione NAD + (cioè, 6 h) rispetto sia alla linea di base (p < 0.0001) e il controllo trattato con soluzione salina 6 h (p < 0.01).
Al punto di tempo 8 h (cioè, 2 ore dopo la fine dell’infusione) i livelli di meNAM sono rimasti il 393% sopra la linea di base (p < 0.0001) e significativamente maggiore rispetto ai campioni di controllo trattati con soluzione salina allo stesso punto temporale (p < 0.05).
i livelli di NAM per i campioni di controllo trattati con soluzione salina non sono cambiati significativamente attraverso il periodo di tempo 8 h (p > 0,05, Figura 1D).
i livelli plasmatici di NMN, un metabolita di NAM attraverso la via di salvataggio anabolizzante, era significativamente elevato (472%) solo al punto di tempo 8 h (cioè, 2 ore dopo la fine dell’infusione, p < 0,05).
I livelli di NMN per i campioni di controllo trattati con soluzione salina non sono cambiati significativamente nel periodo di tempo di 8 ore (p > 0,05, Figura 1E).
Urina
L’infusione continua IV di NAD+ ad un tasso di 3 μmoles/min ha portato ad un significativo (538%) aumento del tasso di escrezione urinaria NAD+ al punto di tempo 6 h (cioè, fine dell’infusione) rispetto a quella escreta a 30 min (p < 0,001). Questo era anche significativamente diverso dalla quantità di NAD+ urinario escreto a 6 h dai controlli trattati con soluzione salina (p < 0,05).
La quantità di NAD+ escreta nelle urine è diminuita del 43% (p < 0,05) a 8 h (cioè, 2 h post-infusione) rispetto al picco di escrezione al punto di tempo 6 h.
Il tasso di escrezione urinaria per NAD + non è cambiato significativamente attraverso il periodo di valutazione 8 h nei campioni di controllo trattati con soluzione salina (Figura 2A).

Figura 2. Variazioni di NAD+ e metaboliti nelle urine nel corso di 8 h (1a 6 h consistente in una continua, 3 μmoles/min, NAD+ IV infusione). (A) NAD +, (B) NAM, (C) meNAM. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, come indicato. ANOVA a due vie con test di confronto multiplo di Bonferroni post hoc è stato utilizzato per determinare se la concentrazione media per gli analisti testati erano diversi nel corso del periodo di 8 ore e tra Test (n = 8) e controllo (n = 3) gruppi.
Il tasso di escrezione del metabolita NAD+ NAM non è cambiato significativamente durante il periodo di prova di 8 ore e non era diverso dal tasso di escrezione NAM osservato per i controlli trattati con soluzione salina (Figura 2B).
Il tasso di escrezione urinaria del metabolita NAM meNAM è stato significativamente aumentato (403%) al punto temporale 6 h (cioè, fine dell’infusione) rispetto a quello osservato a 30 min (p < 0,01). La quantità di meNAM escreta nelle urine è diminuita del 43% (p < 0,05) a 8 h (cioè, 2 ore dopo l’infusione) rispetto al picco di escrezione al punto di tempo di 6 ore.
Il tasso di escrezione urinaria per meNAM non è cambiato significativamente nel periodo di valutazione di 8 ore nei controlli trattati con soluzione salina (Figura 2C).
Discussione
Un interesse crescente nelle terapie basate sul NAD+, comprese le infusioni di NAD+, ha evidenziato la necessità di una comprensione più chiara del destino del NAD+ e dei suoi metaboliti dopo la somministrazione endovenosa. Lo studio attuale documenta i cambiamenti nei livelli di NAD+ e dei principali metaboliti sia nel plasma che nelle urine nel corso di 8 ore utilizzando un tipico regime di dosaggio clinico di 750 mg di NAD+ somministrato per via endovenosa in un periodo di 6 ore.
Importante è il fatto che l’infusione di NAD+ non ha prodotto alcun evento avverso osservabile nella coorte di test, ma piuttosto ha ridotto le attività plasmatiche degli enzimi indicativi dello stress epatico come il LD e l’AST intraepatici e l’enzima GGT post-epatico (dotti biliari), suggerendo che l’integrità del tessuto intraepatico e post-epatico è stata migliorata anche nel periodo relativamente breve di 8 ore. L’aumento della bilirubina, un prodotto di degradazione dei globuli rossi, a 8 ore può riflettere sia un aumento molto piccolo del turnover dei globuli rossi, come può verificarsi a causa dell’emolisi indotta dall’infusione, sia un ridotto metabolismo dell’eme (Tabella 1). Tuttavia, data l’entità molto bassa di questo cambiamento, questo non è stato considerato clinicamente rilevante.
Come previsto, nei partecipanti trattati con soluzione salina (cioè, controllo), i livelli plasmatici di NAD + e metaboliti NAM e ADPR e i metaboliti NAM, NMN e meNAM è rimasto essenzialmente invariato durante il periodo di 8 ore. Tuttavia, una diminuzione apparente in NAM, meNAM e ADPR sono stati osservati tra 30 min e 6 h, molto probabilmente a causa di un effetto di diluizione salina. Coerentemente con questa nozione, i valori di questi analiti sono stati visti per tornare ai livelli di base a 8 h (cioè, 2 h dopo la fine dell’infusione salina).
Inaspettatamente però nei partecipanti infusi di NAD+, i livelli plasmatici di NAD+ non sono riusciti a salire fino a dopo il punto di tempo 2 h, raggiungendo un massimo di ~ 400% sopra la linea di base per NAD+ e metaboliti NAM, meNAM e ADPR (398%, 409%, 393%, rispettivamente) solo al punto di tempo 6 h (Figure 1A-E). Questo era internamente coerente con il picco di escrezione urinaria sia per NAD + e meNAM anche verificarsi a 6 h prima di diminuire rapidamente dopo la fine dell’infusione (figure 2A-C).
NAD + è stato infuso ad un tasso costante di 3 μmoli/min. Pertanto 90 μmoli di NAD + è stato infuso direttamente nel compartimento vascolare ogni 30 min fornendo un totale di 1.080 μmoli entro la fine dell’infusione a 6 h. Intravascolare miscelazione da qualsiasi punto di infusione si verifica entro ~ 2 min, assumendo un volume medio del sangue di 5, il NAD aggiunto +, in assenza di metabolismo significativo o di assorbimento, corrisponderebbe ad un aumento supplementare in (NAD +) di almeno 18 μM, ogni 30 min attraverso il 6 h di infusione. Mentre un aumento di questa entità è ben all’interno dei limiti di rilevamento analitico di questo studio nessun aumento di NAD + o dei suoi metaboliti, sono stati osservati fino a dopo 2 h (cioè, al punto di tempo 6 h) nel plasma o nelle urine. Questa osservazione inaspettata indica un rapido e, almeno per le prime 2 ore, un completo assorbimento e/o metabolismo tissutale di NAD+ e/o dei suoi metaboliti.
Un certo numero di enzimi può realizzare un efficace catabolismo del NAD+, comprese le sirtuine (SIRTs 1-7) le adenosina difosfato (ADP)-ribosio transferasi (ARTs) e le polimerasi (PARPs 1-17) e le ADP-ribosio ciclico (cADPR) sintetasi (CD38, CD157). Le pirofosfatasi extracellulari del NAD+ presenti nel siero umano possono anche degradare il NAD+ in AMP e NMN (Schmidt-Brauns et al., 2001). La proteina CD73 sulla superficie cellulare converte anche NMN in NR, che attraversa facilmente le membrane cellulari per una potenziale risintesi a NAD+. È importante notare che le glicoidrolasi catabolizzatrici di NAD+, CD38 e CD157, l’ecto-nucleotide pirofosfatasi (CD203a) e il catabolizzatore di NMN CD73 sono ectoenzimi che si trovano su un’ampia varietà di cellule tra cui cellule linfoidi, granulocitarie, neuronali ed endoteliali (Wei et al., 2014) e possono essere presenti anche glicoidrolasi NAD solubili nel plasma (Figura 3; Funaro et al., 2009). L’aumento parallelo di plasma NAM e ADPR (coefficiente di correlazione di 1.000, p < 0.001, dati non mostrati) suggerisce fortemente che almeno da 6 h un destino principale di NAD + è il metabolismo attraverso la scissione del legame glicosidico ADPribose-nicotinamide a NAM e ADPR, sottoprodotti sintomatici di NAD glicoidrolasi (ad esempio, CD38) attività. Questo è coerente con l’evidenza di altri dove CD38, in particolare, ha dimostrato di avere un ruolo primario nel controllo dei livelli extracellulari di NAD+ (Wei et al., 2014). Gli eritrociti umani adulti sono CD38 positivi ed esprimono alti livelli di attività di NAD+ glicoidrolasi, scindendo il NAD+ esogeno per fornire agli eritrociti ADP ribosio che può essere efficientemente assunto nella cellula (Kim et al., 1993; Albeniz et al., 2004). L’assenza di qualsiasi aumento di NAD+ o di metaboliti, nel plasma o nelle urine, fino a dopo le prime 2 ore dell’infusione indica che NAD+ e/o i suoi metaboliti sono trasportati fuori dallo spazio vascolare extracellulare e sequestrati in modo efficiente nei compartimenti tissutali o extravascolari come NAD+ e/o i suoi metaboliti durante questo periodo di tempo.

Figura 3. Potenziale catabolismo extracellulare di NAD+ fornito esogenamente attraverso l’attività degli ectoenzimi CD38 (ADP-ribosio (ADPR) sintasi), CD203a (NAD+ pirofosfatasi), CD 73 (5′-nucleotidasi), CD157-ADP-ribosil ciclasi 2. Abbreviazioni: NAM, nicotinammide; NMN, nicotinammide mononucleotide; ADPR, adenosina difosfato riboside; meNAM, nicotinammide metile; 4PY, N-metil-4-piridone-3-carbossamide; 2PY, metil-2-piridone-5-carbossamide; ARPP, ADP ribosio pirofosfatasi; RPPK, ribosil pirofosfochinasi; NAmpt, nicotinamide fosforibosiltransferrasi; NMNAT, nicotinamide mononucleotideadeniltransferasi; CX-43, connexin 43.
Anche se PARP e le sirtuine sono coinvolte nel catabolismo del NAD+, come enzimi intracellulari con rappresentanti nel citoplasma, nel nucleo e nei mitocondri, è improbabile che abbiano un impatto diretto sui livelli extracellulari di NAD+. Tuttavia, ci si può aspettare che questi enzimi rispondano ai cambiamenti nelle concentrazioni intracellulari di NAD+, NAM e NR che possono derivare da NAD+ fornito esogenamente. La figura 4 riassume schematicamente i possibili destini del NAD+ esogeno.
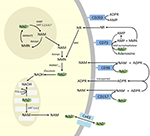
Figura 4. Potenziale destino intra ed extracellulare del NAD+ fornito esogenamente. Abbreviazioni: CD38 , CD203a (NAD+ pirofosfatasi), CD 73 (5′-nucleotidasi). NAM, nicotinammide; NMN, nicotinammide mononucleotide; ADPR, adenosina difosfato riboside; meNAM, nicotinammide metile; 4PY, N-metil-4-piridone-3-carbossamide; 2PY, metil-2-piridone-5-carbossamide; ARPP, ADP ribosio pirofosfatasi; RPPK, ribosil pirofosfochinasi; NAmpt, nicotinamide fosforibosiltransferrasi; NMNAT, nicotinamide mononucleotideadeniltransferasi; PARP ; NRK .
Mentre esiste una capacità significativa per la rapida degradazione del NAD+ IV fornito esogenamente nei metaboliti costituenti, vale anche la pena notare che l’assorbimento del NAD+ extracellulare può anche avvenire. Poiché il NAD+ ha una carica negativa complessiva, non è in grado di attraversare passivamente le membrane cellulari e quindi deve essere trasportato attivamente attraverso la membrana. Che ciò avvenga è stato dimostrato da diversi ricercatori che hanno riportato che il NAD+ esogeno applicato a una varietà di tipi di cellule umane provoca effettivamente un aumento significativo del NAD+ intracellulare (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Mentre i meccanismi coinvolti non sono ancora completamente caratterizzati, Alano et al. (2010) hanno riferito che il NAD+ esogeno potrebbe entrare nei neuroni attraverso i canali P2X7 gated e altri hanno costantemente osservato il trasporto di NAD+ attraverso le membrane attraverso gli emicanali della connexina 43 (CX43), anche a concentrazioni basse come 250 pM (Billington et al., 2008). Poiché le connexine hanno un’ampia distribuzione nei tessuti umani e CX43 sembra essere la connexina più ubiquitaria in molti tipi di cellule, il potenziale per un rapido assorbimento di NAD+ non può essere escluso.
Quindi l’assorbimento cellulare e/o il metabolismo di NAD+ e dei metaboliti NAM e ADPR e dei metaboliti secondari meNAM e NMN sembra procedere al ritmo dell’infusione di NAD+ da 3 μmoli/min per almeno le prime 2 ore. O NAD+ e/o i metaboliti primari testati vengono sequestrati in modo efficiente durante questo primo periodo di 2-6 ore o si formano anche metaboliti secondari. ADPR può essere riciclato per produrre NAD + da NAM (Figura 4) o ulteriormente metabolizzato attraverso ectoenzimi come CD203a (NAD + pirofosfatasi) per produrre AMP che può essere ulteriormente rapidamente metabolizzato in adenosina da CD73 un 5′-nucleotidasi (Bogan e Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). A sostegno di questa ipotesi, un aumento dei livelli di adenosina nel sangue è stato riconosciuto da altri come conseguenza dell’infusione di NAD+ extracellulare (Szczepañska-Konkel et al., 2003). NAM può anche essere metabolizzato a NMN attraverso la via di salvataggio prima della risintesi a NAD+ (Figure 3, 4) o agito da metiltransferasi epatiche per produrre N1-metilnicotinamide che può essere escreto direttamente o ulteriormente convertito a N-metil-2-piridone-5-carbossamide (2PY, +99% di meNAM) e N-metil-4-piridone-3-carbossamide (4PY, ~0.25% di meNAM) prima dell’escrezione (Shibata e Matsuo, 1989; Okamoto et al, 2003).
È evidente che al regime di dosaggio utilizzato i meccanismi coinvolti nel metabolismo e sequestro di NAD+ e metaboliti hanno raggiunto la saturazione qualche volta dopo 2 ore con conseguente elevazione significativa del plasma NAD+ e accumulo di tutti i metaboliti testati (NMA, ADPR, meNAM e NMN) a 6 ore. Come accennato in precedenza, questi dati supportano l’idea che uno dei principali percorsi per il metabolismo di NAD+ in queste condizioni sia la scissione del legame glicosidico, da parte di ectoenzimi come il CD38 per produrre NAM e ADPR. Tuttavia, l’aumento del NMN plasmatico dopo 2 h suggerisce anche che il NAD+ esogeno è probabilmente agito da pirofosfatasi extracellulari NAD+, elevando il NMN plasmatico e rilasciando AMP come metabolita supplementare.
In sintesi, questo studio ha rivelato per la prima volta che: (a) ad una velocità di flusso di 3 μmole/min tutto il NAD+ infuso esogenamente è stato rapidamente e completamente rimosso dal plasma per almeno le prime 2 ore; (b) l’aumento dei bi-prodotti metabolici analizzati è coerente con le glicoidrolasi NAD+ e l’attività della pirofosfatasi NAD+; e (c) i prodotti di escrezione urinaria derivanti dall’infusione di NAD+ includono NAD+ nativo e meNAM ma non NAM.
Sebbene i risultati di questa indagine siano nuovi e vadano in qualche modo a far progredire la nostra comprensione del destino temporizzato del NAD+ esogeno nell’uomo, sono stati identificati dei limiti. Per migliorare il calcolo metabolico complessivo, gli studi futuri dovrebbero indagare i cambiamenti nel NAD+ e nei metaboliti delle cellule rosse e l’escrezione urinaria dei metaboliti secondari di meNAM, 2PY e 4PY. Inoltre, sarà probabilmente utile valutare l’impatto del NAD+ esogeno sui cambiamenti nel metabolismo delle purine che dovrebbe includere almeno la valutazione dell’AMP e dell’adenosina nel plasma e nei globuli rossi. L’uso di modelli animali può anche aiutare a chiarire il coinvolgimento relativo delle varie vie metaboliche attraverso l’uso di inibitori farmacologici adatti e il campionamento dei tessuti.
In conclusione, questo studio è stato in grado di rivelare per la prima volta alcune informazioni molto utili, precedentemente sconosciute, sul destino del NAD+ esogeno per via endovenosa nell’uomo, tra cui, la sicurezza generale e la tollerabilità di un’infusione endovenosa di NAD+ a un tasso di 3 μmoli/min, il rapido sequestro di NAD+ dal plasma, il probabile contributo di entrambe le glicoidrolasi NAD+ e l’attività del pirofosfato NAD+ nel metabolismo di NAD+ e l’apparente efficiente riassorbimento tubulare renale di NAM. Tuttavia sono necessarie ulteriori ricerche per rivelare completamente il complesso destino metabolico di questa importante molecola. Inoltre, la caratterizzazione di questi cambiamenti aiuterà a progredire nello sviluppo e nel miglioramento dei regimi di trattamento basati sul NAD+ per i disturbi che probabilmente beneficeranno di una maggiore disponibilità di NAD+, comprese le condizioni che richiedono una maggiore rigenerazione e riparazione cellulare come l’Alzheimer e altre demenze neurodegenerative.
Data Availability
I set di dati generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Dichiarazione etica
Gli studi che hanno coinvolto partecipanti umani sono stati rivisti e approvati dal William Carey University Institutional Review Board, Hattiesburg, MS (Protocol #2017-12). I pazienti/partecipanti hanno fornito il loro consenso informato scritto per partecipare a questo studio.
Contributi degli autori
RG ha partecipato alla progettazione e supervisione dello studio, alla discussione critica e alla paternità del manoscritto. JBer ha partecipato alla progettazione dello studio, alla discussione critica, alla raccolta dei dati, all’analisi statistica, alla stesura e alla revisione del manoscritto. RM ha partecipato al disegno dello studio, alla discussione critica, alla supervisione clinica e alla revisione del manoscritto. NB ha partecipato all’analisi biochimica e alla revisione del manoscritto. JW ha partecipato alla progettazione dello studio, alla discussione critica e alla revisione del manoscritto. JBen ha partecipato alla raccolta dei dati e alla revisione del manoscritto. SB ha partecipato alla progettazione dello studio e alla revisione del manoscritto. Tutti gli autori hanno rivisto, letto e approvato la versione finale del manoscritto, e sono d’accordo con l’ordine di presentazione degli autori.
Finanziamento
Questo studio è stato finanziato congiuntamente dalla NAD+ Research Inc, (LA, USA) e dall’Australasian Research Institute Incorporation (Sydney, Australia) ed è stato condotto presso lo Springfield Wellness Center, Springfield, LA, USA.
Dichiarazione di conflitto di interessi
RM è un direttore della NAD+ Research Inc. e direttore medico dello Springfield Wellness Center che utilizza il NAD per via endovenosa come terapia clinica. SB ha ricevuto onorari di consulenza da NAD+ Research Inc.
I restanti autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Si ringrazia Archway Apothecary Pty Limited, LA, USA per la fornitura gratuita di IV NAD+ per questo progetto.
Abeti, R., e Duchen, M. R. (2012). Attivazione di PARP da stress ossidativo indotto da β-amiloide: implicazioni per la malattia di Alzheimer. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Uno studio in aperto, non randomizzato della farmacocinetica del supplemento nutrizionale nicotinamide riboside (NR) e dei suoi effetti sui livelli ematici di NAD+ in volontari sani. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., e Swanson, R. A. (2010). Deplezione NAD + è necessario e sufficiente per PARP-1 mediata morte neuronale. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., e Bermek, E. (2004). Attività di NAD glicoidrolasi e assorbimento di adp-ribosio in eritrociti di soggetti normali e pazienti con cancro. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Caratterizzazione dell’assorbimento di NAD+ in cellule di mammifero. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., e Brenner, C. (2010). 5′-nucleotidasi e i loro nuovi ruoli nel metabolismo di NAD+ e fosfato. Nuovo J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., e Grant, R. (2011). Età relativi cambiamenti nel metabolismo NAD + stress ossidativo e sirt1 attività in ratti wistar. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Mappatura NAD + metabolismo nel cervello di ratti Wistar invecchiamento: potenziali obiettivi per influenzare la senescenza del cervello. Biogerontologia 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Quantificare il metaboloma cellulare NAD + utilizzando un approccio di cromatografia liquida tandem spettrometria di massa. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., e Braidy, N. (2018). Il metaboloma NAD+ del plasma è disregolato nell’invecchiamento “normale”. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Ruolo della carenza di NAD+ endoteliale nella disfunzione vascolare legata all’età. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., e Milbrandt, J. (2017). Il dominio del recettore SARM1 toll/interleukin-1 possiede un’attività intrinseca di scissione del NAD+ che promuove la degenerazione assonale patologica. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., e Chiarugi, A. (2013). Approfondimento delle proprietà molecolari e funzionali di NMNAT3 rivela nuovi suggerimenti di omeostasi NAD all’interno dei mitocondri umani. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. Ectoenzimi e immunità innata: il ruolo del CD157 umano nel traffico dei leucociti. Fronte. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). L’eziologia della Pellagra: il significato di alcune osservazioni epidemiologiche rispetto ad essa. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Cambiamenti nel danno ossidativo, infiammazione e con l’età nel liquido cerebrospinale. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). L’adenosina generata nella nicchia del midollo osseo attraverso una via mediata da CD38 correla con la progressione del mieloma umano. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Funzione di NAD glicoidorlasi nell’assorbimento di ADP-ribosio dagli eritrociti umani. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., e Schuh, R. A. (2015). Effetto della nicotinamide mononucleotide sui deficit respiratori mitocondriali del cervello in un modello murino rilevante per la malattia di Alzheimer. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. Cambiamenti associati all’età nello stress ossidativo e nel metabolismo di NAD+ nei tessuti umani. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Addiction the Dark Night of the Soul, NAD+ la luce della speranza. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). La somministrazione a lungo termine di nicotinamide mononucleotide mitiga il declino fisiologico associato all’età nei topi. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). Il ruolo della generazione di adenosina extracellulare nello sviluppo delle malattie autoimmuni. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN nella prevenzione, diagnosi e trattamento delle dipendenze da droghe. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. Variazioni diurne nell’escrezione urinaria umana di cataboliti di nicotinamide: effetti dello stress sul metabolismo della nicotinamide. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., and Gupta, M. P. (2005). Poly (ADP-ribosio) polimerasi-1-dipendente morte cellulare dei miociti cardiaci durante l’insufficienza cardiaca è mediata dalla deplezione NAD + e ridotta attività deacetilasi Sir2α. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. Effetti farmacologici del NAD esogeno sulla bioenergetica mitocondriale, riparazione del DNA e apoptosi. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., e Reidl, J. (2001). Un’attività di pirofosfatasi NAD è necessaria per la moltiplicazione di Haemophilus influenzae tipo b nel flusso sanguigno? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., e Matsuo, H. (1989). Correlazione tra l’assunzione di niacina equivalente e l’escrezione urinaria dei suoi metaboliti, N’-methylnicotinamide, N’-methyl-2-pyridone-5-carboxamide e N’-methyl-4-pyridone-3-carboxamide, in esseri umani che consumano un cibo auto-selezionato. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. Segnalazione di stress ossidativo nella malattia di Alzheimer. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). Emodinamica renale e risposte natriuretiche alla somministrazione endovenosa di diadenosina tetrafosfato (ap4a) e nicotinamide adenina dinucleotide (NAD) nel ratto. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., e Yue, J. (2014). Ruoli e meccanismi della via di segnalazione CD38/ciclo adenosina difosfato ribosio/Ca2+. Mondo J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). Fonti e implicazioni dello squilibrio redox NADH/NAD+ nel diabete e nelle sue complicanze. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., e Tsuchiya, M. (2006). La misura simultanea di nicotinamide adenina dinucleotide e composti correlati mediante cromatografia liquida/spettrometria di massa tandem a ionizzazione elettrospray. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Ruoli di NAD +, PARP-1, e sirtuine nella morte cellulare, danno cerebrale ischemico, e la radiazione di sincrotrone a raggi X lesioni tissutali indotte. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., e Swanson, R. A. (2003). NAD + rifornimento impedisce PARP-1 indotta blocco glicolitico e la morte cellulare in astrociti di topo in coltura. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Stress ossidativo e NAD + nel danno cerebrale ischemico: progressi attuali e prospettive future. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). Intermedi NAD+: la biologia e il potenziale terapeutico di NMN e NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). Nicotinamide mononucleotide, un intermedio chiave NAD +, tratta la fisiopatologia del diabete indotto dalla dieta e dall’età nei topi. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Morte neuronale indotta da proteina prionica mal piegata è dovuto alla deplezione NAD + e può essere alleviato in vitro e in vivo da NAD + ricostituzione. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., e Ying, W. (2005). NADH può entrare in astrociti per bloccare PARP-1-mediata morte degli astrociti. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., e Perry, G. (2007). Cause di stress ossidativo nella malattia di Alzheimer. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar