- Introduction
- Anyagok és módszerek
- Résztvevők
- Diéta standardizálása
- Infúziós protokoll
- Vérmintagyűjtés
- Húgyminta gyűjtése
- Analitikai módszer
- Biztonság
- Statisztikai elemzés
- Etika
- Eredmények
- Biztonság
- Plazma
- Urin
- Diszkusszió
- Adatok elérhetősége
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Finanszírozás
- Érdekellentétről szóló nyilatkozat
- Köszönet
Introduction
The parent pyridine nucleotide, nicotinamide adenine dinucleotide (NAD+) is present in all cells of the body and is essential for cell viability and function.
A légzési láncba történő elektrontranszportért felelős kofaktorként a NAD+ és redoxpárja, a NADH központi szerepet játszik a mitokondriumokban az oxidatív foszforiláción keresztül történő energiatermelésben (ATP). A NAD+ foszforilált metabolitja, a NADP+ és redoxpárja, a NADPH szintén redukáló erőt biztosít számos anabolikus reakcióhoz, beleértve a koleszterin- és nukleinsavszintézist, a zsírsavak nyúlását és a szervezet egyik fő antioxidánsának, a glutationnak (GSH) a regenerálódását. Összességében a piridin-nukleotidok e családja, , több mint 400 enzimreakció redoxi cseréjéhez járul hozzá. Fontos, hogy amikor redoxpárként működik, a NAD+ nem fogy el. A NAD+ azonban számos más fontos anyagcsere-folyamat szubsztrátjaként is szolgál, ezért kémiai reakcióik következményeként elfogy, ami a szövetek NAD+-ellátottságát potenciálisan csökkentheti. Ebbe a körbe tartoznak a DNS-javítást és a nukleáris stabilitást irányító poliadenozin-foszforibóz-ribóz (ADPR) enzimcsalád (PARP 1-17), az epigenetikai szabályozó enzimek (Sirt1-7), a sejtek közötti immunkommunikáció (CD38/CD157) és a neuronális regeneráció (SARM1; Essuman et al., 2017) által vezérelt reakciók. Fennáll tehát a lehetőség a sejtek anyagcseréjének több szinten történő megzavarására olyan körülmények között, amikor az említett enzimek NAD+-fogyasztása meghaladja a NAD+-ellátást vagy szintézist.
A sejtek NAD+-szintjének fenntartása klinikai jelentőségét a múlt század elején állapították meg azzal a felfedezéssel, hogy a pellagra, a hasmenéssel, bőrgyulladással, demenciával és halállal járó betegség gyógyítható a NAD+ prekurzor niacint (más néven B3-vitamin; Goldberger, 1914) tartalmazó élelmiszerekkel. Bár a pellagra a fejlett országokban ritka, kimutatták, hogy a NAD+ sejtkoncentrációja csökken olyan fokozott oxidatív károsodással járó körülmények között, mint amilyenek az öregedés során jelentkeznek (Braidy és mtsai., 2011; Massudi és mtsai., 2012; Guest és mtsai., 2014). A NAD+ megváltozott szintje számos, fokozott oxidatív/szabadgyökös károsodással járó rendellenességet kísér, beleértve a cukorbetegséget (Wu et al., 2016), a szívbetegséget (Pillai et al., 2005), az életkorral összefüggő érrendszeri diszfunkciót (Csiszar et al., 2019), az ischaemiás agykárosodást (Ying és Xiong, 2010), a félregördült neuronális fehérjéket (Zhou et al., 2015) és az Alzheimer-demencia (Abeti és Duchen, 2012).
Az Aβ-plakkok és a neurofibrilláris tau-tangulák patológiai jellemzői mellett az oxidatív károsodás következetes lelet az Alzheimer-kórban, és széles körben elismert, hogy a patogén folyamat korai, akár az Aβ lerakódását megelőző eseménye (Su és mtsai., 2008). Bár az ezt a károsodást okozó reaktív oxigénfajok (ROS) valószínűleg több forrásból származnak, a mitokondriumok diszfunkcionális működése és a redox-aktív fémek, például a Fe++ és Cu+ elérhetősége feltehetően domináns szerepet játszik (Zhua és mtsai., 2007).
A sejtek oxidatív stresszének egyik fő következménye az agyban és máshol is a DNS egy- vagy kétszálú törései. A DNS-károsodásra válaszul a PARP1 hidrolizálja a NAD+-ot, hogy ADP-ribóz polimereket állítson elő (Ying, 2013). Korábban kimutattuk, hogy a NAD+ szintje fordítottan korrelál az oxidatív stressz mérésével emberi szövetekben (Massudi és mtsai., 2012) és patkány agyban (Braidy és mtsai., 2014). Így, bár a NAD+ csökkent szintje az élő Alzheimer-kórban szenvedők agyában még nem invazív technikákkal történő megerősítésre vár, a post mortem agyban észlelt oxidatív károsodás következetes megállapításai erősen alátámasztják azt a nézetet, hogy a felgyorsult NAD+ forgalom és kimerülés hozzájárul a betegség neurológiai diszfunkciójához. Mivel a NAD+ helyreállítására irányuló beavatkozásokról állatmodellekben kimutatták, hogy támogatják az egészséges öregedést és javítják a metabolikus funkciókat (Yoshino et al., 2011; Mills et al., 2016) és a demenciát (Long et al., 2015), aktívan kutatják a NAD+ szint emelésére irányuló stratégiákat az emberben.
A NAD+ szint növelésének legközvetlenebb módszere az intravénás (IV) beadás. Bár a kísérleti kutatásokból származó adatok minimálisak, korábban már beszámoltak az IV NAD+ infúzió jelentős klinikai előnyéről alkoholelvonásban (O’Holleran, 1961; Mestayer, 2019). Meglepő módon, míg a NAD+ prekurzorok, például a nikotinamid ribozid (NR) vagy a nikotinamid mononukleotid (NMN) orális beadását lelkesen vizsgálják a NAD+ szintre gyakorolt hatásuk szempontjából (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), az IV NAD+ beadás metabolikus sorsáról és farmakokinetikai tulajdonságairól még nem számoltak be emberekben. Ez a tanulmány ezért először mutatja be a NAD+ és metabolitjai koncentrációjának változásait a NAD+ intravénás infúziója során egészséges férfi résztvevők egy kohorszában.
Anyagok és módszerek
Résztvevők
Tizenegy (teszt n = 8, kontroll n = 3) 30-55 év közötti férfi résztvevőt toboroztak rádiós, televíziós és közösségi média hirdetéseken keresztül. Minden résztvevőnek 30 kg/m2 alatti volt a testtömegindexe (Teszt átlagos testtömegindexe = 27,5 ± 2,5 kg/m2; Kontroll átlagos testtömegindexe = 24,6 ± 6,5 kg/m2), nem voltak cukorbetegek, 1 cigarettánál kevesebbet dohányoztak és napi 2 szokásos alkoholos italnál kevesebbet fogyasztottak. A vizsgálatból kizárták azokat a személyeket, akik lipidcsökkentő vagy gyulladáscsökkentő gyógyszereket szedtek, akiknek a kórtörténetében máj- vagy veseelégtelenség szerepelt, vagy nemrégiben mikrobiális fertőzésen, traumán vagy bármilyen más jelentős vagy kezeletlen egészségügyi rendellenességen estek át. Az alanyok pénzbeli kompenzációt kaptak idejükért és részvételükért, függetlenül attól, hogy befejezték-e a kísérletet. A résztvevők nem használhattak NAD+, NR vagy nikotinamid tartalmú természetes egészségügyi termékeket a vizsgálatot megelőző 14 napon belül és a vizsgálat során.
Diéta standardizálása
A NAD+ infúziót megelőző napon a résztvevők azonos niacin-csökkentett étrendet fogyasztottak és csak vizet ittak.
A vizsgálat napján a 8 órás utolsó vér-/vizeletmintavételig nem fogyasztottak ételt. A résztvevőket arra ösztönözték, hogy igyanak vizet, hogy normálisan hidratáltak maradjanak. Más típusú italok fogyasztása nem volt megengedett.
A 6 órás infúzió alatt a résztvevők megfelelő energiabevitelének biztosítása érdekében az infúziós oldat 0,1% dextrózt is tartalmazott, ami körülbelül 2000 kalóriát biztosított a 6 órás infúziós időszak alatt.
Infúziós protokoll
A résztvevőket randomizálták a teszt (n = 8) vagy a kontroll (n = 3) csoportba. A Teszt csoport résztvevőinek intravénásan 750 mg NAD+-t adtak normál sóoldatban (Archway Apothecary, Covington, LA, USA) 6 órán keresztül (infúziós sebesség = ~2 mg/perc ≡ 3 μmol/perc). A NAD+ e dózisát empirikusan származtattuk, és az olyan klinikákon (pl. Springfield Wellness Clinic, Springfield, LA, USA) szokásos adagolási rendet tükrözi, amelyek a klinikai gyakorlatban rendszeresen biztosítanak intravénás NAD+ infúziót. A kontrollcsoport résztvevőinek 6 órán keresztül intravénásan normál sóoldatot adtak.
A klinikai beadás, az intravénás infúziók és a mintavétel felügyelete a Springfield Wellness Centerben (Springfield, LA, USA) történt.
Vérmintagyűjtés
A vérminták bázis (TO) gyűjtése minden résztvevőnél egy éjszakai 12 órás koplalás után történt, közvetlenül az infúzió megkezdése előtt. Ezt követően további mintákat vettek 30, 60, 120 (2 óra), 360 (6 óra) és 480 (8 óra) perccel az infúzió megkezdése után.
A teljes vért normál vénás punkcióval vették (az infúzió helyével ellentétes karon) egy 5 ml-es, nem géles heparinizált csőbe. Közvetlenül a vérvétel után a vért 4°C-on 10 percig 1 409× g-n centrifugáltuk.
A plazma- és vörösvérsejtfrakciókat azonnal szétválasztottuk, és egyenként 5 × 500 μl-es aliquotokra osztottuk. Ezután minden aliquotot azonnal lefagyasztottunk, és az elemzésig -80°C-on tároltunk.
Húgyminta gyűjtése
A kiindulási vizeletminta gyűjtése után a résztvevőket arra kértük, hogy a NAD+ infúzió megkezdése után 30 perccel, 2 órával, 6 órával és 8 órával ürítsék ki az összes vizeletet a rendelkezésre bocsátott tartály(ok)ba. Ha a résztvevőknek ezen időpontok között időközönként vizeletet kellett üríteniük, arra kérték őket, hogy ezt a következő, egymást követő tartályba tegyék. Minden mintát a beérkezést követően azonnal aliquotáltunk és -80°C-on tároltunk.
Analitikai módszer
A NAD+ és a kapcsolódó metabolitok kromatográfiás elválasztása és MS kimutatása A tandem tömegspektrometriával kapcsolt folyadékkromatográfiát (LC/MS/MS) egy Sciex QTRAP 5500 tömegspektrométer (Sciex, Redwood City, CA, USA) segítségével végeztük a korábban leírtak szerint (Clement et al., 2018). Röviden, 100 μL humán plazmát vagy vizeletet 400 μL jéghideg metanolban extraháltunk, 4°C-on 10 percig centrifugáltuk, majd 3 kDa membránbetéteken keresztül szűrtük. A mintakivonatokat vákuumban megszárítottuk, 200 μL 100 mM NH4OAc pufferben visszaállítottuk, majd az LC/MS/ MS elemzés előtt 200 μL-es üvegfiolákba töltöttük és lezártuk. A standardokat és a mintákat (20 μL) Phenomenex NH2 oszlopra (150 mm- 2 mm- 3 mm) injektáltuk a korábban leírtak szerint. Egy bináris oldószergradienst használtunk, amely 5 mM NH4OAc pH 9,5 ammóniával beállított pH-értékéből (mozgófázis A) és acetonitrilből (mozgófázis B) állt, 250 μL/perc áramlási sebességgel. Az oldószer kezdeti összetétele az injektáláskor 25% A volt, ezt követte egy 2 perces gradiens 45% A-ig, majd egy gyors gradiens rámpa 80% A-ig (0,1 perc), amelyet 5,9 percig tartottunk, az A-t ismét 95%-ra növeltük (2 perc), 13 percig tartottuk, majd egyensúlyozás céljából visszaálltunk a kezdeti körülményekre (0,1 perc), a teljes futási idő 30 perc volt. Az oszlop áramlását az MS-detektorba irányítottuk. Az egyes metabolitok kalibrációs görbéit az egyes kalibrátorok csúcsterület-arányainak (a metabolit csúcsterülete osztva a kiválasztott IS csúcsterületével) és koncentrációjának függvényében állítottuk fel.
A belső standardok 2H2NAM (NAM, metilNAM és ADPR esetében) és 13C5;-Cyclic AMP (NMN és NAD+ esetében) voltak. Megjegyzendő, hogy mivel nem minden NAD-metabolithoz állnak rendelkezésre izotópos jelölések a kereskedelemben, egy közeli rokon molekula (szerkezeti analóg) is használható (Yamada és mtsai., 2006), feltéve, hogy az elemzés során hasonló stabilitásúnak és ionizációs hatékonyságúnak tekinthető. Az ebben a vizsgálatban kiválasztott belső standardokat korábban a rokon metabolitra optimalizálták (Bustamante és mtsai., 2017).
Biztonság
Az IV NAD+ biztonságosságát májfunkciós tesztek és az esetleges nemkívánatos események klinikai megfigyelése alapján értékeltük. A májfunkciós tesztek a szérum, az összes bilirubin (bili), az alkalikus foszfatáz (ALP), az alanin-aminotranszferáz (ALT), a gamma-glutamil-transzferáz (GGT), a laktát-dehidrogenáz (LD) és az aszpartát-aminotranszferáz (AST) vizsgálatából álltak.
Statisztikai elemzés
A statisztikai elemzést az SPSS 24-es verziójával és a GraphPad Prism 8-as verziójával végeztük Windows számára. Súlyozatlan átlagok, kétirányú ANOVA-t használtunk Bonferroni többszörös összehasonlító post hoc teszttel annak meghatározására, hogy a vizsgált analitikusok átlagos koncentrációja különbözik-e a 8 órás időszak alatt, valamint a teszt- és a kontrollcsoportok között. A Wilcoxon Signed Ranks tesztet használtuk annak meghatározására, hogy a májfunkciós tesztek átlagos koncentrációinak különbségei szignifikánsak-e a kiindulási és a 8 órás időpontok között. A különbségeket statisztikailag szignifikánsnak tekintettük, ha p < 0,05.
Etika
Ezt a vizsgálatot az Orvosi Világszövetség etikai kódexének (Helsinki Nyilatkozat) megfelelően végeztük az embereken végzett kísérletekre vonatkozóan. Az etikai jóváhagyást a William Carey University Institutional Review Boardtól (Hattiesburg, MS) szereztük be (Protocol #2017-12). Minden résztvevőtől tájékozott beleegyezést kaptunk.
Eredmények
Biztonság
A 6 órás infúzió során sem a placebo (sóoldat), sem a teszt (NAD+) kohorszoknál nem észleltek mellékhatásokat.
A NAD+ infúzió megkezdése után 8 órával a májfunkciós enzimek GGT, LD és AST aktivitásának jelentős csökkenését (1,3, 57, 3,6 egység/L) figyelték meg (1. táblázat). A placebóval (sóoldattal) kezelt mintákban 8 órakor egyik májfunkciós marker aktivitásában sem volt szignifikáns változás, azonban a minták alacsony száma csökkentheti a diszkriminációs érzékenységet. A plazma bilirubin 2,75 μmol/l-es szignifikáns emelkedése is megfigyelhető volt. Azonban egyik változás sem tekinthető klinikailag szignifikánsnak.

Táblázat 1

. A Wilcoxon Signed Ranks tesztet használtuk annak meghatározására, hogy a májfunkciós tesztek átlagos koncentrációinak különbségei szignifikánsak-e a kiindulási és a 8 órás időpontok között.
Plazma
A NAD+ 3 μmol/perc sebességű folyamatos infúziója csak a 6 órás időpontban (azaz az infúzió végén) eredményezte a plazma NAD+ szintjének szignifikáns (398%-os) emelkedését a kiindulási értékhez képest (p < 0,0001). Ez szignifikánsan különbözött a 6 órás sóoldattal kezelt kontrolltól (p < 0,001).
A NAD+ szintek 8 órakor is emelkedettek maradtak (azaz, 2 órával az infúzió után) a kiindulási értékhez és a sóoldattal kezelt kontrollmintákhoz képest.
A plazma NAD+-szintje nem változott jelentősen a kiindulási értékhez képest a 8 órás értékelési időszak alatt a sóoldattal kezelt kontrollmintákban (1A. ábra).
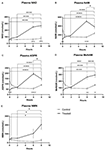
1. ábra. A plazma nikotinamid-adenin-dinukleotid (NAD+) és metabolitok változásai 8 óra alatt . (A) NAD+, (B) nikotinamid (NAM), (C) adenozin-foszforibóz (ADPR), (D) metil-nikotinamid (meNAM), (E) nikotinamid-mononukleotid (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, ahogy jelezve. Kétirányú ANOVA-t használtunk Bonferroni többszörös összehasonlító post hoc teszttel annak meghatározására, hogy a vizsgált analitok átlagos koncentrációja különbözik-e a 8 órás időtartam alatt, valamint a teszt (n = 8) és a kontroll (n = 3) csoportok között.
A NAD+ esetében megfigyelt változásokhoz hasonlóan a NAD+ metabolit nikotinamid (NAM) plazmaszintje is jelentősen, 409%-kal nőtt a NAD+ infúzió végén (ill, 6 óra) a kiindulási értékhez képest (p < 0,0001). Ez szintén szignifikánsan különbözött a 6 órás sóoldattal kezelt kontrolltól (p < 0,001).
A 8 órás időpontban (azaz 2 órával az infúzió befejezése után) a NAM-szintek a kontroll és a kezelt csoportok között már nem különböztek szignifikánsan (p > 0,05).
A sóoldattal kezelt kontroll minták NAM-szintje nem változott szignifikánsan a 8 órás időtartam alatt (p > 0,05, 1B ábra).
A NAM esetében megfigyelt változásokkal összhangban a NAD+ metabolit ADPR plazmaszintje a NAD+ infúzió végén (azaz 6 órán belül) a kiindulási értékhez képest jelentősen, 393%-kal emelkedett (p < 0,0001). Ez szignifikánsan különbözött a 6 órás sóoldattal kezelt kontrolltól (p < 0,0001).
A 8 órás időpontban (azaz 2 órával az infúzió befejezése után) az ADPR szintje 305%-kal maradt a kiindulási szint felett (p < 0,0001). Ez azonban nem volt szignifikánsan nagyobb, mint a sóoldattal kezelt kontroll minták ADPR-szintje ugyanebben az időpontban (p > 0,05).
A sóoldattal kezelt kontroll minták ADPR-szintje nem változott szignifikánsan a 8 órás időtartam alatt (p > 0,05, 1C ábra).
A Spearman-féle korrelációs elemzés a csoportátlagok között a két NAD+ katabolikus metabolit, a NAM és az ADPR esetében a 8 órás időpontok között 1,00 korrelációs együtthatót eredményezett (p < 0.001).
A NAM esetében megfigyelt változásokkal összhangban a NAM metabolit, a metil-nikotinamid (meNAM) plazmaszintje is jelentősen, 350%-ra emelkedett a NAD+ infúzió végére (azaz, 6 óra) mind a kiindulási értékhez (p < 0,0001), mind a 6 órás sóoldattal kezelt kontrollhoz képest (p < 0,01).
A 8 órás időpontban (azaz: 6 óra), 2 órával az infúzió befejezése után) a meNAM-szintek 393%-kal maradtak a kiindulási szint felett (p < 0,0001), és szignifikánsan nagyobbak voltak, mint a sóoldattal kezelt kontroll minták ugyanebben az időpontban (p < 0,05).
A sóoldattal kezelt kontroll minták meNAM-szintje nem változott szignifikánsan a 8 órás időtartam alatt (p > 0,05, 1D ábra).
A NAM anabolikus mentési útvonalon keresztül a NAM metabolitjának, az NMN-nek a plazmaszintje csak a 8 órás időpontban emelkedett szignifikánsan (472%) (ill, 2 órával az infúzió befejezése után, p < 0,05).
A sóoldattal kezelt kontroll minták NMN-szintje nem változott jelentősen a 8 órás időtartam alatt (p > 0,05, 1E ábra).
Urin
A NAD+ folyamatos, 3 μmol/perc sebességű intravénás infúziója a vizelet NAD+-kiválasztási arányának jelentős (538%-os) növekedését eredményezte a 6 órás időpontban (ill, infúzió vége) a 30 percben ürített mennyiséghez képest (p < 0,001). Ez szintén szignifikánsan különbözött a 6 órakor a vizelettel ürített NAD+ mennyiségétől a sóoldattal kezelt kontrolloknál (p < 0,05).
A vizelettel ürített NAD+ mennyisége 43%-kal (p < 0,05) csökkent 8 órakor (ill, 2 órával az infúzió után) a 6 órás időpontban mért csúcskiválasztáshoz képest.
A NAD+ vizeletkiválasztási aránya nem változott jelentősen a 8 órás értékelési időszak alatt a sóoldattal kezelt kontroll mintákban (2A ábra).

2. ábra. A vizelet NAD+ és metabolitjainak változása 8 óra alatt (az első 6 óra folyamatos, 3 μmol/perc NAD+ intravénás infúzióból állt). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, ahogy jelezve. Kétirányú ANOVA-t használtunk Bonferroni többszörös összehasonlítás post hoc tesztjével annak meghatározására, hogy a vizsgált elemzők átlagos koncentrációja különbözik-e a 8 órás időszak alatt, valamint a teszt (n = 8) és a kontroll (n = 3) csoportok között.
A NAD+ metabolit NAM kiválasztási aránya nem változott jelentősen a 8 órás vizsgálati időszak alatt, és nem különbözött a sóoldattal kezelt kontrolloknál megfigyelt NAM-kiválasztási aránytól (2B ábra).
A NAM-metabolit meNAM vizelet-kiválasztási aránya szignifikánsan (403%-kal) megnőtt a 6 órás időpontban (ill, infúzió vége) a 30 percben megfigyelt értékhez képest (p < 0,01). A vizelettel kiválasztódó meNAM mennyisége 43%-kal csökkent (p < 0,05) a 8 órás (azaz, 2 órával az infúzió után) a 6 órás időpontban mért csúcskiválasztáshoz képest.
A meNAM vizeletkiválasztási aránya nem változott jelentősen a 8 órás értékelési időszak alatt a sóoldattal kezelt kontrolloknál (2C ábra).
Diszkusszió
A NAD+ alapú terápiák iránti növekvő érdeklődés, beleértve a NAD+ infúziókat is, rávilágított arra, hogy tisztábban kell érteni a NAD+ és metabolitjai sorsát az intravénás beadást követően. A jelenlegi vizsgálat a NAD+ és a legfontosabb metabolitok szintjének változásait dokumentálja mind a plazmában, mind a vizeletben 8 óra alatt, egy tipikus klinikai adagolási séma, 750 mg NAD+ intravénás beadásával 6 órán keresztül.
Fontos, hogy a NAD+ infúziója nem okozott semmilyen megfigyelhető mellékhatást a vizsgálati kohorszban, hanem csökkentette a májstresszre utaló enzimek, mint az intrahepatikus LD és AST, valamint a poszthepatikus (epevezeték) GGT enzim plazma aktivitását, ami arra utal, hogy a viszonylag rövid 8 órás időtartam alatt is fokozódott mind a hepatikus, mind a poszthepatikus szövetek integritása. A bilirubin, a vörösvértestek bomlásterméke, 8 órán belüli emelkedése vagy a vörösvértestek forgalmának nagyon kis mértékű növekedését tükrözheti, ami az infúzió által kiváltott hemeolízis miatt fordulhat elő, vagy a csökkent heme-metabolizmust (1. táblázat). Tekintettel azonban ennek a változásnak a nagyon alacsony nagyságrendjére, ezt nem tekintettük klinikailag relevánsnak.
Amint az várható volt, a sóoldattal kezelt (azaz kontroll) résztvevőknél a NAD+ és a NAM és ADPR metabolitok, valamint a NAM metabolitok, az NMN és a meNAM plazmaszintje lényegében változatlan maradt a 8 órás időtartam alatt. A 30 perc és 6 óra között azonban a NAM, a meNAM és az ADPR nyilvánvaló csökkenése volt megfigyelhető, ami valószínűleg a sóoldat hígító hatásának köszönhető. Ezzel az elképzeléssel összhangban ezen analitok értékei 8 órán belül visszatértek a kiindulási szintre (azaz, 2 órával a sóoldat-infúzió befejezése után).
Váratlanul azonban a NAD+ infúzióban részesülőknél a plazma NAD+ szintje nem emelkedett a 2 órás időpont utánig, és csak a 6 órás időpontban érte el a kiindulási szint feletti ~400%-os maximumot a NAD+ és a NAM, meNAM és ADPR metabolitok esetében (398%, 409%, 393%, illetve) (1A-E ábra). Ez belsőleg összhangban volt azzal, hogy mind a NAD+, mind a meNAM vizeletkiválasztásának csúcsa szintén 6 órakor következett be, majd az infúzió befejezése után gyorsan csökkent (2A-C ábrák).
A NAD+-t állandó, 3 μmol/perc sebességgel infundáltuk. Ezért 30 percenként 90 μmol NAD+ került közvetlenül az érrendszeri kompartmentbe, ami az infúzió végére, 6 órára összesen 1080 μmolt eredményezett. Az intravaszkuláris keveredés az infúzió bármely pontjáról ~2 perc alatt következik be; 5 átlagos vérmennyiséget feltételezve, a hozzáadott NAD+ jelentős metabolizmus vagy felszívódás hiányában a (NAD+) legalább 18 μM további emelkedésének felel meg 30 percenként a 6 órás infúzió során. Bár egy ilyen mértékű növekedés jóval a vizsgálat analitikai kimutatási határán belül van, sem a NAD+, sem a metabolitjainak növekedése nem volt megfigyelhető 2 óra elteltéig (azaz a 6 órás időpontig) sem a plazmában, sem a vizeletben. Ez a váratlan megfigyelés a NAD+ és/vagy metabolitjainak gyors, és legalább az első 2 órában teljes szöveti felvételére és/vagy metabolizmusára utal.
Egy sor enzim képes hatékony NAD+ katabolizmust elérni, köztük a szirtuinok (SIRT 1-7) az adenozin-difoszfát (ADP)-ribóz transzferázok (ART) és poli(ADP-ribóz) polimerázok (PARP 1-17) és a ciklikus ADP-ribóz (cADPR) szintázok (CD38, CD157). A humán szérumban jelen lévő extracelluláris NAD+ pirofoszfatázok szintén képesek a NAD+-t AMP-re és NMN-re lebontani (Schmidt-Brauns és mtsai., 2001). A sejtfelszíni CD73 fehérje szintén átalakítja az NMN-t NR-é, amely könnyen átjut a sejtmembránokon, hogy esetlegesen újra NAD+ -ra szintetizálódjon. Fontos, hogy a NAD+ katabolizáló glikohidrolázok, a CD38 és CD157, az ekto-nukleotid pirofoszfatáz (CD203a) és az NMN katabolizáló CD73 ektoenzimek a sejtek széles skáláján megtalálhatóak, beleértve a limfoid, granulocita, neuronális és endotél sejteket (Wei et al., 2014), és a plazmaoldható NAD glikohidrolázok is jelen lehetnek (3. ábra; Funaro et al., 2009). A plazma NAM és ADPR párhuzamos emelkedése (1,000-es korrelációs együttható, p < 0,001, az adatok nem láthatóak) erősen arra utal, hogy legalább 6 órára a NAD+ egyik fő sorsa az anyagcsere a glikozidos ADPribóz-nikotinamid kötés NAM-ra és ADPR-ra történő hasítása révén, a NAD-glikohidroláz (pl. CD38) aktivitásra jellemző melléktermékek. Ez összhangban van a mások által nyert bizonyítékokkal, ahol különösen a CD38-nak elsődleges szerepe van az extracelluláris NAD+ szint szabályozásában (Wei és mtsai., 2014). A felnőtt humán eritrociták CD38 pozitívak és magas szintű NAD+ glikohidroláz aktivitást fejeznek ki, amely az exogén NAD+-ot hasítja, hogy az eritrocitákat a sejtbe hatékonyan felvehető ADP ribózzal lássa el (Kim et al., 1993; Albeniz et al., 2004). A NAD+ vagy a metabolitok emelkedésének hiánya a plazmában vagy a vizeletben az infúzió első 2 órája utánig azt jelzi, hogy a NAD+ és/vagy metabolitjai az extracelluláris érrendszeri térből kiáramlanak, és ebben az időszakban NAD+ és/vagy metabolitjaik formájában hatékonyan szekvenálódnak a szöveti vagy extravaszkuláris kompartmentekbe.

3. ábra. Az exogén módon adagolt NAD+ potenciális extracelluláris katabolizmusa a CD38 (ADP-ribóz (ADPR) szintáz), CD203a (NAD+ pirofoszfatáz), CD 73 (5′-nukleotidáz), CD157-ADP-ribozil-cikláz 2 ektoenzimek aktivitásán keresztül. Rövidítések: NAM, nikotinamid; NMN, nikotinamid-mononukleotid; ADPR, adenozin-difoszfát ribozid; meNAM, metil-nikotinamid; 4PY, N-metil-4-piridon-3-karboxamid; 2PY, metil-2-piridon-5-karboxamid; ARPP, ADP ribóz-pirofoszfatáz; RPPK, ribozilpirofoszfokináz; NAmpt, nikotinamid-foszforibozil-transzferráz; NMNAT, nikotinamid-mononukleotidadenil-transzferáz; CX-43, connexin 43.
A PARP és a szirtuinok ugyan részt vesznek a NAD+ katabolizmusában, de intracelluláris enzimként, amelyeknek képviselői a citoplazmában, a sejtmagban és a mitokondriumban vannak, nem valószínű, hogy közvetlenül befolyásolják az extracelluláris NAD+-szintet. Várható azonban, hogy ezek az enzimek reagálnak a NAD+, NAM és NR intracelluláris koncentrációjának változásaira, amelyek az exogén módon adagolt NAD+ hatására keletkezhetnek. A 4. ábra vázlatosan összefoglalja az exogén NAD+ lehetséges sorsát.
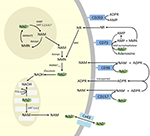
4. ábra. Az exogén módon adagolt NAD+ potenciális intracelluláris és extracelluláris sorsa. Rövidítések: CD38 , CD203a (NAD+ pirofoszfatáz), CD 73 (5′-nukleotidáz). NAM, nikotinamid; NMN, nikotinamid-mononukleotid; ADPR, adenozin-difoszfát ribozid; meNAM, metil-nikotinamid; 4PY, N-metil-4-piridon-3-karboxamid; 2PY, metil-2-piridon-5-karboxamid; ARPP, ADP ribóz-pirofoszfatáz; RPPK, ribozilpirofoszfokináz; NAmpt, nikotinamid-foszforibozil-transzferráz; NMNAT, nikotinamid-mononukleotidadenil-transzferáz; PARP ; NRK .
Míg jelentős kapacitás áll rendelkezésre az exogén módon adagolt IV NAD+ gyors lebontására az alkotó metabolitokra, azt is érdemes megjegyezni, hogy az extracelluláris NAD+ felvétele is előfordulhat. Mivel a NAD+ összességében negatív töltéssel rendelkezik, nem képes passzívan áthaladni a sejtmembránokon, ezért aktívan kell a membránon keresztül szállítani. Hogy ez megtörténik, azt számos kutató kimutatta, akik arról számoltak be, hogy a különböző humán sejttípusokhoz alkalmazott exogén NAD+ valóban az intracelluláris NAD+ jelentős emelkedését eredményezi (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Bár az érintett mechanizmus(ok) még nem teljesen jellemzett(ek), Alano és munkatársai (2010) arról számoltak be, hogy az exogén NAD+ a P2X7 kapucsatornákon keresztül juthat be az idegsejtekbe, mások pedig következetesen megfigyelték a NAD+ membránokon keresztüli szállítását a connexin 43 (CX43) hemicsatornákon keresztül, akár 250 pM-os koncentrációban is (Billington és munkatársai, 2008). Mivel a konnxinok széles körben elterjedtek az emberi szövetekben, és úgy tűnik, hogy a CX43 a legelterjedtebb konnxin számos sejttípusban, nem lehet kizárni a NAD+ gyors felvételének lehetőségét.
A NAD+ és a metabolitok NAM és ADPR, valamint a másodlagos metabolitok meNAM és NMN celluláris felvétele és/vagy metabolizmusa tehát úgy tűnt, hogy legalább az első 2 órában a 3 μmol/perc NAD+-infúzióval párhuzamosan zajlik. Az ADPR újrahasznosítható NAD+ előállítására NAM-ból (4. ábra) vagy tovább metabolizálható ektoenzimeken keresztül, mint például a CD203a (NAD+ pirofoszfatáz) AMP előállítására, amelyet a CD73 a 5′-nukleotidáz további gyors metabolizálhat adenozinná (Bogan és Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). E hipotézis alátámasztására mások a vér adenozinszintjének növekedését ismerték fel az extracelluláris NAD+ infúzió következményeként (Szczepañska-Konkel és mtsai., 2003). A NAM a mentési útvonalon keresztül NMN-é is metabolizálódhat, mielőtt újraszintetizálódik NAD+ -ra (3., 4. ábra), vagy a hepatikus metiltranszferázok hatására N1-metil-nikotinamid keletkezik, amely vagy közvetlenül kiválasztódik, vagy tovább alakulhat N-metil-2-piridon-5-karboxamiddá (2PY, a meNAM +99%-a) és N-metil-4-piridon-3-karboxamiddá (4PY, ~0.25%-a meNAM), mielőtt kiválasztódna (Shibata és Matsuo, 1989; Okamoto et al., 2003).
Nyilvánvaló, hogy az alkalmazott adagolási séma mellett a NAD+ és a metabolitok metabolizmusában és szekvenálásában részt vevő mechanizmusok valamikor 2 óra után elérték a telítettséget, ami a plazma NAD+ jelentős emelkedéséhez és az összes vizsgált metabolit (NMA, ADPR, meNAM és NMN) 6 órán belüli felhalmozódásához vezetett. Amint korábban említettük, ezek az adatok alátámasztják azt a nézetet, hogy a NAD+ metabolizmus egyik fő útvonala ilyen körülmények között a glikozidos kötés hasítása az ektoenzimek, például a CD38 által, NAM és ADPR előállítása céljából. A plazma NMN 2 óra utáni emelkedése azonban arra is utal, hogy az exogén NAD+-ra valószínűleg extracelluláris NAD+ pirofoszfatázok hatnak, emelve a plazma NMN-t és felszabadítva AMP-t mint további metabolitot.
Összefoglalva, ez a vizsgálat első alkalommal mutatta ki, hogy: (a) 3 μmol/perc áramlási sebesség mellett az összes exogén módon infundált NAD+ gyorsan és teljesen eltávolodott a plazmából legalább az első 2 órában; (b) az elemzett metabolikus bi-termékek növekedése összhangban van a NAD+ glikohidrolázok és a NAD+ pirofoszfatáz aktivitásával; és (c) a NAD+ infúzióból származó vizeletkiválasztási termékek között natív NAD+ és meNAM, de nem NAM található.
Míg e vizsgálat eredményei újszerűek, és valamennyire előreviszik az exogén NAD+ emberben történő időzített sorsának megértését, korlátokat is azonosítottak. Az általános metabolikus számítások javítása érdekében a jövőbeni vizsgálatokban vizsgálni kell a vörösvérsejtek NAD+ és metabolitjainak változásait, valamint a másodlagos meNAM-metabolitok, a 2PY és a 4PY vizeletkiválasztását. Ezenkívül valószínűleg hasznos lesz értékelni az exogén NAD+ hatását a purin metabolizmus változásaira, aminek legalább a plazma és a vörösvérsejt AMP és adenozin értékelését magában kell foglalnia. Az állatmodellek használata megfelelő farmakológiai gátlók és szövetmintavétel révén segíthet tisztázni a különböző metabolikus útvonalak relatív részvételét.
Összefoglalva, ez a vizsgálat először tudott feltárni néhány nagyon hasznos, korábban ismeretlen információt az exogén IV NAD+ emberi sorsáról, beleértve a 3 μmol/perc sebességű IV NAD+ infúzió általános biztonságosságát és tolerálhatóságát, a NAD+ gyors szekvenálása a plazmából, a NAD+ glikohidroláz és a NAD+ pirofoszfát aktivitás valószínű hozzájárulása a NAD+ metabolizmusához és a NAM nyilvánvalóan hatékony vesetubuláris reabszorpciója. További kutatásokra van azonban szükség e fontos molekula összetett metabolikus sorsának teljes feltárásához. Továbbá, e változások jellemzése segíteni fogja a NAD+ alapú kezelések fejlesztését és javítását olyan rendellenességek esetében, amelyek valószínűleg profitálnak a megnövekedett NAD+ elérhetőségből, beleértve a fokozott sejtregenerációt és -javítást igénylő állapotokat, mint például az Alzheimer-kór és más neurodegeneratív demenciák.
Adatok elérhetősége
A tanulmányhoz létrehozott adatkészletek a megfelelő szerzőtől kérésre rendelkezésre állnak.
Etikai nyilatkozat
A humán résztvevőkkel végzett vizsgálatokat a William Carey University Institutional Review Board (Hattiesburg, MS) felülvizsgálta és jóváhagyta (Protocol #2017-12). A betegek/résztvevők írásbeli tájékozott beleegyezésüket adták a vizsgálatban való részvételhez.
A szerzők hozzájárulása
RG részt vett a vizsgálat tervezésében és felügyeletében, a kritikai vitában és a kézirat szerzőségében. JBer részt vett a tanulmánytervezésben, a kritikai vitában, az adatgyűjtésben, a statisztikai elemzésben, a kézirat szerkesztésében és a kézirat átnézésében. RM részt vett a tanulmánytervezésben, a kritikai vitában, a klinikai felügyeletben és a kézirat átnézésében. NB részt vett a biokémiai elemzésben és a kézirat felülvizsgálatában. JW részt vett a vizsgálat tervezésében, a kritikai vitában és a kézirat felülvizsgálatában. JBen részt vett az adatgyűjtésben és a kézirat felülvizsgálatában. SB részt vett a vizsgálat tervezésében és a kézirat felülvizsgálatában. Minden szerző átnézte, elolvasta és jóváhagyta a kézirat végleges változatát, és egyetért a szerzők előadásának sorrendjével.
Finanszírozás
Ezt a vizsgálatot a NAD+ Research Inc. közösen finanszírozta, (LA, USA) és az Australasian Research Institute Incorporation (Sydney, Ausztrália) finanszírozta, és a Springfield Wellness Centerben (Springfield, LA, USA) végezték.
Érdekellentétről szóló nyilatkozat
RM a NAD+ Research Inc. igazgatója és a Springfield Wellness Center orvosi igazgatója, amely klinikai terápiaként IV NAD-ot alkalmaz. SB tanácsadói díjat kapott a NAD+ Research Inc.-től.
A többi szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végeztük, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
Köszönjük az Archway Apothecary Pty Limited, LA, USA ingyenes IV NAD+-ellátását a projekthez.
Abeti, R., és Duchen, M. R. (2012). A PARP aktiválása a β-amyloid által kiváltott oxidatív stressz által: következmények az Alzheimer-kórra nézve. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Nyílt, nem randomizált vizsgálat a nikotinamid ribozid (NR) táplálékkiegészítő farmakokinetikájáról és a vér NAD+ szintjére gyakorolt hatásáról egészséges önkéntesekben. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). A NAD+ kimerülés szükséges és elegendő a PARP-1 által közvetített neuronális halálhoz. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). NAD-glikohidroláz aktivitások és adp-ribóz felvétel normál alanyok és rákos betegek eritrocitáiban. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). A NAD+ felvétel jellemzése emlős sejtekben. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-nukleotidázok és új szerepük a NAD+ és a foszfát anyagcserében. New J. Chem. 34, 845-853. doi: 10.1039/b9njj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). A NAD+ anyagcsere oxidatív stressz és a sirt1 aktivitás korral összefüggő változásai wistar patkányokban. PLoS One 6:e19194. doi: 10.1371/journal.pone.001919194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). A NAD+ anyagcsere feltérképezése öregedő Wistar patkányok agyában: potenciális célpontok az agyi öregedés befolyásolására. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). A celluláris NAD+ metabolizmus számszerűsítése tandem folyadékkromatográfiás tömegspektrometriás megközelítéssel. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). A plazma NAD+ metabolizmusa diszregulált a “normális” öregedés során. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Az endothelialis NAD+ hiány szerepe az életkorral összefüggő érrendszeri diszfunkcióban. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., and Milbrandt, J. (2017). A SARM1 útdíj/interleukin-1 receptor doménje saját NAD+ hasító aktivitással rendelkezik, amely elősegíti a patológiás axonális degenerációt. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., and Chiarugi, A. (2013). Az NMNAT3 molekuláris és funkcionális tulajdonságainak megismerése új utalásokat tár fel a NAD homeosztázisra a humán mitokondriumokban. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ektoenzimek és veleszületett immunitás: a humán CD157 szerepe a leukociták mozgásában. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). A Pellagra etiológiája: egyes epidemiológiai megfigyelések jelentősége ezzel kapcsolatban. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Az oxidatív károsodás, a gyulladás és a kor előrehaladtával bekövetkező változásai az agy-gerincvelői folyadékban. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). A CD38 által közvetített útvonalon keresztül a csontvelői niche-ben keletkező adenozin korrelál a humán myeloma progressziójával. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Functionof NAD glycohydorlase in ADP-ribose uptake from human erythrocytes. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). A nikotinamid-mononukleotid hatása az agyi mitokondriális légzési hiányosságokra egy Alzheimer-kórral kapcsolatos egérmodellben. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Az oxidatív stressz és a NAD+ anyagcsere korral összefüggő változásai emberi szövetekben. PLoS One 7:e42357. doi: 10.1371/journal.pone.004235357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). A lélek sötét éjszakájának függősége, a NAD+ a remény fénye. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). A nikotinamid-mononukleotid hosszú távú adagolása enyhíti az életkorral összefüggő élettani hanyatlást egerekben. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). Az extracelluláris adenozin-termelés szerepe az autoimmun betegségek kialakulásában. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN a kábítószerfüggőségek megelőzésében, diagnózisában és kezelésében. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). A nikotinamid-katabolitok emberi vizeletkiválasztásának napszakos változásai: a stressz hatása a nikotinamid metabolizmusára. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., and Gupta, M. P. (2005). A poli(ADP-ribóz) polimeráz-1-függő szívizomsejtes sejthalált szívelégtelenség során a NAD+ kimerülés és a csökkent Sir2α deacetiláz aktivitás közvetíti. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Az exogén NAD farmakológiai hatásai a mitokondriális bioenergetikára, a DNS-javításra és az apoptózisra. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., and Reidl, J. (2001). Szükséges-e egy NAD pirofoszfatáz aktivitás a Haemophilus influenzae b típusú szaporodásához a véráramban? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., and Matsuo, H. (1989). A niacin-egyenértékű bevitel és metabolitjainak, az N’-metil-nikotinamidnak, az N’-metil-2-piridon-5-karboxamidnak és az N’-metil-4-piridon-3-karboxamidnak a vizeletkiválasztása közötti korreláció egy önelválasztott élelmiszert fogyasztó emberekben. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Oxidatív stressz jelátvitel az Alzheimer-kórban. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). A vese hemodinamikája és natriuretikus válaszok diadenozin-tetrafoszfát (ap4a) és nikotinamid-adenin-dinukleotid (NAD) intravénás adására patkányban. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). A CD38/ciklikus adenozin-difoszfát ribóz/Ca2+ jelátviteli útvonal szerepe és mechanizmusai. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). A NADH/NAD+ redox egyensúlyhiány forrásai és következményei a cukorbetegségben és szövődményeiben. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., and Tsuchiya, M. (2006). A nikotinamid-adenin-dinukleotid és rokon vegyületek egyidejű mérése folyadékkromatográfiás/elektrospray ionizációs tandem tömegspektrometriával. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). A NAD+, a PARP-1 és a sirtuinok szerepe a sejthalálban, az iszkémiás agykárosodásban és a szinkrotron sugárzás röntgensugarak által kiváltott szöveti sérülésben. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). A NAD+ feltöltés megakadályozza a PARP-1 által kiváltott glikolitikus blokkolást és sejthalált tenyésztett egér asztrocitákban. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Oxidatív stressz és NAD+ az ischaemiás agykárosodásban: jelenlegi előrelépések és jövőbeli kilátások. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). NAD + intermedierek: az NMN és az NR biológiája és terápiás potenciálja. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). A nikotinamid-mononukleotid, egy kulcsfontosságú NAD+ intermedier, kezeli a diéta és az életkor által kiváltott cukorbetegség patofiziológiáját egerekben. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). A félreformált prionfehérje által kiváltott neuronális halál a NAD+ kimerülésnek köszönhető, és in vitro és in vivo enyhíthető NAD+ pótlással. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). A NADH bejuthat az asztrocitákba, hogy blokkolja a PARP-1 által közvetített asztrociták halálát. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., and Perry, G. (2007). Az oxidatív stressz okai az Alzheimer-kórban. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar