- Introduction
- Materialien und Methoden
- Teilnehmer
- Diät-Standardisierung
- Infusionsprotokoll
- Blutprobenentnahme
- Urinprobenentnahme
- Analytische Methode
- Sicherheit
- Statistische Analyse
- Ethik
- Ergebnisse
- Sicherheit
- Plasma
- Urin
- Diskussion
- Datenverfügbarkeit
- Ethikerklärung
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
- Danksagungen
Introduction
Das übergeordnete Pyridin-Nukleotid, Nicotinamid-Adenin-Dinukleotid (NAD+), ist in allen Zellen des Körpers vorhanden und für die Lebensfähigkeit und Funktion der Zellen unerlässlich.
Als Cofaktor, der für den Elektronentransport in der Atmungskette verantwortlich ist, sind NAD+ und sein Redoxpaar NADH von zentraler Bedeutung für die Energieerzeugung (ATP) in den Mitochondrien durch oxidative Phosphorylierung. Der phosphorylierte Metabolit von NAD+, NADP+ mit seinem Redoxpaar NADPH, liefert auch die Reduktionskraft für eine Reihe von anabolen Reaktionen, darunter die Cholesterin- und Nukleinsäuresynthese, die Verlängerung von Fettsäuren und die Regeneration von Glutathion (GSH), einem der wichtigsten Antioxidantien des Körpers. Insgesamt trägt diese Familie von Pyridinnukleotiden zum Redox-Austausch bei über 400 Enzymreaktionen bei. Wichtig ist, dass NAD+ bei seiner Funktion als Redoxpaar nicht verbraucht wird. Allerdings dient NAD+ auch als Substrat für eine Reihe anderer wichtiger Stoffwechselprozesse und wird daher als Folge ihrer chemischen Reaktionen verbraucht, wodurch das Gewebe möglicherweise an NAD+ verarmt. Dazu gehören Reaktionen, die von der Familie der Polyadenosin-Phosphoribose-Ribose (ADPR)-Enzyme (PARP 1-17) angetrieben werden, die die DNA-Reparatur und die Kernstabilität kontrollieren, sowie epigenetische Kontrollenzyme (Sirt1-7), die interzelluläre Immunkommunikation (CD38/CD157) und die neuronale Regeneration (SARM1; Essuman et al., 2017). Es besteht daher die Möglichkeit, dass der Zellstoffwechsel auf mehreren Ebenen gestört wird, wenn der NAD+-Verbrauch durch diese Enzyme die NAD+-Versorgung oder -Synthese übersteigt.
Die klinische Bedeutung der Aufrechterhaltung des zellulären NAD+-Spiegels wurde Anfang des letzten Jahrhunderts mit der Feststellung festgestellt, dass Pellagra, eine Krankheit, die durch Durchfall, Dermatitis, Demenz und Tod gekennzeichnet ist, mit Lebensmitteln geheilt werden kann, die die NAD+-Vorstufe Niacin (auch bekannt als Vitamin B3; Goldberger, 1914) enthalten. Obwohl Pellagra in den Industrieländern selten ist, hat sich gezeigt, dass die Zellkonzentrationen von NAD+ unter Bedingungen erhöhter oxidativer Schäden, wie sie beim Altern auftreten, abnehmen (Braidy et al., 2011; Massudi et al., 2012; Guest et al., 2014). Es wurde festgestellt, dass veränderte NAD+-Spiegel mit verschiedenen Erkrankungen einhergehen, die mit einer erhöhten Schädigung durch oxidative/freie Radikale einhergehen, darunter Diabetes (Wu et al., 2016), Herzerkrankungen (Pillai et al., 2005), altersbedingte vaskuläre Dysfunktion (Csiszar et al., 2019), ischämische Hirnschäden (Ying und Xiong, 2010), fehlgefaltete neuronale Proteine (Zhou et al., 2015) und Alzheimer-Demenz (Abeti und Duchen, 2012).
Zusätzlich zu den pathologischen Merkmalen von Aβ-Plaques und neurofibrillären Tau-Tangles sind oxidative Schäden ein konsistenter Befund bei der Alzheimer-Krankheit und werden weithin als ein frühes Ereignis im pathogenen Prozess anerkannt, das sogar der Aβ-Ablagerung vorausgeht (Su et al., 2008). Während die reaktiven Sauerstoffspezies (ROS), die diesen Schaden verursachen, wahrscheinlich aus verschiedenen Quellen stammen, wird angenommen, dass dysfunktionale Mitochondrien und die Verfügbarkeit von redoxaktiven Metallen wie Fe++ und Cu+ eine dominante Rolle spielen (Zhua et al., 2007).
Eine wichtige Folge von zellulärem oxidativem Stress, im Gehirn und anderswo, sind Einzel- oder Doppelstrangbrüche in der DNA. Als Reaktion auf DNA-Schäden hydrolysiert PARP1 NAD+, um ADP-Ribose-Polymere herzustellen (Ying, 2013). Wir haben bereits gezeigt, dass der NAD+-Gehalt in menschlichem Gewebe (Massudi et al., 2012) und im Rattenhirn (Braidy et al., 2014) in umgekehrter Korrelation zu den Messwerten für oxidativen Stress steht. Während die reduzierten NAD+-Spiegel im Gehirn lebender Alzheimer-Patienten noch nicht durch nicht-invasive Techniken bestätigt wurden, stützen die konsistenten Befunde oxidativer Schäden im postmortalen Gehirn die Ansicht, dass ein beschleunigter NAD+-Umsatz und -Verlust zur neurologischen Dysfunktion bei dieser Krankheit beitragen. Da sich in Tiermodellen gezeigt hat, dass Interventionen zur Wiederherstellung von NAD+ ein gesundes Altern unterstützen und die Stoffwechselfunktion (Yoshino et al., 2011; Mills et al., 2016) und Demenz (Long et al., 2015) verbessern, werden Strategien zur Erhöhung des NAD+-Spiegels beim Menschen aktiv erforscht.
Die direkteste Methode zur Erhöhung des NAD+-Spiegels ist die intravenöse Verabreichung (IV). Obwohl die Daten aus der experimentellen Forschung minimal sind, wurde bereits über den signifikanten klinischen Nutzen einer intravenösen NAD+-Infusion beim Alkoholentzug berichtet (O’Holleran, 1961; Mestayer, 2019). Während die orale Verabreichung von NAD+-Vorläufern wie Nikotinamid-Ribosid (NR) oder Nikotinamid-Mononukleotid (NMN) mit Begeisterung auf ihre Auswirkungen auf den NAD+-Spiegel hin untersucht wird (Yoshino et al., 2011, 2018; Mills et al., 2016; Airhart et al., 2017), wurde über das metabolische Schicksal und die pharmakokinetischen Eigenschaften der intravenösen NAD+-Verabreichung beim Menschen überraschenderweise noch nicht berichtet. In dieser Studie werden daher zum ersten Mal die Veränderungen der Konzentrationen von NAD+ und seiner Metaboliten während einer IV-Infusion von NAD+ in einer Kohorte gesunder männlicher Teilnehmer dargestellt.
Materialien und Methoden
Teilnehmer
Elf (Test n = 8, Kontrolle n = 3) männliche Teilnehmer im Alter von 30-55 Jahren wurden über Werbung in Radio, Fernsehen und sozialen Medien rekrutiert. Alle Teilnehmer hatten einen BMI von weniger als 30 kg/m2 (durchschnittlicher BMI der Testgruppe = 27,5 ± 2,5 kg/m2; durchschnittlicher BMI der Kontrollgruppe = 24,6 ± 6,5 kg/m2), waren keine Diabetiker, rauchten weniger als eine Zigarette und konsumierten weniger als zwei alkoholische Standardgetränke pro Tag. Personen, die lipidsenkende oder entzündungshemmende Medikamente einnahmen, bei denen eine Leber- oder Niereninsuffizienz in der Vorgeschichte vorlag oder die vor kurzem eine mikrobielle Infektion, ein Trauma oder andere schwerwiegende oder unbehandelte medizinische Störungen erlitten hatten, wurden von der Studie ausgeschlossen. Die Probanden erhielten eine finanzielle Entschädigung für ihre Zeit und Teilnahme, unabhängig davon, ob sie das Experiment abschlossen. Die Teilnehmer durften innerhalb von 14 Tagen vor und während der Studie keine natürlichen Gesundheitsprodukte verwenden, die NAD+, NR oder Nicotinamid enthielten.
Diät-Standardisierung
Am Tag vor der NAD+-Infusion nahmen die Teilnehmer eine identische niacinreduzierte Diät zu sich und tranken nur Wasser.
Am Tag der Studie wurde keine Nahrung zu sich genommen, bis nach der abschließenden 8-Stunden-Blut-/Urinprobe. Die Teilnehmer wurden angehalten, Wasser zu trinken, um ihren Flüssigkeitshaushalt aufrechtzuerhalten. Andere Getränke waren nicht erlaubt.
Um sicherzustellen, dass die Teilnehmer während der 6-stündigen Infusion eine angemessene Energiezufuhr aufrechterhalten, enthielt die Infusionslösung auch 0,1 % Dextrose, die über die 6-stündige Infusionsdauer etwa 2.000 Kalorien lieferte.
Infusionsprotokoll
Die Teilnehmer wurden nach dem Zufallsprinzip entweder der Test- (n = 8) oder der Kontrollgruppe (n = 3) zugeteilt. Den Teilnehmern der Testgruppe wurden über einen Zeitraum von 6 Stunden intravenös 750 mg NAD+ in normaler Kochsalzlösung (Archway Apothecary, Covington, LA, USA) verabreicht (Infusionsrate = ~2 mg/min ≡ 3 μmol/min). Diese NAD+-Dosierung wurde empirisch abgeleitet und entspricht einem gängigen Dosierungsschema in Kliniken (z. B. Springfield Wellness Clinic, Springfield, LA, USA), die in der klinischen Praxis regelmäßig NAD+-Infusionen verabreichen. Den Teilnehmern der Kontrollgruppe wurde über einen Zeitraum von 6 Stunden normale Kochsalzlösung intravenös verabreicht.
Die klinische Verabreichung und Überwachung der IV-Infusionen und die Probenentnahme erfolgten im Springfield Wellness Center, Springfield, LA, USA.
Blutprobenentnahme
Baseline-Blutproben (TO) wurden bei allen Teilnehmern nach einer 12-stündigen Nüchternheit über Nacht entnommen, die unmittelbar vor Beginn der Infusion erfolgte. Weitere Proben wurden dann 30, 60, 120 (2 h), 360 (6 h) und 480 (8 h) Minuten nach Beginn der Infusion entnommen.
Das Vollblut wurde durch eine Standardvenenpunktion (entgegengesetzt zur Infusionsstelle) in ein 5-ml-Röhrchen ohne Heparin entnommen. Unmittelbar nach der Entnahme wurde das Blut bei 4°C für 10 min bei 1.409× g zentrifugiert.
Die Plasma- und Erythrozytenfraktionen wurden sofort abgetrennt und auf je 5 × 500 μL Aliquots verteilt. Alle Aliquots wurden dann sofort eingefroren und bis zur Analyse bei -80 °C gelagert.
Urinprobenentnahme
Nach der Entnahme einer Urinprobe in der Mitte des Flusses wurden die Teilnehmer gebeten, 30 Minuten, 2 Stunden, 6 Stunden und 8 Stunden nach Beginn der NAD+-Infusion den gesamten Urin in den/die bereitgestellten Behälter zu entleeren. Wenn die Teilnehmer zwischen diesen Zeitpunkten zwischendurch Urin abgeben mussten, wurden sie gebeten, dies in das nächstfolgende Gefäß zu tun. Alle Proben wurden sofort nach Erhalt aliquotiert und bei -80 °C gelagert.
Analytische Methode
Chromatographische Trennung von NAD+ und verwandten Metaboliten und MS-Nachweis Flüssigchromatographie gekoppelt an Tandem-Massenspektrometrie (LC/MS/MS) wurde mit einem Sciex QTRAP 5500 Massenspektrometer (Sciex, Redwood City, CA, USA) wie zuvor beschrieben durchgeführt (Clement et al., 2018). Kurz gesagt wurden 100 μL menschliches Plasma oder Urin in 400 μL eiskaltem Methanol extrahiert, 10 Minuten lang bei 4 °C zentrifugiert und durch 3 kDa-Membrankartuschen filtriert. Die Probenextrakte wurden unter Vakuum getrocknet, in 200 μl 100 mM NH4OAc-Puffer rekonstituiert und vor der LC/MS/MS-Analyse in 200 μl-Glasfläschchen überführt und verschlossen. Standardlösungen und Proben (20 μL) wurden wie zuvor beschrieben auf eine Phenomenex NH2-Säule (150 mm- 2 mm- 3 mm) injiziert. Es wurde ein binärer Lösungsmittelgradient bestehend aus 5 mM NH4OAc pH 9,5, eingestellt mit Ammoniak (mobile Phase A) und Acetonitril (mobile Phase B) mit einer Flussrate von 250 μL/min verwendet. Die anfängliche Lösungsmittelzusammensetzung bei der Injektion betrug 25 % A, gefolgt von einem 2-minütigen Gradienten auf 45 % A und einer schnellen Gradientenrampe auf 80 % A (0,1 min), die 5,9 min lang beibehalten wurde. A wurde erneut auf 95 % erhöht (2 min), 13 min lang gehalten und dann zur Äquilibrierung auf die anfänglichen Bedingungen zurückgesetzt (0,1 min), was einer Gesamtlaufzeit von 30 min entspricht. Der Säulenfluss wurde in den MS-Detektor geleitet. Die Kalibrierungskurven der einzelnen Metaboliten wurden anhand der Peakflächenverhältnisse (Peakfläche des Metaboliten geteilt durch Peakfläche des ausgewählten IS) jedes Kalibrators im Verhältnis zu seiner Konzentration erstellt.
Die internen Standards bestanden aus 2H2NAM (für NAM, methylNAM und ADPR) und 13C5;-Cyclic AMP (für NMN und NAD+). Da nicht für alle NAD-Metaboliten Isotopenmarker im Handel erhältlich sind, kann auch ein eng verwandtes Molekül (Strukturanalogon) verwendet werden (Yamada et al., 2006), sofern es bei der Analyse eine ähnliche Stabilität und Ionisierungseffizienz aufweist. Die in dieser Studie ausgewählten internen Standards wurden zuvor für den verwandten Metaboliten optimiert (Bustamante et al., 2017).
Sicherheit
Die Sicherheit von intravenösem NAD+ wurde anhand von Leberfunktionstests und der klinischen Beobachtung etwaiger unerwünschter Ereignisse bewertet. Die Leberfunktionstests bestanden aus Serum, Gesamtbilirubin (Bili), alkalischer Phosphatase (ALP), Alanin-Aminotransferase (ALT), Gamma-Glutamyl-Transferase (GGT), Laktatdehydrogenase (LD) und Aspartat-Aminotransferase (AST).
Statistische Analyse
Die statistische Analyse wurde mit SPSS Version 24 und GraphPad Prism Version 8 für Windows durchgeführt. Eine ungewichtete Mittelwert-, Zwei-Wege-ANOVA mit Bonferroni’s multiplem Vergleichstest wurde verwendet, um festzustellen, ob die mittlere Konzentration für die getesteten Analytiker über den Zeitraum von 8 Stunden und zwischen Test- und Kontrollgruppen unterschiedlich war. Der Wilcoxon Signed Ranks Test wurde verwendet, um festzustellen, ob die Unterschiede in den mittleren Konzentrationen der Leberfunktionstests zwischen dem Ausgangswert und den 8-Stunden-Zeitpunkten signifikant waren. Unterschiede wurden als statistisch signifikant angesehen, wenn p < 0,05.
Ethik
Diese Studie wurde in Übereinstimmung mit dem Ethikkodex des Weltärztebundes (Deklaration von Helsinki) für Experimente am Menschen durchgeführt. Die ethische Genehmigung wurde vom Institutional Review Board der William Carey University, Hattiesburg, MS, eingeholt (Protokoll #2017-12). Von allen Teilnehmern wurde eine informierte Zustimmung eingeholt.
Ergebnisse
Sicherheit
Während der 6-stündigen Infusion wurden weder bei der Placebo- (Kochsalzlösung) noch bei der Testkohorte (NAD+) unerwünschte Ereignisse beobachtet.
Eine signifikante Abnahme der Aktivität (1,3, 57, 3,6 Einheiten/L) der Leberfunktionsenzyme GGT, LD bzw. AST wurde 8 Stunden nach Beginn der NAD+-Infusion beobachtet (Tabelle 1). In den mit Placebo (Kochsalzlösung) behandelten Proben war 8 Stunden nach der Infusion keine signifikante Veränderung der Aktivität eines Leberfunktionsmarkers festzustellen, allerdings kann die geringe Anzahl der Proben die Unterscheidungsempfindlichkeit verringern. Ein signifikanter Anstieg des Plasmabilirubins um 2,75 μmol/l wurde ebenfalls beobachtet. Keine der Veränderungen wurde jedoch als klinisch signifikant angesehen.

Tabelle 1. Der Wilcoxon Signed Ranks Test wurde verwendet, um festzustellen, ob die Unterschiede in den mittleren Konzentrationen der Leberfunktionstests zwischen dem Ausgangswert und dem 8-Stunden-Zeitpunkt signifikant waren.
Plasma
Eine kontinuierliche Infusion von NAD+ mit einer Rate von 3 μmol/min führte nur zum 6-Stunden-Zeitpunkt (d. h. Ende der Infusion) zu einem signifikanten (398 %) Anstieg der NAD+-Plasmaspiegel im Vergleich zum Ausgangswert (p < 0,0001). Dies war ein signifikanter Unterschied zu der mit Kochsalzlösung behandelten 6-Stunden-Kontrolle (p < 0,001).
Die NAD+-Spiegel blieben auch nach 8 Stunden (d. h.,
Die NAD+-Konzentrationen im Plasma änderten sich in den mit Kochsalzlösung behandelten Kontrollproben während des 8-stündigen Bewertungszeitraums nicht signifikant gegenüber dem Ausgangswert (Abbildung 1A).
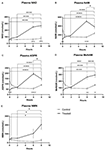
Abbildung 1. Veränderungen des Plasmanikotinamid-Adenin-Dinukleotids (NAD+) und der Metaboliten über 8 Stunden. (A) NAD+, (B) Nicotinamid (NAM), (C) Adenosinphosphoribose (ADPR), (D) Methylnicotinamid (meNAM), (E) Nicotinamidmononukleotid (NMN). *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, wie angegeben. Es wurde eine zweiseitige ANOVA mit Bonferroni’s multiplem Post-Hoc-Vergleichstest verwendet, um festzustellen, ob sich die mittleren Konzentrationen für die getesteten Analytiker über den Zeitraum von 8 Stunden und zwischen den Test- (n = 8) und Kontrollgruppen (n = 3) unterschieden.
Ähnlich wie die für NAD+ beobachteten Veränderungen stiegen die Plasmaspiegel des NAD+-Metaboliten Nikotinamid (NAM) am Ende der NAD+-Infusion (d.h., 6 Stunden) im Vergleich zum Ausgangswert (p < 0,0001). Dies war ebenfalls ein signifikanter Unterschied zur 6-stündigen, mit Kochsalzlösung behandelten Kontrolle (p < 0,001).
Zum 8-stündigen Zeitpunkt (d. h. 2 Stunden nach Ende der Infusion) unterschieden sich die NAM-Konzentrationen zwischen der Kontroll- und der behandelten Gruppe nicht mehr signifikant (p > 0,05).
Die NAM-Konzentrationen in den mit Kochsalzlösung behandelten Kontrollproben änderten sich während des 8-stündigen Zeitraums nicht signifikant (p > 0,05, Abbildung 1B).
In Übereinstimmung mit den für NAM beobachteten Veränderungen stiegen die Plasmaspiegel des NAD+-Metaboliten ADPR am Ende der NAD+-Infusion (d. h. 6 Stunden) im Vergleich zum Ausgangswert signifikant um 393 % (p < 0,0001). Dies war ein signifikanter Unterschied zu der 6 Stunden mit Kochsalzlösung behandelten Kontrolle (p < 0,0001).
Zum 8-Stunden-Zeitpunkt (d.h. 2 Stunden nach Ende der Infusion) blieben die ADPR-Werte 305% über dem Ausgangswert (p < 0,0001). Dies war jedoch nicht signifikant höher als die ADPR-Werte in den mit Kochsalzlösung behandelten Kontrollproben zum gleichen Zeitpunkt (p > 0,05).
Die ADPR-Werte für die mit Kochsalzlösung behandelten Kontrollproben änderten sich während des 8-Stunden-Zeitraums nicht signifikant (p > 0,05, Abbildung 1C).
Eine Spearman-Korrelationsanalyse zwischen den Gruppendurchschnitten über die 8-Stunden-Zeitpunkte für die beiden NAD+-abbauenden Metaboliten, NAM und ADPR, ergab einen Korrelationskoeffizienten von 1,00 (p < 0.001).
Auch die Plasmaspiegel des NAM-Metaboliten Methyl-Nikotinamid (meNAM) stiegen in Übereinstimmung mit den für NAM beobachteten Veränderungen am Ende der NAD+-Infusion (d. h., 6 Stunden) im Vergleich zum Ausgangswert (p < 0,0001) und zur 6 Stunden mit Kochsalzlösung behandelten Kontrolle (p < 0,01) signifikant an.
Zum 8-Stunden-Zeitpunkt (d.h., (d.h. 2 Stunden nach Ende der Infusion) blieben die meNAM-Spiegel 393% über dem Ausgangswert (p < 0,0001) und signifikant höher als bei den mit Kochsalzlösung behandelten Kontrollproben zum gleichen Zeitpunkt (p < 0,05).
Die NMN-Spiegel der mit Kochsalzlösung behandelten Kontrollproben änderten sich während des 8-Stunden-Zeitraums nicht signifikant (p > 0,05, Abbildung 1D).
Die Plasmaspiegel von NMN, einem Metaboliten von NAM über den anabolen Rückgewinnungsweg, waren nur zum 8-Stunden-Zeitpunkt signifikant erhöht (472 %) (d. h., 2 Stunden nach Ende der Infusion, p < 0,05).
Die NMN-Konzentrationen in den mit Kochsalzlösung behandelten Kontrollproben änderten sich während des 8-Stunden-Zeitraums nicht signifikant (p > 0,05, Abbildung 1E).
Urin
Die kontinuierliche IV-Infusion von NAD+ mit einer Rate von 3 μmol/min führte zu einem signifikanten (538 %) Anstieg der NAD+-Ausscheidungsrate im Urin zum 6-Stunden-Zeitpunkt (d. h., (d. h. Ende der Infusion) im Vergleich zu der Ausscheidung nach 30 Minuten (p < 0,001). Dies war auch ein signifikanter Unterschied zu der Menge an NAD+ im Urin, die von den mit Kochsalzlösung behandelten Kontrollen nach 6 Stunden ausgeschieden wurde (p < 0,05).
Die Menge an NAD+, die im Urin ausgeschieden wurde, verringerte sich um 43 % (p < 0,05) nach 8 Stunden (d. h., 2 Stunden nach der Infusion) um 43 % (p < 0,05) im Vergleich zur Spitzenausscheidung zum 6-Stunden-Zeitpunkt.
Die Urinausscheidungsrate für NAD+ änderte sich in den mit Kochsalzlösung behandelten Kontrollproben während des 8-Stunden-Bewertungszeitraums nicht signifikant (Abbildung 2A).

Abbildung 2. Veränderungen von NAD+ und Metaboliten im Urin über 8 Stunden (die ersten 6 Stunden bestanden aus einer kontinuierlichen, 3 μmol/min, NAD+ IV-Infusion). (A) NAD+, (B) NAM, (C) meNAM. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001, wie angegeben. Die zweifache ANOVA mit dem Bonferroni-Post-Hoc-Test für Mehrfachvergleiche wurde verwendet, um festzustellen, ob sich die mittlere Konzentration der getesteten Analytiker über den Zeitraum von 8 Stunden und zwischen den Test- (n = 8) und Kontrollgruppen (n = 3) unterscheidet.
Die Ausscheidungsrate des NAD+-Metaboliten NAM änderte sich während des 8-stündigen Testzeitraums nicht signifikant und unterschied sich nicht von der beobachteten NAM-Ausscheidungsrate für die mit Kochsalzlösung behandelten Kontrollen (Abbildung 2B).
Die Urinausscheidungsrate des NAM-Metaboliten meNAM war zum 6-stündigen Zeitpunkt (d. h. am Ende der Infusion) signifikant erhöht (403 %), (d.h. Ende der Infusion) im Vergleich zu 30 Minuten (p < 0,01). Die mit dem Urin ausgeschiedene meNAM-Menge verringerte sich um 43 % (p < 0,05) nach 8 Stunden (d. h.,
Die Urinausscheidungsrate für meNAM änderte sich in den mit Kochsalzlösung behandelten Kontrollen während des 8-stündigen Bewertungszeitraums nicht signifikant (Abbildung 2C).
Diskussion
Das wachsende Interesse an NAD+-basierten Therapien, einschließlich NAD+-Infusionen, hat die Notwendigkeit eines klareren Verständnisses des Verbleibs von NAD+ und seiner Metaboliten nach der intravenösen Verabreichung deutlich gemacht. Die aktuelle Studie dokumentiert die Veränderungen der NAD+-Konzentrationen und der wichtigsten Metaboliten im Plasma und im Urin über 8 Stunden bei einem typischen klinischen Dosierungsschema von 750 mg NAD+, das über einen Zeitraum von 6 Stunden intravenös verabreicht wird.
Wichtig ist, dass die Infusion von NAD+ in der Testkohorte keine beobachtbaren unerwünschten Ereignisse hervorrief, sondern vielmehr die Plasmaaktivitäten von Enzymen verringerte, die auf Leberstress hindeuten, wie z. B. die intrahepatische LD und AST sowie das posthepatische (Gallengangs-)Enzym GGT, was darauf hindeutet, dass die Integrität sowohl des intrahepatischen als auch des posthepatischen Gewebes selbst innerhalb des relativ kurzen Zeitraums von 8 Stunden verbessert wurde. Der Anstieg von Bilirubin, einem Abbauprodukt der Erythrozyten, nach 8 Stunden kann entweder einen sehr geringen Anstieg des Umsatzes der Erythrozyten widerspiegeln, wie er aufgrund einer infusionsbedingten Hämolyse auftreten kann, oder einen reduzierten Häm-Stoffwechsel (Tabelle 1). Angesichts des sehr geringen Ausmaßes dieser Veränderung wurde dies jedoch nicht als klinisch relevant erachtet.
Wie erwartet, blieben die Plasmaspiegel von NAD+ und den Metaboliten NAM und ADPR sowie den NAM-Metaboliten NMN und meNAM bei den mit Kochsalzlösung behandelten Teilnehmern (d. h. den Kontrollpersonen) über den Zeitraum von 8 Stunden im Wesentlichen unverändert. Allerdings wurde zwischen 30 Minuten und 6 Stunden ein offensichtlicher Rückgang von NAM, meNAM und ADPR beobachtet, der höchstwahrscheinlich auf einen Kochsalzverdünnungseffekt zurückzuführen ist. In Übereinstimmung mit diesem Gedanken kehrten die Werte für diese Analyten nach 8 Stunden auf den Ausgangswert zurück (d. h.,
Unerwarteterweise stiegen die NAD+-Plasmakonzentrationen bei den Teilnehmern, denen NAD+ infundiert wurde, jedoch erst nach dem 2-Stunden-Zeitpunkt an und erreichten erst zum 6-Stunden-Zeitpunkt ein Maximum von ~400 % über dem Ausgangswert für NAD+ und die Metaboliten NAM, meNAM und ADPR (398 %, 409 % bzw. 393 %) (Abbildungen 1A-E). Dies stand im Einklang mit der Spitze der Urinausscheidung sowohl für NAD+ als auch für meNAM, die ebenfalls um 6 Uhr auftrat, bevor sie nach dem Ende der Infusion rasch abnahm (Abbildungen 2A-C).
NAD+ wurde mit einer konstanten Rate von 3 μmol/min infundiert. Daher wurden alle 30 Minuten 90 μmol NAD+ direkt in das Gefäßkompartiment infundiert, was bis zum Ende der Infusion nach 6 Stunden insgesamt 1.080 μmol ergab. Die intravaskuläre Vermischung erfolgt an jedem Infusionspunkt innerhalb von ~2 Minuten; unter der Annahme eines durchschnittlichen Blutvolumens von 5 würde das hinzugefügte NAD+ bei Abwesenheit eines signifikanten Metabolismus oder einer Absorption einem zusätzlichen Anstieg von (NAD+) von mindestens 18 μM alle 30 Minuten über die 6 Stunden der Infusion entsprechen. Während ein Anstieg dieser Größenordnung deutlich innerhalb der analytischen Nachweisgrenzen dieser Studie liegt, wurde weder im Plasma noch im Urin ein Anstieg von NAD+ oder seiner Metaboliten bis nach 2 Stunden (d. h. zum Zeitpunkt der 6-stündigen Infusion) beobachtet. Diese unerwartete Beobachtung deutet auf eine rasche und zumindest in den ersten 2 Stunden vollständige Gewebeaufnahme und/oder Metabolisierung von NAD+ und/oder seinen Metaboliten hin.
Eine Reihe von Enzymen kann einen effektiven NAD+-Katabolismus bewirken, darunter die Sirtuine (SIRTs 1-7), die Adenosindiphosphat (ADP)-Ribose-Transferasen (ARTs) und Poly(ADP-Ribose)-Polymerasen (PARPs 1-17) sowie die zyklischen ADP-Ribose (cADPR)-Synthasen (CD38, CD157). Extrazelluläre NAD+-Pyrophosphatasen, die im menschlichen Serum vorhanden sind, können ebenfalls NAD+ zu AMP und NMN abbauen (Schmidt-Brauns et al., 2001). Das Zelloberflächenprotein CD73 wandelt auch NMN in NR um, das leicht die Zellmembranen für eine mögliche Resynthese zu NAD+ durchquert. Wichtig ist, dass die NAD+-abbauenden Glykohydrolasen CD38 und CD157, die Ekto-Nukleotid-Pyrophosphatase (CD203a) und der NMN-Abbauer CD73 Ektoenzyme sind, die auf einer Vielzahl von Zellen zu finden sind, darunter lymphoide, granulozytäre, neuronale und endotheliale Zellen (Wei et al., 2014), und dass auch plasmalösliche NAD-Glykohydrolasen vorhanden sein können (Abbildung 3; Funaro et al., 2009). Der parallele Anstieg von NAM und ADPR im Plasma (Korrelationskoeffizient von 1,000, p < 0,001, Daten nicht gezeigt) deutet stark darauf hin, dass zumindest nach 6 Stunden ein Hauptschicksal von NAD+ der Stoffwechsel durch Spaltung der glykosidischen ADPribose-Nikotinamid-Verknüpfung zu NAM und ADPR ist, Nebenprodukte, die symptomatisch für NAD-Glykohydrolase-Aktivität (z. B. CD38) sind. Dies steht im Einklang mit anderen Erkenntnissen, die zeigen, dass insbesondere CD38 eine primäre Rolle bei der Kontrolle der extrazellulären NAD+-Spiegel spielt (Wei et al., 2014). Erwachsene menschliche Erythrozyten sind CD38-positiv und weisen eine hohe NAD+-Glykohydrolase-Aktivität auf, die exogenes NAD+ spaltet, um Erythrozyten mit ADP-Ribose zu versorgen, die effizient in die Zelle aufgenommen werden kann (Kim et al., 1993; Albeniz et al., 2004). Das Fehlen eines Anstiegs von NAD+ oder Metaboliten im Plasma oder Urin bis nach den ersten 2 Stunden der Infusion deutet darauf hin, dass NAD+ und/oder seine Metaboliten während dieses Zeitraums aus dem extrazellulären Gefäßraum transportiert und effizient in Gewebe oder extravaskuläre Kompartimente als NAD+ und/oder seine Metaboliten sequestriert werden.

Abbildung 3. Potenzieller extrazellulärer Katabolismus von exogen zugeführtem NAD+ durch die Aktivität der Ektoenzyme CD38 (ADP-Ribose (ADPR)-Synthase), CD203a (NAD+-Pyrophosphatase), CD 73 (5′-Nukleotidase), CD157-ADP-Ribosylcyclase 2. Abkürzungen: NAM, Nicotinamid; NMN, Nicotinamid-Mononukleotid; ADPR, Adenosindiphosphat-Ribosid; meNAM, Methylnicotinamid; 4PY, N-Methyl-4-pyridon-3-carboxamid; 2PY, Methyl-2-pyridon-5-carboxamid; ARPP, ADP-Ribose-Pyrophosphatase; RPPK, Ribosyl-Pyrophosphokinase; NAmpt, Nicotinamid-Phosphoribosyltransferrase; NMNAT, Nicotinamid-Mononucleotidadenyltransferase; CX-43, Connexin 43.
Obwohl PARP und Sirtuine am NAD+-Abbau beteiligt sind, ist es unwahrscheinlich, dass sie als intrazelluläre Enzyme mit Vertretern im Zytoplasma, im Zellkern und in den Mitochondrien den extrazellulären NAD+-Spiegel direkt beeinflussen. Es ist jedoch davon auszugehen, dass diese Enzyme auf Veränderungen der intrazellulären Konzentrationen von NAD+, NAM und NR reagieren, die durch exogen zugeführtes NAD+ entstehen können. Abbildung 4 fasst schematisch die möglichen Schicksale von exogenem NAD+ zusammen.
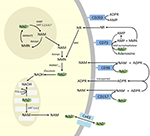
Abbildung 4. Potenzielles intra- und extrazelluläres Schicksal von exogen zugeführtem NAD+. Abkürzungen: CD38 , CD203a (NAD+-Pyrophosphatase), CD 73 (5′-Nukleotidase). NAM, Nicotinamid; NMN, Nicotinamid-Mononukleotid; ADPR, Adenosindiphosphat-Ribosid; meNAM, Methylnicotinamid; 4PY, N-Methyl-4-pyridon-3-carboxamid; 2PY, Methyl-2-pyridon-5-carboxamid; ARPP, ADP-Ribose-Pyrophosphatase; RPPK, Ribosyl-Pyrophosphokinase; NAmpt, Nicotinamid-Phosphoribosyltransferrase; NMNAT, Nicotinamid-Mononucleotidadenyltransferase; PARP ; NRK .
Es besteht zwar eine beträchtliche Kapazität für den raschen Abbau des exogen zugeführten IV-NAD+ in seine Metaboliten, doch ist auch die Aufnahme von extrazellulärem NAD+ zu erwähnen. Da NAD+ insgesamt negativ geladen ist, kann es die Zellmembranen nicht passiv durchqueren und muss daher aktiv durch die Membran transportiert werden. Dass dies der Fall ist, wurde von einer Reihe von Forschern gezeigt, die berichteten, dass exogenes NAD+, das einer Vielzahl menschlicher Zelltypen zugeführt wird, tatsächlich zu einer erheblichen Erhöhung des intrazellulären NAD+ führt (Ying et al., 2003; Zhu et al., 2005; Billington et al., 2008; Pittelli et al., 2011; Felici et al., 2013). Während die beteiligten Mechanismen noch nicht vollständig charakterisiert sind, berichteten Alano et al. (2010), dass exogenes NAD+ durch P2X7-gesteuerte Kanäle in Neuronen eindringen kann, und andere haben durchgängig den Transport von NAD+ durch Membranen über Connexin 43 (CX43)-Hemikanäle beobachtet, selbst bei Konzentrationen von nur 250 pM (Billington et al., 2008). Da Connexine im menschlichen Gewebe weit verbreitet sind und CX43 das am häufigsten vorkommende Connexin in vielen Zelltypen zu sein scheint, kann das Potenzial für eine schnelle Aufnahme von NAD+ nicht ausgeschlossen werden.
Die zelluläre Aufnahme und/oder der Stoffwechsel von NAD+ und den Metaboliten NAM und ADPR sowie den sekundären Metaboliten meNAM und NMN scheinen zumindest in den ersten 2 Stunden mit der NAD+-Infusion von 3 μmol/Min. Schritt zu halten. Entweder werden NAD+ und/oder die getesteten primären Metaboliten während dieser ersten 2-6 Stunden effizient sequestriert oder es werden auch sekundäre Metaboliten gebildet. ADPR kann recycelt werden, um NAD+ aus NAM zu erzeugen (Abbildung 4), oder über Ektoenzyme wie CD203a (NAD+-Pyrophosphatase) weiter verstoffwechselt werden, um AMP zu erzeugen, das durch CD73 a 5′-Nukleotidase weiter schnell zu Adenosin verstoffwechselt werden kann (Bogan und Brenner, 2010; Horenstein et al., 2016; Morandi et al., 2018). Zur Unterstützung dieser Hypothese wurde ein Anstieg des Adenosinspiegels im Blut von anderen als Folge einer extrazellulären NAD+-Infusion erkannt (Szczepañska-Konkel et al., 2003). NAM kann auch über den Bergungsweg zu NMN verstoffwechselt werden, bevor es zu NAD+ resynthetisiert wird (Abbildungen 3 und 4), oder durch hepatische Methyltransferasen zu N1-Methylnicotinamid umgewandelt werden, das entweder direkt ausgeschieden oder weiter zu N-Methyl-2-pyridon-5-carboxamid (2PY, +99 % von meNAM) und N-Methyl-4-pyridon-3-carboxamid (4PY, ~0.25% von meNAM) vor der Ausscheidung (Shibata und Matsuo, 1989; Okamoto et al, 2003).
Es ist offensichtlich, dass bei dem verwendeten Dosierungsschema die Mechanismen, die am Metabolismus und der Sequestrierung von NAD+ und Metaboliten beteiligt sind, irgendwann nach 2 Stunden eine Sättigung erreicht haben, was zu einer signifikanten Erhöhung von NAD+ im Plasma und einer Akkumulation aller getesteten Metaboliten (NMA, ADPR, meNAM und NMN) nach 6 Stunden führt. Wie bereits erwähnt, stützen diese Daten die Ansicht, dass ein wichtiger Weg für den NAD+-Stoffwechsel unter diesen Bedingungen die Spaltung der glykosidischen Bindung durch Ektoenzyme wie CD38 ist, um NAM und ADPR zu erzeugen. Der Anstieg des Plasma-NMN nach 2 Stunden deutet jedoch auch darauf hin, dass exogenes NAD+ wahrscheinlich durch extrazelluläre NAD+-Pyrophosphatasen beeinflusst wird, wodurch das Plasma-NMN erhöht und AMP als zusätzlicher Metabolit freigesetzt wird.
Zusammenfassend zeigt diese Studie zum ersten Mal, dass: (a) bei einer Flussrate von 3 μmol/min das gesamte exogen infundierte NAD+ zumindest in den ersten 2 Stunden schnell und vollständig aus dem Plasma entfernt wurde; (b) der Anstieg der analysierten metabolischen Nebenprodukte mit der Aktivität von NAD+-Glykohydrolasen und NAD+-Pyrophosphatasen übereinstimmt; und (c) die durch die NAD+-Infusion entstehenden Urinausscheidungsprodukte natives NAD+ und meNAM, nicht aber NAM enthalten.
Die Ergebnisse dieser Untersuchung sind zwar neu und tragen dazu bei, unser Verständnis des zeitlichen Verbleibs von exogenem NAD+ beim Menschen zu verbessern, doch wurden auch Einschränkungen festgestellt. Zur Verbesserung der Gesamtstoffwechselberechnung sollten künftige Studien die Veränderungen von NAD+ und Metaboliten in den roten Blutkörperchen sowie die Urinausscheidung der sekundären meNAM-Metaboliten 2PY und 4PY untersuchen. Darüber hinaus wird es wahrscheinlich nützlich sein, die Auswirkungen von exogenem NAD+ auf Veränderungen im Purinstoffwechsel zu bewerten, was zumindest die Bewertung von AMP und Adenosin im Plasma und in den Erythrozyten einschließen sollte. Die Verwendung von Tiermodellen kann auch dazu beitragen, die relative Beteiligung der verschiedenen Stoffwechselwege durch den Einsatz geeigneter pharmakologischer Inhibitoren und Gewebeproben zu klären.
Zusammenfassend lässt sich sagen, dass diese Studie zum ersten Mal einige sehr nützliche, bisher unbekannte Informationen über den Verbleib von exogenem intravenösem NAD+ beim Menschen aufzeigen konnte, einschließlich der allgemeinen Sicherheit und Verträglichkeit einer intravenösen NAD+-Infusion mit einer Rate von 3 μmol/min, die schnelle Sequestrierung von NAD+ aus dem Plasma, den wahrscheinlichen Beitrag sowohl der NAD+-Glykohydrolase- als auch der NAD+-Pyrophosphat-Aktivität zum Metabolismus von NAD+ und die offensichtlich effiziente renale tubuläre Rückresorption von NAM. Es sind jedoch weitere Forschungsarbeiten erforderlich, um das komplexe metabolische Schicksal dieses wichtigen Moleküls vollständig aufzudecken. Darüber hinaus wird die Charakterisierung dieser Veränderungen dazu beitragen, die Entwicklung und Verbesserung von NAD+-basierten Behandlungsschemata für Erkrankungen voranzutreiben, die wahrscheinlich von einer erhöhten NAD+-Verfügbarkeit profitieren, einschließlich Erkrankungen, die eine verstärkte zelluläre Regeneration und Reparatur erfordern, wie Alzheimer und andere neurodegenerative Demenzerkrankungen.
Datenverfügbarkeit
Die für diese Studie erstellten Datensätze sind auf Anfrage bei der entsprechenden Autorin erhältlich.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden vom William Carey University Institutional Review Board, Hattiesburg, MS (Protokoll #2017-12) geprüft und genehmigt. Die Patienten/Teilnehmer gaben ihre schriftliche Einwilligung zur Teilnahme an dieser Studie.
Beiträge der Autoren
RG war an der Planung und Überwachung der Studie, der kritischen Diskussion und der Erstellung des Manuskripts beteiligt. JBer war am Studiendesign, der kritischen Diskussion, der Datenerhebung, der statistischen Analyse, der Manuskripterstellung und der Manuskriptprüfung beteiligt. RM war an der Planung der Studie, der kritischen Diskussion, der klinischen Überwachung und der Durchsicht des Manuskripts beteiligt. NB war an der biochemischen Analyse und der Durchsicht des Manuskripts beteiligt. JW war am Studiendesign, an der kritischen Diskussion und an der Durchsicht des Manuskripts beteiligt. JBen war an der Datenerhebung und der Durchsicht des Manuskripts beteiligt. SB war am Studiendesign und der Durchsicht des Manuskripts beteiligt. Alle Autoren haben die endgültige Fassung des Manuskripts geprüft, gelesen und gebilligt und sind mit der Reihenfolge der Darstellung der Autoren einverstanden.
Finanzierung
Diese Studie wurde gemeinsam von der NAD+ Research Inc, (LA, USA) und der Australasian Research Institute Incorporation (Sydney, Australien) finanziert und im Springfield Wellness Center, Springfield, LA, USA, durchgeführt.
Erklärung zu Interessenkonflikten
RM ist Direktor der NAD+ Research Inc. und medizinischer Leiter des Springfield Wellness Center, das IV NAD als klinische Therapie einsetzt. SB erhielt Beratungshonorare von NAD+ Research Inc.
Die übrigen Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir möchten Archway Apothecary Pty Limited, LA, USA für die kostenlose Bereitstellung von IV NAD+ für dieses Projekt danken.
Abeti, R., and Duchen, M. R. (2012). Aktivierung von PARP durch oxidativen Stress induziert durch β-Amyloid: Implikationen für die Alzheimer-Krankheit. Neurochem. Res. 37, 2589-2596. doi: 10.1007/s11064-012-0895-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Airhart, S. E., Shireman, L. M., Risler, L. J., Anderson, G. D., Nagana Gowda, G. A., Raftery, D., et al. (2017). Eine offene, nicht-randomisierte Studie über die Pharmakokinetik des Nahrungsergänzungsmittels Nicotinamid-Ribosid (NR) und seine Auswirkungen auf den NAD+-Spiegel im Blut gesunder Freiwilliger. PLoS One 12:e0186459. doi: 10.1371/journal.pone.0186459
PubMed Abstract | CrossRef Full Text | Google Scholar
Alano, C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T. M., and Swanson, R. A. (2010). NAD+-Verarmung ist notwendig und ausreichend für PARP-1-vermittelten neuronalen Tod. J. Neurosci. 30, 2967-2978. doi: 10.1523/JNEUROSCI.5552-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Albeniz, I., Demir, O., Nurten, R., and Bermek, E. (2004). NAD-Glycohydrolase-Aktivitäten und Adp-Ribose-Aufnahme in Erythrozyten von Normalpersonen und Krebspatienten. Biosci. Rep. 24, 41-53. doi: 10.1023/b:bire.0000037755.42767.a4
PubMed Abstract | CrossRef Full Text | Google Scholar
Billington, R. A., Travelli, C., Ercolano, E., Galli, U., Roman, C. B., Grolla, A. A., et al. (2008). Charakterisierung der NAD+-Aufnahme in Säugetierzellen. J. Biol. Chem. 283, 6367-6374. doi: 10.1074/jbc.M706204200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogan, K., and Brenner, C. (2010). 5′-Nukleotidasen und ihre neue Rolle im NAD+- und Phosphat-Stoffwechsel. New J. Chem. 34, 845-853. doi: 10.1039/b9nj00758j
CrossRef Full Text | Google Scholar
Braidy, N., Guillemin, G. J., Mansour, H., Chan-Ling, T., Poljak, A., and Grant, R. (2011). Altersbedingte Veränderungen des NAD+-Stoffwechsels, des oxidativen Stresses und der Sirt1-Aktivität bei Wistar-Ratten. PLoS One 6:e19194. doi: 10.1371/journal.pone.0019194
PubMed Abstract | CrossRef Full Text | Google Scholar
Braidy, N., Poljak, A., Grant, R., Jayasena, T., Mansour, H., Chan-Ling, T., et al. (2014). Kartierung des NAD+-Stoffwechsels im Gehirn alternder Wistar-Ratten: Potenzielle Ziele zur Beeinflussung der Hirnseneszenz. Biogerontology 15, 177-198. doi: 10.1007/s10522-013-9489-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Bustamante, S., Jayasena, T., Richani, D., Gilchrist, R., Wu, L., Sinclair, D., et al. (2017). Quantifizierung des zellulären NAD+-Metaboloms mit einem Tandem-Flüssigkeitschromatographie-Massenspektrometrie-Ansatz. Metabolomics 14:15. doi: 10.1007/s11306-017-1310-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Clement, J., Wong, M., Poljak, A., Sachdev, P., and Braidy, N. (2018). Das Plasma-NAD+-Metabolom ist bei „normaler“ Alterung dysreguliert. Rejuvenation Res. 22, 121-130. doi: 10.1089/rej.2018.2077
PubMed Abstract | CrossRef Full Text | Google Scholar
Csiszar, A., Tarantini, S., Yabluchanskiy, A., Balasubramanian, P., Kiss, T., Farkas, E., et al. (2019). Rolle des endothelialen NAD+-Mangels bei altersbedingter vaskulärer Dysfunktion. Am. J. Physiol. Heart Circ. Physiol. 316, H1253-H1266. doi: 10.1152/ajpheart.00039.2019
PubMed Abstract | CrossRef Full Text | Google Scholar
Essuman, K., Summers, D. W., Sasaki, Y., Mao, X., DiAntonio, A., and Milbrandt, J. (2017). Die SARM1-Maut/Interleukin-1-Rezeptordomäne besitzt eine intrinsische NAD+-Spaltungsaktivität, die pathologische axonale Degeneration fördert. Neuron 93, 1334.e5-1343.e5. doi: 10.1016/j.neuron.2017.02.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Felici, R., Lapucci, A., Ramazzotti, M., and Chiarugi, A. (2013). Einblicke in die molekularen und funktionellen Eigenschaften von NMNAT3 geben neue Hinweise auf die NAD-Homöostase in menschlichen Mitochondrien. PLoS One 8:e76938. doi: 10.1371/journal.pone.0076938
PubMed Abstract | CrossRef Full Text | Google Scholar
Funaro, A., Ortolan, E., Bovino, P., Lo Buono, N., Nacci, G., Parrotta, R., et al. (2009). Ektoenzyme und angeborene Immunität: die Rolle des menschlichen CD157 beim Leukozyten-Trafficking. Front. Biosci. 14, 929-943. doi: 10.2741/3287
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberger, J. (1914). Die Ätiologie der Pellagra: Die Bedeutung gewisser epidemiologischer Beobachtungen in diesem Zusammenhang. Public Health Rep. 29, 1683-1686. doi: 10.2307/4570920
CrossRef Full Text | Google Scholar
Guest, J., Grant, R., Mori, T. A., and Croft, K. D. (2014). Veränderungen von oxidativen Schäden, Entzündungen und mit dem Alter in der Liquor cerebrospinalis. PLoS One 9:e85335. doi: 10.1371/journal.pone.0085335
PubMed Abstract | CrossRef Full Text | Google Scholar
Horenstein, A., Quarona, V., Toscani, D., Costa, F., Chillemi, A., Pistoia, V., et al. (2016). Adenosin, das in der Nische des Knochenmarks durch einen CD38-vermittelten Signalweg erzeugt wird, korreliert mit dem Fortschreiten des menschlichen Myeloms. Mol. Med. 22, 694-704. doi: 10.2119/molmed.2016.00198
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, U., Han, M. K., Park, B. H., Kim, H. R., and An, N. H. (1993). Funktion der NAD-Glycohydorlase bei der ADP-Ribose-Aufnahme aus menschlichen Erythrozyten. Biochim. Biophys. Acta 1178, 121-126. doi: 10.1016/0167-4889(93)90001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Long, A. N., Owens, K., Schlappal, A. E., Kristian, T., Fishman, P. S., and Schuh, R. A. (2015). Wirkung von Nikotinamidmononukleotid auf mitochondriale Atmungsdefizite des Gehirns in einem für die Alzheimer-Krankheit relevanten murinen Modell. BMC Neurol. 15:19. doi: 10.1186/s12883-015-0272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Massudi, H., Grant, R., Braidy, N., Guest, J., Farnsworth, B., Guillemin, G. J., et al. (2012). Altersbedingte Veränderungen des oxidativen Stresses und des NAD+-Stoffwechsels in menschlichem Gewebe. PLoS One 7:e42357. doi: 10.1371/journal.pone.0042357
PubMed Abstract | CrossRef Full Text | Google Scholar
Mestayer, P. N. (2019). Sucht die dunkle Nacht der Seele, NAD+ das Licht der Hoffnung. (Bloomington IS: Balboa Press).
Google Scholar
Mills, K. F., Yoshida, S., Stein, L. R., Grozio, A., Kubota, S., Sasaki, Y., et al. (2016). Langfristige Verabreichung von Nikotinamidmononukleotid mildert den altersbedingten physiologischen Abbau bei Mäusen. Cell Metab. 24, 795-806. doi: 10.1016/j.cmet.2016.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Morandi, F., Horenstein, A. L., Rizzo, R., and Malavasi, F. (2018). Die Rolle der extrazellulären Adenosinbildung bei der Entwicklung von Autoimmunerkrankungen. Mediators Inflamm. 2018:7019398. doi: 10.1155/2018/7019398
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Holleran, P. (1961). DPN in der Prävention, Diagnose und Behandlung von Drogenabhängigkeit. West. J. Surg. Obst. Gyn. 69, 213-215.
Google Scholar
Okamoto, H., Ishikawa, A., Yoshitake, Y., Kodama, N., Nishimuta, M., Fukuwatari, T., et al. (2003). Tageszeitliche Schwankungen in der menschlichen Urinausscheidung von Nikotinamid-Kataboliten: Auswirkungen von Stress auf den Nikotinamid-Stoffwechsel. Am. J. Clin. Nutr. 77, 406-410. doi: 10.1093/ajcn/77.2.406
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillai, J. B., Isbatan, A., Imai, S., und Gupta, M. P. (2005). Der von der Poly(ADP-Ribose)-Polymerase-1 abhängige Zelltod von Herzmuskelzellen während der Herzinsuffizienz wird durch NAD+-Verarmung und verminderte Sir2α-Deacetylase-Aktivität vermittelt. J. Biol. Chem. 280, 43121-43130. doi: 10.1074/jbc.m506162200
PubMed Abstract | CrossRef Full Text | Google Scholar
Pittelli, M., Felici, R., Pitozzi, V., Giovannelli, L., Bigagli, E., Cialdai, F., et al. (2011). Pharmakologische Effekte von exogenem NAD auf mitochondriale Bioenergetik, DNA-Reparatur und Apoptose. Mol. Pharmacol. 80, 1136-1146. doi: 10.1124/mol.111.073916
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmidt-Brauns, J., Herbert, M., Kemmer, G., Kraiss, A., Schlör, S., and Reidl, J. (2001). Ist eine NAD-Pyrophosphatase-Aktivität für die Vermehrung von Haemophilus influenzae Typ b in der Blutbahn notwendig? Int. J. Med. Microbiol. 291, 219-225. doi: 10.1078/1438-4221-00122
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibata, K., and Matsuo, H. (1989). Korrelation zwischen der Aufnahme von Niacin-Äquivalenten und der Urinausscheidung seiner Metaboliten, N‘-Methylnicotinamid, N‘-Methyl-2-pyridon-5-carboxamid und N‘-Methyl-4-pyridon-3-carboxamid, bei Menschen, die ein selbstgewähltes Lebensmittel verzehren. Am. J. Clin. Nutr. 50, 114-119. doi: 10.1093/ajcn/50.1.114
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, B., Wang, X., Nunomura, A., Moreira, P., Lee, H. G., Perry, G., et al. (2008). Oxidativer Stress als Signalgeber bei der Alzheimer-Krankheit. Curr. Alzheimer Res. 5, 525-532.
Google Scholar
Szczepañska-Konkel, M., Langner, G., Bednarczuk, G., Stiepanow-Trzeciak, A., Jankowski, M., and Angielski, S. (2003). Hämodynamik der Niere und natriuretische Reaktionen auf die intravenöse Verabreichung von Diadenosintetraphosphat (ap4a) und Nicotinamid-Adenin-Dinucleotid (NAD) bei der Ratte. J. Physiol. Pharmacol. 54, 163-173.
PubMed Abstract | Google Scholar
Wei, W., Graeff, R., and Yue, J. (2014). Roles and mechanisms of the CD38/cyclic adenosine diphosphate ribose/Ca2+ signaling pathway. World J. Biol. Chem. 5, 58-67. doi: 10.4331/wjbc.v5.i1.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., Jin, Z., Zheng, H., and Yan, L. J. (2016). Quellen und Auswirkungen des NADH/NAD+-Redox-Ungleichgewichts bei Diabetes und seinen Komplikationen. Diabetes Metab. Syndr. Obes. 9, 145-153. doi: 10.2147/dmso.s106087
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Hara, N., Shibata, T., Osago, H., and Tsuchiya, M. (2006). Die gleichzeitige Messung von Nikotinamid-Adenin-Dinukleotid und verwandten Verbindungen durch Flüssigchromatographie/Elektrospray-Ionisations-Tandem-Massenspektrometrie. Anal. Biochem. 352, 282-285. doi: 10.1016/j.ab.2006.02.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W. (2013). Roles of NAD+, PARP-1, and sirtuins in cell death, ischemic brain injury, and synchrotron radiation X-ray-induced tissue injury. Scientifica 2013:691251. doi: 10.1155/2013/691251
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., Garnier, P., and Swanson, R. A. (2003). NAD+-Repletion verhindert PARP-1-induzierte glykolytische Blockade und Zelltod in kultivierten Maus-Astrozyten. Biochem. Biophys. Res. Commun. 308, 809-813. doi: 10.1016/s0006-291x(03)01483-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ying, W., and Xiong, Z.-G. (2010). Oxidativer Stress und NAD+ bei ischämischen Hirnverletzungen: aktuelle Fortschritte und zukünftige Perspektiven. Curr. Med. Chem. 17, 2152-2158. doi: 10.2174/092986710791299911
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Baur, J. A., and Imai, S. I. (2018). NAD+-Zwischenprodukte: die Biologie und das therapeutische Potenzial von NMN und NR. Cell Metab. 27, 513-528. doi: 10.1016/j.cmet.2017.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshino, J., Mills, K. F., Yoon, M. J., and Imai, S. (2011). Nicotinamid-Mononukleotid, ein wichtiges NAD+-Zwischenprodukt, behandelt die Pathophysiologie von diät- und altersinduziertem Diabetes bei Mäusen. Cell Metab. 14, 528-536. doi: 10.1016/j.cmet.2011.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, M., Ottenberg, G., Sferrazza, G. F., Hubbs, C., Fallahi, M., Rumbaugh, G., et al. (2015). Der durch fehlgefaltetes Prionprotein induzierte neuronale Tod ist auf NAD+-Verarmung zurückzuführen und kann in vitro und in vivo durch NAD+-Auffüllung gemildert werden. Brain 138, 992-1008. doi: 10.1093/brain/awv002
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhu, K., Swanson, R. A., and Ying, W. (2005). NADH kann in Astrozyten eindringen und den PARP-1-vermittelten Astrozytentod blockieren. Neuroreport 16, 1209-1212. doi: 10.1097/00001756-200508010-00015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhua, X., Sua, B., Wanga, X., Smitha, M. A., und Perry, G. (2007). Ursachen des oxidativen Stresses bei der Alzheimer-Krankheit. Cell. Mol. Life Sci. 64, 2202-2210. doi: 10.1007/s00018-007-7218-4
PubMed Abstract | CrossRef Full Text | Google Scholar