La connaissance de l’anatomie et de l’électrophysiologie du système de conduction cardiaque depuis la jonction auriculo-ventriculaire (AV) jusqu’aux fibres de Purkinje distales est essentielle pour comprendre la physiopathologie du bloc de branche gauche (LBBB).
Embryologie
Pendant la cardiogenèse, la différenciation en cellules musculaires fonctionnelles et en système de conduction reste un sujet de discussion. Des hypothèses ont été développées qui, singulièrement ou en combinaison, pourraient expliquer ce sujet complexe. Les composants du stimulateur cardiaque et du système de conduction ne sont pas uniformes en ce qui concerne la fonction, la morphologie et le phénotype moléculaire. Plusieurs modèles et théories ont été élaborés. La théorie des quatre anneaux décrit quatre anneaux du système de conduction à l’intérieur du tube cardiaque qui se différencient en composants du stimulateur cardiaque et du système de conduction. Le modèle de recrutement suppose que certains cardiomyocytes sont engagés très tôt dans le système de conduction. Le modèle de spécification postule que les cellules myocardiques primaires expriment soit des gènes du système de conduction, soit des gènes du myocyte de travail.
Anatomie
Le système de conduction spécialisé du cœur est composé de cellules qui conduisent les impulsions électriques plus rapidement que le myocarde environnant. Le système de conduction peut être divisé en segments anatomiques distincts, et chaque segment est décrit en séquence en commençant par la jonction AV et en terminant par les fibres de Purkinje.
La jonction AV a traditionnellement été divisée en trois régions comme suit : zone cellulaire transitionnelle, nœud AV et partie pénétrante du faisceau AV (faisceau de His, faisceau commun).
La zone cellulaire transitionnelle est l’endroit où l’oreillette droite fusionne avec le nœud AV compact au moyen de voies auriculaires discrètes appelées voies lentes et rapides. Dans le passé, on pensait que les voies lentes et rapides étaient parallèles. Cependant, des données provenant d’ablations par radiofréquence du nœud AV et de tachycardies par réentrée AV ont démontré que la voie lente est plus étroitement associée à l’aspect antéro-supérieur de l’orifice du sinus coronaire. En outre, les données montrent que la voie rapide est située légèrement supérieure et postérieure au nœud AV.
Le segment suivant est le nœud AV, qui se trouve antérieur et supérieur à l’os du sinus coronaire, directement au-dessus de l’insertion du feuillet septal de la valve tricuspide. Cette zone est située au sommet du triangle de Koch, qui est formé par l’anneau tricuspide, le tendon de Todaro et l’ostium du sinus coronaire. L’apport sanguin au nœud AV provient de l’artère nodale AV, qui est une branche de l’artère coronaire droite chez 85 % à 90 % des individus et une branche de l’artère coronaire circonflexe gauche chez 10 % à 15 % des individus.
Au sommet du triangle de Koch, le nœud AV compact devient le faisceau pénétrant de His. Il pénètre le corps fibreux central au niveau de l’attache du tendon de Todaro, passe entre le septum membraneux et le septum musculaire, et bifurque au niveau de la crête du septum ventriculaire musculaire. Le faisceau de His est divisé en trois segments anatomiques. Le segment proximal, ou non pénétrant, se situe en distal du nœud AV et en proximal du corps fibreux central. Le segment moyen, ou pénétrant, pénètre le corps fibreux central et s’étend en arrière du septum membraneux. Le segment distal, ou ramifié, bifurque au niveau de la crête du septum musculaire en branches de faisceau droite et gauche (voir l’image ci-dessous).
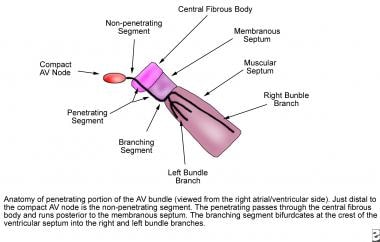 Cette image représente l’anatomie de la partie pénétrante du faisceau atrio-ventriculaire (AV).
Cette image représente l’anatomie de la partie pénétrante du faisceau atrio-ventriculaire (AV). La branche droite du faisceau, une continuation directe du faisceau pénétrant, prend son origine distalement par rapport à l’attachement du feuillet septal de la valve tricuspide avec le septum membraneux et les surfaces sur le septum ventriculaire droit juste en dessous du muscle papillaire du conus. Il n’est pas ramifié et se dirige vers l’apex du ventricule droit le long de la marge postérieure de la bande septale, traverse la bande modératrice jusqu’à la base du muscle papillaire antérieur et se dirige vers la paroi libre du ventricule droit.
Le LBB prend naissance sur la crête du septum ventriculaire musculaire juste distalement par rapport au septum membraneux. Il se présente sous la forme d’un éventail et descend vers le bas le long de la surface septale du ventricule gauche, sous la cuspide non coronaire de la valve aortique. Le LBB se ramifie généralement en trois fascicules principaux. Le fascicule antérieur est dirigé vers la base du muscle papillaire antérolatéral, le fascicule postérieur est dirigé vers la base du muscle papillaire postéromédial et, dans 60 % des cœurs, un fascicule central se dirige vers la région médiane du septum. Lorsqu’il n’y a pas de fascicule central, comme dans 40% des cœurs, la région médio-septale est alimentée par des radiations du fascicule antérieur ou des fascicules antérieur et postérieur.
À l’aspect terminal de chaque branche de faisceau, les fibres de Purkinje sont entrelacées sur la surface endocardique des deux ventricules et ont tendance à être concentrées à l’extrémité des muscles papillaires.
Electrophysiologie de la conduction cardiaque
Le cœur est une pompe mécanique en deux temps coordonnée par des impulsions électriques précisément synchronisées. Pour que la pompe fonctionne de manière optimale, des dépolarisations séquentielles des oreillettes puis des ventricules permettent à la contraction auriculaire d’assurer le remplissage diastolique complet des ventricules (synchronie AV). Après le remplissage des ventricules, l’activation rapide du myocarde ventriculaire permet une contraction synchronisée pour éjecter le sang le plus efficacement possible vers les grands vaisseaux.
Conduction cardiaque normale
Dans la conduction cardiaque normale, l’excitation électrique du cœur se déroule de manière séquentielle des oreillettes vers les ventricules et est mise en évidence sur l’électrocardiogramme (ECG) de surface (voir l’image ci-dessous).
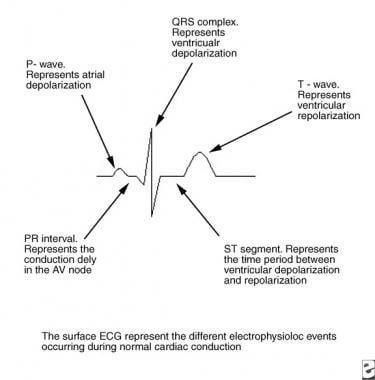 Cette image représente les événements électrophysiologiques de la conduction cardiaque normale. AV = atrio-ventriculaire ; ECG = électrocardiogramme.
Cette image représente les événements électrophysiologiques de la conduction cardiaque normale. AV = atrio-ventriculaire ; ECG = électrocardiogramme. L’impulsion électrique générée dans le nœud sinusal traverse les oreillettes (reflétée par l’onde P sur l’ECG) pour atteindre le nœud AV. Lorsque l’impulsion traverse le nœud AV, la conduction ralentit, ce qui laisse le temps à la contraction auriculaire de se produire avant que le ventricule ne soit activé (segment PR). Après que l’impulsion ait traversé le nœud AV compact, elle est rapidement conduite à travers le cœur vers les ventricules par le faisceau de His (faisceau pénétrant) vers le faisceau ramifié, les branches du faisceau, les fibres de Purkinje distales et, enfin, les cellules myocardiques ventriculaires (complexe QRS étroit).
L’anatomie du LBB est variable. L’origine du LBB est large chez certains et étroite chez d’autres (allant de <1 mm à 14 mm) et est significativement influencée par la relation anatomique du faisceau de His avec le septum ventriculaire. La subdivision du LBB est également très variable. Certaines études suggèrent une division trifasciculaire du LBB en une branche antérieure, postérieure et septale. Pour les cliniciens et les électrophysiologistes, le concept de LBB bifasciculaire (fascicules antérieur et postérieur) a bien servi. Dans un cœur normal, l’impulsion électrique arrivant du faisceau de His entraîne une activation parallèle et indépendante des deux ventricules, tandis que le septum ventriculaire est activé dans le sens gauche-droite. Le riche réseau de Purkinjie de chaque côté transmet l’impulsion électrique aux cellules du myocarde.
Types de bloc de branche gauche
Le BBG complet se produit lorsque l’impulsion électrique est retardée ou interrompue soit dans le BBG principal, soit dans les deux fascicules antérieur et postérieur. La conduction le long de la branche bundle droite se déroule normalement, et le ventricule droit se dépolarise de façon normale. Dans un BBG complet, la conduction du ventricule droit passe d’abord par le septum interventriculaire, puis par les parties antérieure et postérieure du ventricule gauche, et enfin par la paroi libre latérale gauche. Le retard de la dépolarisation du ventricule gauche explique les résultats de l’ECG dans le bloc de branche gauche (voir les images ci-dessous).
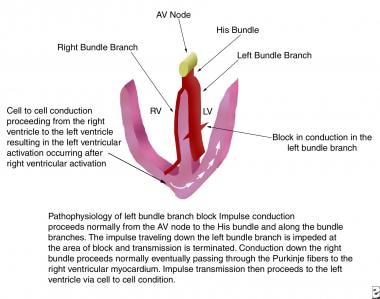 Cette image décrit la pathophysiologie du bloc de branche gauche. AV = atrio-ventriculaire ; VG = ventricule gauche ; VR = ventricule droit.
Cette image décrit la pathophysiologie du bloc de branche gauche. AV = atrio-ventriculaire ; VG = ventricule gauche ; VR = ventricule droit. 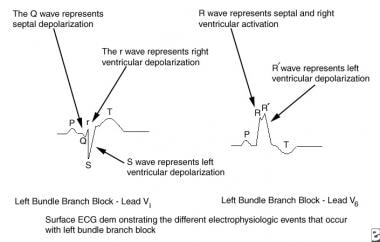 Cette image décrit les événements électrophysiologiques du bloc de branche gauche. ECG = électrocardiogramme.
Cette image décrit les événements électrophysiologiques du bloc de branche gauche. ECG = électrocardiogramme. Le BBG incomplet se présente sous deux formes, chacune étant appelée hémibloc. Dans l’hémibloc antérieur gauche (HAG), la transmission de l’impulsion électrique se fait normalement le long de la branche principale du LBB et du fascicule postérieur, mais elle est bloquée ou retardée dans le fascicule antérieur. Ce blocage entraîne une activation retardée de la partie antérieure du ventricule gauche. En cas de HLA, la durée du complexe QRS peut être normale ou seulement légèrement prolongée en raison d’une conduction rapide normale le long du faisceau principal droit et gauche et du fascicule postérieur gauche. En outre, le complexe QRS est dirigé vers le haut dans le plan frontal. C’est ce que l’on appelle la déviation de l’axe gauche, bien que le terme de déviation de l’axe supérieur décrive plus précisément cette observation. De plus, l’axe du QRS est normalement à gauche ; par conséquent, le terme de déviation de l’axe gauche a peu de sens sémantique.
Avec l’hémibloc postérieur gauche, la transmission de l’impulsion électrique se déroule normalement le long du LBB principal et du fascicule antérieur, mais elle est bloquée dans le fascicule postérieur. Ce blocage entraîne une activation retardée du ventricule gauche postérieur. Le complexe QRS est à nouveau de durée normale ou légèrement prolongée et inscrit un axe vers la droite dans le plan frontal. L’hémibloc postérieur gauche est rarement observé chez les enfants, et le diagnostic est difficile en raison de l’association fréquente d’une déviation de l’axe droit chez les enfants atteints de cardiopathie congénitale et d’hypertrophie ventriculaire droite.