学習目標
- 共有結合の定義
- 共有結合の形成をルイス電子ドット図で説明する
イオン結合は通常、ある原子が一つまたは複数の電子を失うことと別の原子が一つまたは複数の電子を得ることが容易に起こるとき、発生します。 しかし、一部の原子は簡単に電子を手放したり得たりしない。 それでも化合物の形成に参加する。 どのようにして? 完全な価電子帯を得るためのもう1つのメカニズム、それは電子の共有です。
ここで、H原子が1s副殻を満たすために必要な電子は2個だけであることを理解した上で、H原子を用いて共有結合を説明しましょう。 各H原子は価電子帯に1個の電子を持つことから始まる:
The two H atoms can share their electrons:
We can use circles to show that each H atom has two electrons around the nucleus, completely filling each atom’s valence shell.H Atomは価電子帯に2個の電子を持つことから、2個のH原子を共有できる。
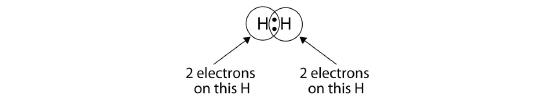
各H原子が価電子帯を満たしているので、この結合は安定で、二原子水素分子を作ることができました。 (簡単のために、2つの点ではなく、ダッシュで共有結合を表現することも珍しくありません。 別の例として、フッ素を考えてみましょう。 F原子は価電子帯に7個の電子を持っています。
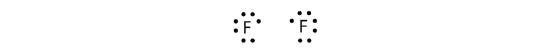
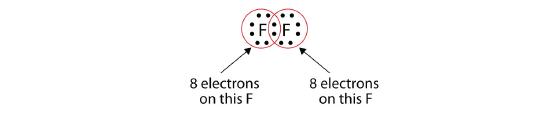
この2つの原子はH原子が行ったのと同じことを行うことができます。

各F原子の周りに完全なオクテットがあることに注意してください:
共有電子ペアを表すためにダッシュを使ってこれを書くこともできます:
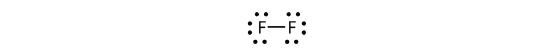
二原子分子のフッ素には二種類の異なる電子が存在するのです。 結合電子対は共有結合を作る。 各フッ素原子は結合に参加しない他の3つの電子のペアを持っています; これらはローンペア電子と呼ばれます。
共有結合は異なる元素の間でも作ることができます。 一例としてHFがあります。 各原子は価電子帯に奇数の電子を持つことから始まります:
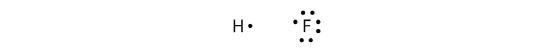
二つの原子はその不対電子を共有して共有結合を作ることができます:
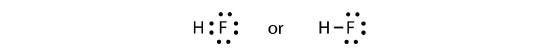
我々は、H原子が電子2個で完全価電子殻を持っているが、F原子は電子の完全8重項を持っていますことに留意してください。
例題:
ルイス電子ドット図を用いて、HBrの共有結合の形成を説明しなさい。
解答
HBrはFの代わりにBrがある以外はHFと非常によく似ています。 原子は以下の通りです:

2つの原子は不対電子を共有できます:
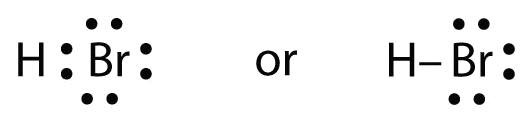
練習問題
ルイス電子ドット図を使って、Cl2での共有結合形成を説明せよ
Answer.White.White.Who Did the Covivalent Bond Formation in the HF in Cl2.With Lines.White.White.Who Did The Covivalent Bond Forming for Lines.Who Did The Covivalent Bond Forming in Cl2.White.White.White.White.White.White.White.Who Did The Covivalant: 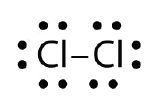
共有結合の構造を扱うとき、電子が余っているように見えることがあります。 これまで習った規則を適用しても、まだ電子がくっつかずにぶら下がっているのです。 そのままにしておくわけにはいきません。
複数の共有結合
原子間に一個の共有結合しか作れないと、八重項則を満たせない分子もあるんです。 分子式が \ce{C_2H_4} であるエテンという化合物を考えてみよう。 炭素原子は互いに結合しており、それぞれの炭素は2つの水素原子とも結合している。
two \(C}) atoms \(= 2 \times 4 = 8 phi) valence electrons
four \(H}) atoms \(= 4 \times 1 = 4 phi) valence electrons
total of 12 分子内の価電子
炭素原子間に単結合を持ち、オクテット則に従ってルイス電子のドット構造を描いた場合。 はこのようになります。

This Lewis structure is incorrect, because it contains a total of 14 electrons.
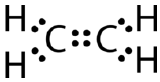
二重共有結合とは、2組の電子を共有する原子によって形成される共有結合のことです。 エタンの2つの炭素原子の間に生じる二重共有結合も、下図のように構造式と分子モデルで表すことができます。 (A) 構造モデルは、2つの炭素原子間の二重共有結合と、水素原子への単結合からなる[sec{C_2H_4}]。 (B) Ⓐの分子モデル。
三重共有結合は、3組の電子を共有する原子によって形成される共有結合である。 窒素は地球の大気の大部分を構成する気体です。 窒素原子は5個の価電子を持ち、1組の電子と3個の単電子で表すことができる。 他の窒素原子と結合して二原子分子を作るとき、それぞれの原子にある3個の単電子が結合して、3組の共有電子を形成します。
各窒素原子はオクテット則に従い、1個の単独電子と6個の原子間共有電子を持ちます。
まとめ
- 共有結合は、原子が電子を共有するときに形成されます。
- ルイス電子ドット図は、共有結合の形成を示すために描かれることがあります。
- 原子間の二重結合や三重結合は、いくつかの分子の結合を適切に説明するために必要かもしれません。
貢献者と帰属
-
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson and Jean Dupon.が、CK-12財団に貢献しました。
- 匿名
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)