Leerdoelen
- Covalente binding definiëren.
- Covalente bindingvorming illustreren met Lewis-elektronpuntdiagrammen.
Ionische binding ontstaat meestal wanneer het voor een atoom gemakkelijk is om een of meer elektronen af te staan en voor een ander atoom om een of meer elektronen te winnen. Sommige atomen zullen echter niet gemakkelijk elektronen afstaan of winnen. Toch nemen ze deel aan de vorming van verbindingen. Hoe? Er is nog een ander mechanisme om een volledige valentieschil te verkrijgen: elektronen delen. Wanneer elektronen worden gedeeld tussen twee atomen, vormen ze een binding die een covalente binding wordt genoemd.
Laten we een covalente binding illustreren aan de hand van H-atomen, met dien verstande dat H-atomen slechts twee elektronen nodig hebben om de 1s subschil te vullen. Elk H-atoom begint met een enkel elektron in zijn valentieschil:
De twee H-atomen kunnen hun elektronen delen:
We kunnen cirkels gebruiken om aan te tonen dat elk H-atoom twee elektronen rond de kern heeft, waardoor de valentieschil van elk atoom volledig wordt gevuld:
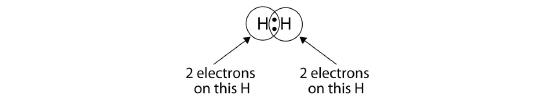
Omdat elk H-atoom een gevulde valentieschil heeft, is deze binding stabiel, en hebben we een diatomisch waterstofmolecuul gemaakt. (Dit verklaart waarom waterstof een van de diatomische elementen is.) Omwille van de eenvoud is het niet ongebruikelijk om de covalente binding met een streepje weer te geven, in plaats van met twee puntjes:
H-H
Omdat twee atomen één elektronenpaar delen, wordt deze covalente binding een enkelvoudige binding genoemd. Een ander voorbeeld is fluor. F-atomen hebben zeven elektronen in hun valentieschil:
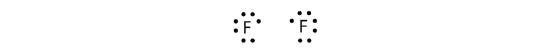
Deze twee atomen kunnen hetzelfde doen als de H-atomen: ze delen hun ongepaarde elektronen om een covalente binding aan te gaan.

Merk op dat elk F-atoom nu een volledig octet om zich heen heeft:
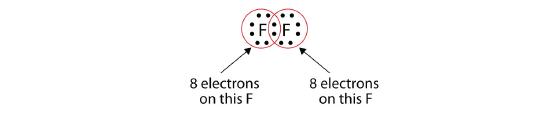
We kunnen dit ook schrijven met een streepje om het gedeelde elektronenpaar weer te geven:
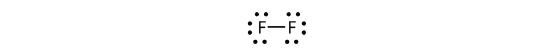
Er zijn twee verschillende soorten elektronen in het fluor-dioatoommolecuul. Het bindende elektronenpaar maakt de covalente binding. Elk F-atoom heeft drie andere elektronenparen die niet deelnemen aan de binding; ze worden lone paar elektronen genoemd. Elk F-atoom heeft één bindingspaar en drie eenzame elektronenparen.
Covalente bindingen kunnen ook tussen verschillende elementen worden gemaakt. Een voorbeeld is HF. Elk atoom begint met een oneven aantal elektronen in zijn valentieschil:
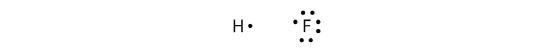
De twee atomen kunnen hun ongepaarde elektronen delen om een covalente binding te maken:
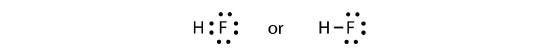
We merken op dat het H-atoom een volledige valentieschil heeft met twee elektronen, terwijl het F-atoom een volledig octet elektronen heeft.
Voorbeeld:
Gebruik Lewis-elektronpuntdiagrammen om de covalente bindingsvorming in HBr te illustreren.
Oplossing
HBr lijkt veel op HF, behalve dat het Br heeft in plaats van F. De atomen zijn als volgt:

De twee atomen kunnen hun ongepaarde elektron delen:
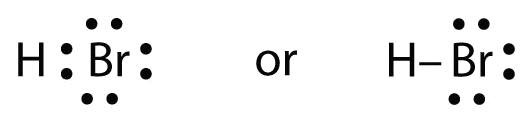
Oefening
Gebruik Lewis-elektronpuntdiagrammen om de covalente bindingsvorming in Cl2 te illustreren.
Antwoord: 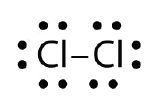
Wanneer je met covalente structuren werkt, lijkt het soms alsof je elektronen over hebt. Je past de regels toe die je tot nu toe geleerd hebt en er zijn nog steeds een paar elektronen die er ongebonden bijhangen. Je kunt ze daar niet gewoon laten. Dus waar laat je ze?
Meervoudige covalente bindingen
Sommige moleculen kunnen niet aan de octetregel voldoen door slechts enkele covalente bindingen tussen de atomen te maken. Neem de verbinding etheen, die een molecuulformule heeft van {C_2H_4}. De koolstofatomen zijn aan elkaar gebonden, waarbij elke koolstof ook is gebonden aan twee waterstofatomen.
twee valentie-elektronen in het molecuul, 2 maal 4 valentie-elektronen, 4 valentie-elektronen in het molecuul, 4 maal 1 valentie-elektronen, totaal 12 valentie-elektronen. valentie-elektronen in het molecuul
Als de Lewis-elektronenstippelstructuur was getekend met een enkele binding tussen de koolstofatomen en met de octetregel gevolgd, zou het er als volgt uitzien:

Deze Lewisstructuur is onjuist omdat deze in totaal 14 elektronen bevat. De Lewisstructuur kan echter worden gewijzigd door de lone pairs op de koolstofatomen te elimineren en twee paren te delen in plaats van slechts één paar.
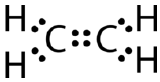
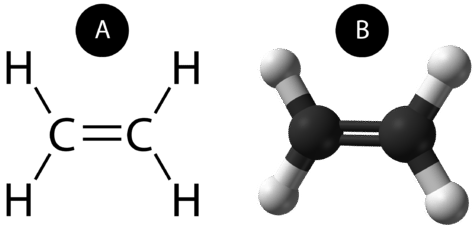
Een dubbele covalente binding is een covalente binding die wordt gevormd door atomen die twee elektronenparen delen. De dubbele covalente binding die optreedt tussen de twee koolstofatomen in ethaan kan ook worden weergegeven met een structuurformule en met een molecuulmodel zoals weergegeven in onderstaande figuur.
Een drievoudige covalente binding is een covalente binding die wordt gevormd door atomen die drie elektronenparen delen. Het element stikstof is een gas dat het grootste deel van de atmosfeer van de aarde uitmaakt. Een stikstofatoom heeft vijf valentie-elektronen, die kunnen worden weergegeven als één paar en drie enkele elektronen. Bij de binding met een ander stikstofatoom tot een diatomisch molecuul vormen de drie enkelvoudige elektronen op elk atoom samen drie gedeelde elektronenparen.
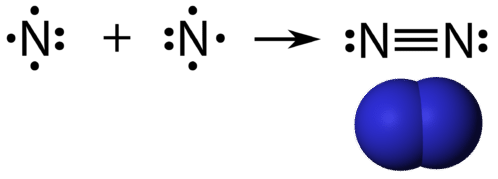
Elk stikstofatoom volgt de octetregel met één eenzaam elektronenpaar en zes elektronen die worden gedeeld tussen de atomen.
Samenvatting
- Covalente bindingen worden gevormd wanneer atomen elektronen delen.
- Lewis-elektronendiagrammen kunnen worden getekend om de vorming van covalente bindingen te illustreren.
- Dubbele of drievoudige bindingen tussen atomen kunnen nodig zijn om de binding in sommige moleculen goed te illustreren.
Bijdragers en toeschrijvingen
-
CK-12 Stichting door Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, en Jean Dupon.
- Anoniem
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)