Learning Objectives
- Define covalent bond.
- Illustrate covalent bond formation with Lewis electron dot diagrams.
Ionic bonding typically occurs when it is easy for one atom to lose one or more electrons and another atom to gain one or more electrons. Jednakże, niektóre atomy nie oddadzą lub zyskają elektrony łatwo. Mimo to nadal biorą udział w tworzeniu związków. W jaki sposób? Istnieje inny mechanizm uzyskiwania pełnej powłoki walencyjnej: dzielenie się elektronami. Kiedy elektrony są dzielone pomiędzy dwa atomy, tworzą one wiązanie zwane wiązaniem kowalencyjnym.
Zilustrujmy wiązanie kowalencyjne używając atomów H, rozumiejąc, że atomy H potrzebują tylko dwóch elektronów do wypełnienia podpowłoki 1s. Każdy atom H zaczyna z jednym elektronem w swojej powłoce walencyjnej:
Dwa atomy H mogą dzielić się swoimi elektronami:
Możemy użyć okręgów aby pokazać, że każdy atom H ma dwa elektrony wokół jądra, całkowicie wypełniając powłokę walencyjną każdego atomu:
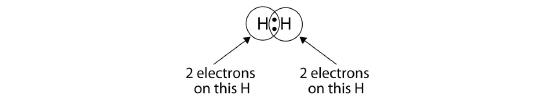
Ponieważ każdy atom H ma wypełnioną powłokę walencyjną, to wiązanie jest stabilne, a my stworzyliśmy cząsteczkę wodoru dwuatomowego. (To wyjaśnia, dlaczego wodór jest jednym z pierwiastków dwuatomowych.) Dla uproszczenia, nie jest niczym niezwykłym przedstawienie wiązania kowalencyjnego za pomocą kreski, zamiast dwóch kropek:
H-H
Ponieważ dwa atomy dzielą jedną parę elektronów, to wiązanie kowalencyjne nazywamy wiązaniem pojedynczym. Jako inny przykład, rozważmy fluor. Atomy F mają siedem elektronów w swojej powłoce walencyjnej:
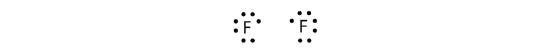
Te dwa atomy mogą zrobić to samo, co atomy H; dzielą się swoimi niesparowanymi elektronami, aby utworzyć wiązanie kowalencyjne.

Zauważ, że każdy atom F ma teraz pełny oktet wokół siebie:
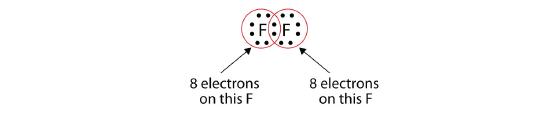
Możemy również napisać to używając myślnika do reprezentowania wspólnej pary elektronów:
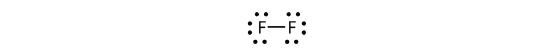
W cząsteczce dwuatomowej fluoru są dwa różne rodzaje elektronów. Wiążąca para elektronów tworzy wiązanie kowalencyjne. Każdy atom F ma trzy inne pary elektronów, które nie uczestniczą w wiązaniu; są one nazywane elektronami samotnej pary. Każdy atom F ma jedną parę wiążącą i trzy samotne pary elektronów.
Wiązania kowalencyjne mogą być wykonane między różnymi elementami, jak również. Jednym z przykładów jest HF. Każdy atom zaczyna z nieparzystą liczbą elektronów w swojej powłoce walencyjnej:
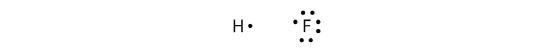
Dwa atomy mogą dzielić się swoimi niesparowanymi elektronami, aby utworzyć wiązanie kowalencyjne:
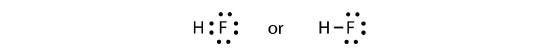
Zauważamy, że atom H ma pełną powłokę walencyjną z dwoma elektronami, podczas gdy atom F ma pełny oktet elektronów.
Przykład:
Użyj diagramów kropek elektronowych Lewisa do zilustrowania tworzenia wiązania kowalencyjnego w HBr.
Roztwór
HBr jest bardzo podobny do HF, z wyjątkiem tego, że zamiast F ma Br. Atomy są następujące:

Dwa atomy mogą dzielić się swoim niesparowanym elektronem:
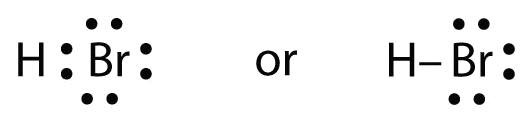
Ćwiczenie:
Użyj diagramów kropek elektronowych Lewisa, aby zilustrować tworzenie wiązania kowalencyjnego w Cl2.
Odpowiedź: 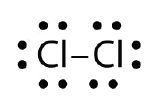
Pracując ze strukturami kowalencyjnymi, czasami wygląda to tak, jakbyś miał resztki elektronów. Stosujesz zasady, których nauczyłeś się do tej pory i wciąż są jakieś elektrony wiszące tam nieprzymocowane. Nie możesz ich tam po prostu zostawić. Więc gdzie je umieścić?
Wielokrotne wiązania kowalencyjne
Niektóre cząsteczki nie są w stanie spełnić reguły oktetu poprzez tworzenie tylko pojedynczych wiązań kowalencyjnych między atomami. Rozważmy związek eten, który ma wzór cząsteczkowy \(\ce{C_2H_4}\). Atomy węgla są połączone ze sobą, przy czym każdy węgiel jest również połączony z dwoma atomami wodoru.
dwa atomy \(\ce{C}} \(= 2 \ razy 4 = 8 \) elektrony walencyjne
cztery atomy \(\ce{H}} \(= 4 \ razy 1 = 4 = 4 \) elektrony walencyjne
ogółem 12 elektrony walencyjne w cząsteczce
Jeżeli struktura kropek elektronowych Lewisa byłaby narysowana z pojedynczym wiązaniem pomiędzy atomami węgla i z zachowaniem zasady oktetu, wyglądałaby ona następująco:

Ta struktura Lewisa jest nieprawidłowa, ponieważ zawiera w sumie 14 elektronów. Strukturę Lewisa można jednak zmienić poprzez wyeliminowanie par samotnych na atomach węgla i konieczność współdzielenia dwóch par zamiast tylko jednej pary.
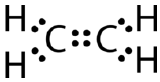
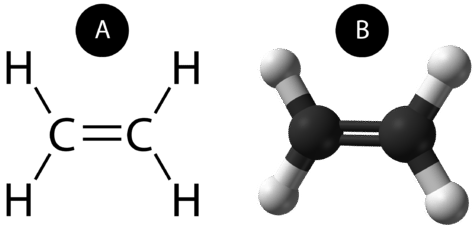
Wiązanie podwójne kowalencyjne to wiązanie kowalencyjne utworzone przez atomy, które dzielą dwie pary elektronów. Podwójne wiązanie kowalencyjne, które występuje między dwoma atomami węgla w etanie, można również przedstawić za pomocą wzoru strukturalnego i za pomocą modelu molekularnego, jak pokazano na poniższym rysunku.
Trójkowe wiązanie kowalencyjne to wiązanie kowalencyjne utworzone przez atomy, które dzielą trzy pary elektronów. Pierwiastek azot jest gazem, który stanowi większość ziemskiej atmosfery. Atom azotu ma pięć elektronów walencyjnych, które mogą być przedstawione jako jedna para i trzy pojedyncze elektrony. Podczas łączenia się z innym atomem azotu w celu utworzenia cząsteczki dwuatomowej, trzy pojedyncze elektrony na każdym atomie łączą się, tworząc trzy współdzielone pary elektronów.
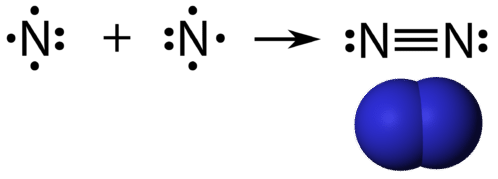
Każdy atom azotu działa zgodnie z regułą oktetu z jedną samotną parą elektronów i sześcioma elektronami, które są współdzielone między atomami.
Podsumowanie
- Wiązania kowalencyjne są tworzone, gdy atomy dzielą się elektronami.
- Diagramy kropek elektronowych Lewisa mogą być rysowane w celu zilustrowania tworzenia wiązań kowalencyjnych.
- Wiązania podwójne lub potrójne między atomami mogą być konieczne do prawidłowego zilustrowania wiązania w niektórych cząsteczkach.
Współautorzy i przypisy
-
Fundacja CK-12 przez Sharon Bewick, Richarda Parsonsa, Therese Forsythe, Shonnę Robinson i Jean Dupon.
- Anonymous
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
.