Cíle učení
- Definice kovalentní vazby.
- Znázornění vzniku kovalentní vazby pomocí Lewisových elektronových bodových diagramů.
Iontová vazba typicky vzniká, když je pro jeden atom snadné ztratit jeden nebo více elektronů a pro jiný atom získat jeden nebo více elektronů. Některé atomy však elektrony snadno neodevzdají ani nezískají. Přesto se stále podílejí na tvorbě sloučenin. Jak? Existuje další mechanismus pro získání kompletní valenční slupky: sdílení elektronů. Když jsou elektrony sdíleny mezi dvěma atomy, vytvářejí vazbu, která se nazývá kovalentní vazba.
Ukážeme si kovalentní vazbu na příkladu atomů H s tím, že atomy H potřebují pouze dva elektrony, aby zaplnily 1s podslupku. Každý atom H začíná s jedním elektronem ve své valenční slupce:
\
Dva atomy H mohou své elektrony sdílet:
\
Můžeme použít kružnice, abychom ukázali, že každý atom H má kolem jádra dva elektrony, které zcela vyplňují valenční slupku každého atomu:
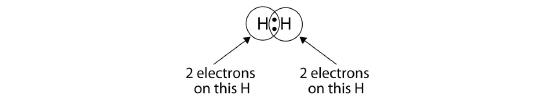
Protože má každý atom H zaplněnou valenční slupku, je tato vazba stabilní a my jsme vytvořili dvouatomovou molekulu vodíku. (To vysvětluje, proč je vodík jedním z dvouatomových prvků.) Pro zjednodušení není neobvyklé znázorňovat kovalentní vazbu pomlčkou místo dvěma tečkami:
H-H
Protože dva atomy sdílejí jeden pár elektronů, nazývá se tato kovalentní vazba jednoduchá vazba. Jako další příklad uveďme fluor. Atomy F mají ve své valenční slupce sedm elektronů:
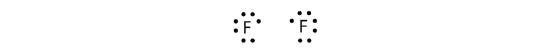
Tyto dva atomy mohou udělat totéž, co udělaly atomy H; sdílejí své nepárové elektrony a vytvářejí kovalentní vazbu.

Všimněte si, že každý atom F má nyní kolem sebe kompletní oktet:
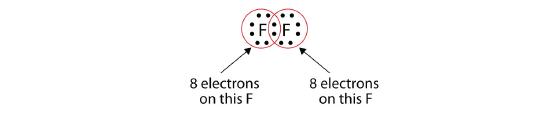
Můžeme to také zapsat pomocí pomlčky, která představuje sdílený elektronový pár:
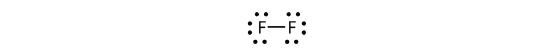
V dvouatomové molekule fluoru jsou dva různé typy elektronů. Vazbový elektronový pár tvoří kovalentní vazbu. Každý atom F má tři další páry elektronů, které se neúčastní vazby; nazývají se osamělé párové elektrony. Každý atom F má jeden vazebný pár a tři osamělé páry elektronů.
Kovalentní vazby mohou vznikat i mezi různými prvky. Jedním z příkladů je HF. Každý atom začíná s lichým počtem elektronů ve své valenční slupce:
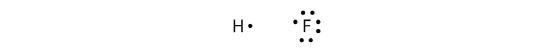
Dva atomy mohou sdílet své nepárové elektrony a vytvořit kovalentní vazbu:
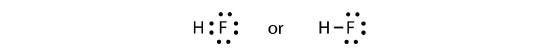
Všimneme si, že atom H má plnou valenční slupku se dvěma elektrony, zatímco atom F má kompletní oktet elektronů.
Příklad \(\PageIndex{1}\):
Pomocí Lewisových elektronových bodových diagramů znázorněte vznik kovalentní vazby v HBr.
Roztok
HBr je velmi podobný HF, jen místo F má Br. Atomy jsou následující:

Dva atomy mohou sdílet svůj nepárový elektron:
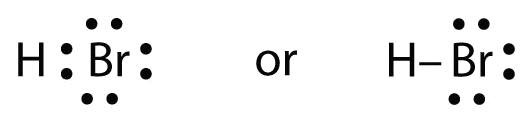
Cvičení \(\PageIndex{1}\)
Použijte Lewisovy elektronové bodové diagramy k znázornění vzniku kovalentní vazby v Cl2.
Odpověď: 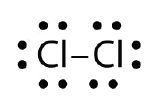
Při práci s kovalentními strukturami to někdy vypadá, že máte zbylé elektrony. Aplikujete pravidla, která jste se dosud naučili, a stále tam visí nějaké nepřipojené elektrony. Nemůžete je tam jen tak nechat. Kam je tedy dáte?“
Vícenásobné kovalentní vazby
Některé molekuly nejsou schopny splnit pravidlo oktetu tím, že mezi atomy vytvoří pouze jednoduché kovalentní vazby. Uvažujme sloučeninu ethen, která má molekulový vzorec \(\ce{C_2H_4}\). Atomy uhlíku jsou navzájem vázány, přičemž každý uhlík je také vázán na dva atomy vodíku.
dva atomy \(\ce{C}\) \(= 2 \krát 4 = 8\) valenčních elektronů
čtyři atomy \(\ce{H}\) \(= 4 \krát 1 = 4\) valenčních elektronů
celkem 12. valenčních elektronů v molekule
Pokud by byla Lewisova elektronová bodová struktura nakreslena s jedinou vazbou mezi atomy uhlíku a s dodržením pravidla oktetu, by vypadala takto:

Tato Lewisova struktura je nesprávná, protože obsahuje celkem 14 elektronů. Lewisovu strukturu však lze změnit tak, že se odstraní osamělé páry na atomech uhlíku a místo jednoho páru se budou sdílet dva.
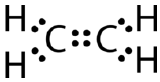
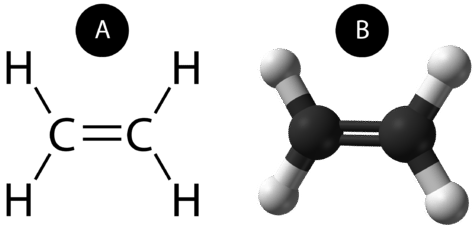
Dvojitá kovalentní vazba je kovalentní vazba tvořená atomy, které sdílejí dva páry elektronů. Dvojnou kovalentní vazbu, která vzniká mezi dvěma atomy uhlíku v ethanu, lze také znázornit strukturním vzorcem a pomocí molekulového modelu, jak je uvedeno na obrázku níže.
Trojitá kovalentní vazba je kovalentní vazba tvořená atomy, které sdílejí tři páry elektronů. Prvek dusík je plyn, který tvoří většinu zemské atmosféry. Atom dusíku má pět valenčních elektronů, které lze znázornit jako jeden pár a tři jednoduché elektrony. Při spojení s jiným atomem dusíku za vzniku dvouatomové molekuly se tři jednoduché elektrony na každém atomu spojí do tří sdílených párů elektronů.
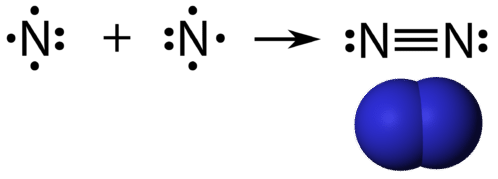
Každý atom dusíku se řídí pravidlem oktetu s jedním osamělým párem elektronů a šesti elektrony, které jsou sdílené mezi atomy.
Souhrn
- Kovalentní vazby vznikají, když atomy sdílejí elektrony.
- K znázornění vzniku kovalentních vazeb lze nakreslit Lewisovy elektronové bodové diagramy.
- Pro správné znázornění vazeb v některých molekulách mohou být nutné dvojné nebo trojné vazby mezi atomy.
Přispěvatelé a atributy
-
Nadace ČK-12 Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson a Jean Dupon.
- Anonymní
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
.