Objetivos de aprendizaje
- Definir el enlace covalente.
- Ilustrar la formación de enlaces covalentes con los diagramas de puntos de electrones de Lewis.
El enlace iónico se produce típicamente cuando es fácil que un átomo pierda uno o más electrones y otro átomo gane uno o más electrones. Sin embargo, algunos átomos no ceden ni ganan electrones fácilmente. Aun así, participan en la formación de compuestos. ¿Cómo? Existe otro mecanismo para obtener una capa de valencia completa: compartir electrones. Cuando los electrones se comparten entre dos átomos, forman un enlace llamado enlace covalente.
Ilustremos un enlace covalente utilizando átomos de H, entendiendo que los átomos de H sólo necesitan dos electrones para llenar la subcáscara 1s. Cada átomo de H comienza con un solo electrón en su cáscara de valencia:
\N-
Los dos átomos de H pueden compartir sus electrones:
\N-
Podemos usar círculos para mostrar que cada átomo de H tiene dos electrones alrededor del núcleo, llenando completamente la cáscara de valencia de cada átomo:
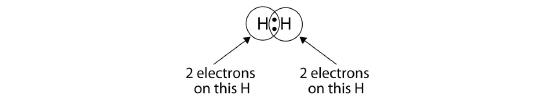
Debido a que cada átomo de H tiene una capa de valencia llena, este enlace es estable, y hemos hecho una molécula de hidrógeno diatómica. (Esto explica por qué el hidrógeno es uno de los elementos diatómicos.) Para simplificar, no es raro representar el enlace covalente con un guión, en lugar de con dos puntos:
H-H
Debido a que dos átomos comparten un par de electrones, este enlace covalente se llama enlace simple. Como otro ejemplo, consideremos el flúor. Los átomos de F tienen siete electrones en su capa de valencia:
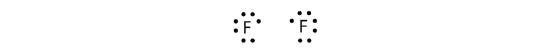
Estos dos átomos pueden hacer lo mismo que los átomos de H; comparten sus electrones no apareados para hacer un enlace covalente.

Nota que cada átomo de F tiene un octeto completo a su alrededor ahora:
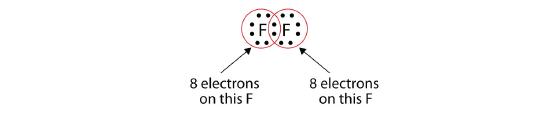
También podemos escribir esto usando un guión para representar el par de electrones compartido:
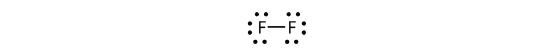
Hay dos tipos diferentes de electrones en la molécula diatómica de flúor. El par de electrones de enlace hace el enlace covalente. Cada átomo de F tiene otros tres pares de electrones que no participan en el enlace; se llaman electrones de par solitario. Cada átomo de F tiene un par de electrones de enlace y tres pares de electrones solitarios.
Los enlaces covalentes también se pueden hacer entre diferentes elementos. Un ejemplo es el HF. Cada átomo comienza con un número impar de electrones en su capa de valencia:
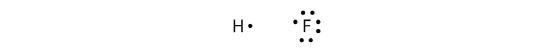
Los dos átomos pueden compartir sus electrones no apareados para hacer un enlace covalente:
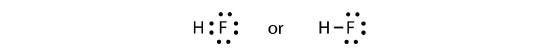
Notamos que el átomo H tiene una capa de valencia completa con dos electrones, mientras que el átomo F tiene un octeto completo de electrones.
Ejemplo \(\PageIndex{1}):
Utilice los diagramas de puntos de electrones de Lewis para ilustrar la formación del enlace covalente en el HBr.
Solución
El HBr es muy similar al HF, excepto que tiene Br en lugar de F. Los átomos son los siguientes:

Los dos átomos pueden compartir su electrón no apareado:
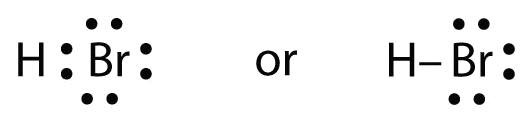
Ejercicio \(\PageIndex{1})
Utilice los diagramas de puntos de electrones de Lewis para ilustrar la formación de enlaces covalentes en Cl2.
Respuesta: 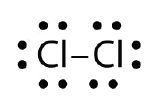
Cuando se trabaja con estructuras covalentes, a veces parece que te sobran electrones. Aplicas las reglas que has aprendido hasta ahora y todavía hay algunos electrones colgando por ahí sin unir. No puedes dejarlos ahí. Entonces, ¿dónde los pones?
Enlaces covalentes múltiples
Algunas moléculas no pueden satisfacer la regla del octeto haciendo sólo enlaces covalentes simples entre los átomos. Consideremos el compuesto eteno, que tiene una fórmula molecular de \ce{C_2H_4}\). Los átomos de carbono están unidos entre sí, y cada carbono está unido también a dos átomos de hidrógeno.
dos átomos de \ce{C}\\N(= 2 veces 4 = 8\N) electrones de valencia
cuatro átomos de \ce{H}\N(= 4 veces 1 = 4\N) electrones de valencia
total de 12 electrones de valencia en la molécula
Si se dibujara la estructura de puntos de electrones de Lewis con un solo enlace entre los átomos de carbono y con la regla del octeto, se vería así:

Esta estructura de Lewis es incorrecta porque contiene un total de 14 electrones. Sin embargo, la estructura de Lewis se puede cambiar eliminando los pares solitarios de los átomos de carbono y teniendo que compartir dos pares en lugar de un solo par.
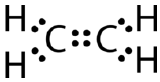
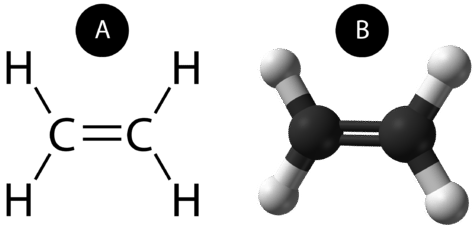
Un enlace covalente doble es un enlace covalente formado por átomos que comparten dos pares de electrones. El doble enlace covalente que se produce entre los dos átomos de carbono del etano también puede representarse mediante una fórmula estructural y con un modelo molecular, como se muestra en la siguiente figura.
Un enlace covalente triple es un enlace covalente formado por átomos que comparten tres pares de electrones. El elemento nitrógeno es un gas que compone la mayor parte de la atmósfera terrestre. Un átomo de nitrógeno tiene cinco electrones de valencia, que pueden mostrarse como un par y tres electrones simples. Cuando se combina con otro átomo de nitrógeno para formar una molécula diatómica, los tres electrones simples de cada átomo se combinan para formar tres pares de electrones compartidos.
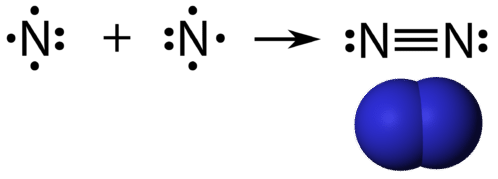
Cada átomo de nitrógeno sigue la regla del octeto con un par solitario de electrones y seis electrones que se comparten entre los átomos.
Resumen
- Los enlaces covalentes se forman cuando los átomos comparten electrones.
- Se pueden dibujar diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes.
- Pueden ser necesarios dobles enlaces o triples enlaces entre átomos para ilustrar adecuadamente la formación de enlaces en algunas moléculas.
Contribuidores y Atribuciones
-
FundaciónCK-12 por Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson y Jean Dupon.
- Anónimo
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)