6.9 Varför absorberar objekt som de gör?
Atmosfären absorberar en betydande mängd strålning i det infraröda området men ganska lite i det synliga. Vi ser också att gaser absorberar starkt vid vissa våglängder och inte vid andra. Varför är det så?
För att besvara denna fråga måste vi titta på konfigurationen hos de elektroner som zoomar runt atomer och molekyler. För mer än 100 år sedan började forskare använda prismor för att sprida ljuset från solen och från lågor som innehåller olika grundämnen. Medan solen gav regnbågens färger hade lågorna ljus i mycket tydliga linjer eller band. Denna gåta löstes slutligen för lite mer än 100 år sedan med uppfinningen av kvantmekaniken, som i princip säger att elektronerna som susar runt atomer och molekyler och molekylernas vibrationer och rotationer endast kan ha diskreta energier som styrs av regler för bevarande av vinkelmoment.

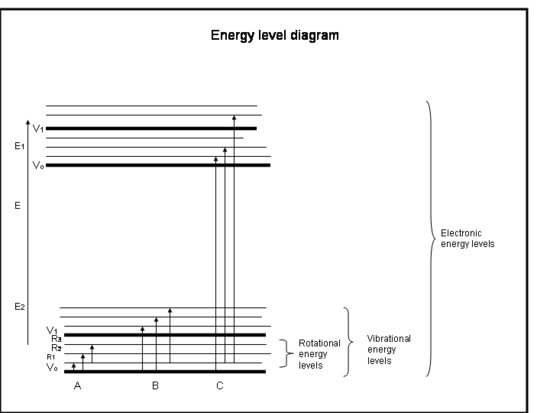
Den följande uppräknade listan är en snabbkurs i absorption av elektronerna i atomer och molekyler. Se figuren under rutan.
Snabbkurs: Absorption av elektronerna i atomer och molekyler
- Kemiska bindningar och kvantmekanik bestämmer tillsammans de energinivåer som en elektron, atom eller molekyl kan befinna sig i.
- Energin i en molekyl är summan av den energi som är relaterad till elektronernas position i förhållande till deras stabila grundelektroniska tillstånd, den molekylära vibrationen och den molekylära rotationen.
- Absorption sker när fotonens energi matchar skillnaden mellan två energinivåer i en molekyl, ΔE = Efinal – Einitial = hc/λ.
- Regler som fastställs av bevarande av vinkelmoment och elektronspinn bestämmer vilka övergångar mellan energinivåer som tillåts.
- Mängden absorption, som helt enkelt kallas absorptions-tvärsnittet, σ, beror på många faktorer, men varierar avsevärt från molekyl till molekyl och från övergång till övergång. Tvärsnittet har dimensioner av area och har vanligen enheterna cm2.
- Elektroniska övergångar inträffar när elektronerna faktiskt hoppar in i andra banor runt kärnorna. De har energier som motsvarar strålning (dvs. fotoner) i ultravioletta till synliga våglängder.
- Vibrationella övergångar inträffar när molekylen vibrerar med en annan frekvens eller på ett annat sätt. Diatomära molekyler (t.ex. O2 och N2) har bara ett sätt att vibrera – fram och tillbaka längs den kemiska bindning som binder dem. Men mer komplicerade molekyler (t.ex. H2O och CO2) kan vibrera inte bara genom att kärnorna går mot och bort från varandra, utan också genom att böja sig i tre riktningar. Dessa vibrationsövergångar, tillsammans med rörelser som kombinerar vibration och rotation, har energier som motsvarar den nära och mellersta infraröda strålningen (dvs. fotoner).
- Rotationsövergångar uppstår när en molekyl ändrar sin rotationshastighet. Dessa övergångar har energier som motsvarar strålning (dvs, Fotoner) i de långt infraröda till radiovågsvåglängderna.
- Translationsenergierna hos molekyler i jordens atmosfär, ~kT, är i allmänhet lite större än den energi som krävs för att gå från en rotationsnivå till en annan, 10-100 gånger mindre än den energi som krävs för att gå från en vibrationsnivå till en annan, och hundratals till tusentals gånger mindre än vad som krävs för att gå från en elektronisk nivå till en annan.
- Vi har redan sett att vissa molekyler och atomer har mer kinetisk energi än andra. Alla molekyler med kinetisk energi som är större än energidifferensen mellan rotationsnivåerna kan kollidera med molekylen och ge den tillräckligt med rotationsenergi för att övergå till en högre rotationsnivå. Vi ser alltså att rotationsenergin fördelas över många rotationsnivåer, men att vibrations- och elektronnivåerna vanligen är grundnivåerna (lägsta energinivåerna).
- Atomer har inte molekylliknande vibrationer och rotationer eftersom de bara har en atomkärna, så deras spektrum består bara av elektroniska övergångar.
- En skarp övergång från en diskret nivå till en annan, som framträder som en linje i ett spektrum, inträffar i ett snävt energimåttområde kring skillnaden i övergångsenergi. Den resulterande strålningen förekommer i ett smalt band av våglängder kring linjens centrala våglängd. Bredden på denna linje (mätt vid halva linjens maximala höjd) kallas linjebredd.
- Denna naturliga linjebredd kan breddas av molekylens rörelse, så kallad dopplerbreddning, eller av kollisioner, så kallad tryckbreddning.
- Högst upp i atmosfären är dopplerbreddningen dominerande eftersom trycket är lågt, men lägre upp i atmosfären blir tryckbreddningen dominerande även om dopplerbreddningen också ökar. Absorptionslinjerna är alltså bredare nära jordytan än de är högre upp i atmosfären.
Absorptionstvärsnittet, σ, varierar avsevärt över absorptionslinjens bredd. Det är alltså möjligt att all strålning absorberas i mitten av linjen men att mycket lite absorberas i ”vingarna”.”
Fysikalisk tolkning
Atomer och molekyler kan absorbera strålning (en foton) endast om deras struktur har en energidifferens mellan nivåerna som motsvarar fotons energi (hc/λ). I annat fall kommer atomen eller molekylen inte att absorbera ljuset. När molekylen har absorberat fotonen kan den antingen förlora en foton och gå tillbaka till sin ursprungliga lägre energinivå, eller så kan den brytas sönder om fotonenergin är större än den kemiska bindning som håller ihop molekylen, eller så kan den kollidera med andra molekyler, t.ex. N2 eller O2, och överföra energi till dem samtidigt som den går tillbaka till sin lägre energinivå. Kollisioner sker ofta, så energin från den absorberade fotonen överförs ofta till värmeenergi.
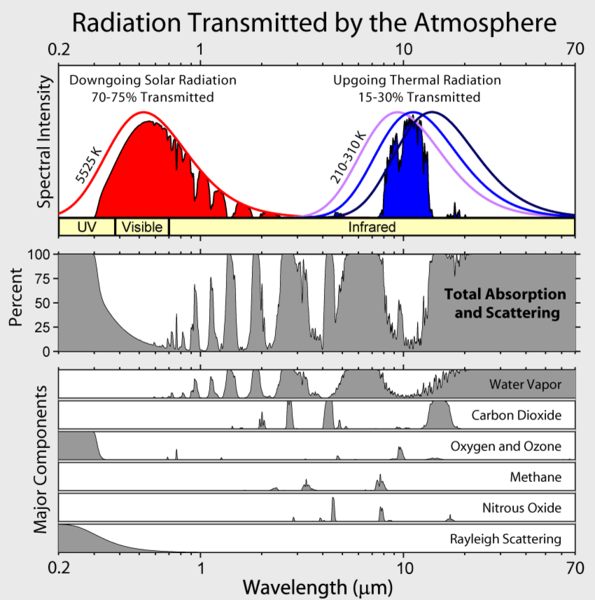
Bemärk att jordens utgående infraröda strålning är begränsad till några få atmosfäriska ”fönster” och att strålningen vid alla andra våglängder absorberas kraftigt, främst av vattenånga, men också av koldioxid, ozon, dikväveoxid, metan och andra mer spårbara gaser som inte visas i figuren ovan.