6.9 De ce absorb obiectele în felul în care o fac?
Atmosfera absoarbe o cantitate semnificativă de radiații în infraroșu, dar destul de puțin în vizibil. De asemenea, observăm că gazele absorb puternic la unele lungimi de undă și nu la altele. De ce se întâmplă acest lucru?
Pentru a răspunde la această întrebare, trebuie să ne uităm la configurațiile electronilor care se rotesc în jurul atomilor și moleculelor. În urmă cu mai bine de 100 de ani, oamenii de știință au început să folosească prisme pentru a dispersa lumina de la soare și de la flăcările care conțineau diferite elemente. În timp ce soarele dădea culorile curcubeului, flăcările aveau lumina în linii sau benzi foarte distincte. Această enigmă a fost în cele din urmă rezolvată cu puțin peste 100 de ani în urmă, odată cu inventarea mecanicii cuantice, care spune, în esență, că electronii care fac zob în jurul atomilor și moleculelor, precum și vibrațiile și rotațiile moleculelor nu pot avea decât energii discrete care sunt guvernate de regulile de conservare a momentului cinetic.

Lista cu buline de mai jos este un curs intensiv de absorbție de către electronii din atomi și molecule. Consultați figura de sub caseta de mai jos.
Curs rapid: Absorbția de către electronii din atomi și molecule
- Legăturile chimice și mecanica cuantică determină împreună nivelurile de energie în care se poate afla orice electron, atom sau moleculă.
- Eneria unei molecule este suma energiei legate de poziția electronilor în raport cu stările electronice stabile de masă, vibrația moleculară și rotația moleculară.
- Absorbția are loc atunci când energia fotonului se potrivește cu diferența dintre două niveluri de energie dintr-o moleculă, ΔE = Efinal – Einitial = hc/λ.
- Reguli stabilite prin conservarea momentului unghiular și a spinului electronic determină ce tranziții între nivelurile de energie sunt permise.
- Cantitatea de absorbție, numită pur și simplu secțiune transversală de absorbție, σ, provine din mai mulți factori, dar variază semnificativ de la o moleculă la alta și de la o tranziție la alta. Secțiunea transversală are dimensiuni de arie și are în mod obișnuit unități de cm2.
- Transițiile electronice au loc atunci când electronii sar efectiv pe alte orbite în jurul nucleelor. Ele au energii care sunt echivalente cu radiații (adică fotoni) în lungimile de undă de la ultraviolet până la vizibil.
- Transițiile vibraționale apar atunci când molecula vibrează la o frecvență diferită sau într-un mod diferit. Moleculele diatomice (de exemplu, O2 și N2) au un singur mod de a vibra – înapoi și înainte de-a lungul legăturii chimice care le unește. Dar moleculele mai complicate (de exemplu, H2O și CO2) pot vibra nu numai cu nucleele care se apropie și se îndepărtează unul de celălalt, ci și prin îndoirea în trei direcții. Aceste tranziții vibraționale, însoțite de mișcări care combină vibrația și rotația, au energii echivalente cu radiația infraroșie apropiată și medie (adică fotonii).
- Transițiile rotaționale apar atunci când o moleculă își schimbă viteza de rotație. Aceste tranziții au energii echivalente cu cele ale radiației (i.e, fotoni) în infraroșu îndepărtat până la lungimile de undă ale undelor radio.
- Energia de translație a moleculelor din atmosfera Pământului, ~kT, este în general puțin mai mare decât energia necesară pentru a trece de la un nivel de rotație la altul, de 10-100 de ori mai mică decât energia necesară pentru a trece de la un nivel de vibrație la altul și de sute până la mii de ori mai mică decât ceea ce este necesar pentru a trece de la un nivel electronic la altul.
- Am văzut deja că unele molecule și atomi au mai multă energie cinetică decât alții. Toate moleculele cu energie cinetică mai mare decât diferența de energie dintre nivelurile de rotație pot intra în coliziune cu molecula și îi pot da acesteia suficientă energie de rotație pentru a trece la un nivel de rotație superior. Astfel, observăm că energia de rotație este distribuită pe mai multe niveluri de rotație, dar că nivelurile vibraționale și electronice sunt, de obicei, nivelurile fundamentale (cu cea mai mică energie).
- Atomii nu au vibrații și rotații asemănătoare moleculelor, deoarece au un singur nucleu, astfel încât spectrele lor constau numai din tranziții electronice.
- O tranziție bruscă de la un nivel discret la altul, care apare ca o linie într-un spectru, are loc într-un interval îngust de energii în jurul diferenței de energie de tranziție. Radiația rezultată apare într-o bandă îngustă de lungimi de undă în jurul lungimii de undă centrale a liniei. Lățimea acestei linii (măsurată la jumătatea înălțimii maxime a liniei) se numește lățimea liniei.
- Această lățime naturală a liniei poate fi lărgită de mișcarea moleculei, numită lărgire Doppler, sau de coliziuni, numită lărgire de presiune.
- La înălțime în atmosferă, lărgirea Doppler este dominantă, deoarece presiunea este scăzută, dar mai jos în atmosferă, lărgirea de presiune devine dominantă, chiar dacă lărgirea Doppler crește și ea. Astfel, liniile de absorbție sunt mai largi în apropierea suprafeței Pământului decât mai sus în atmosferă.
Secțiunea transversală de absorbție, σ, variază semnificativ pe lățimea liniei de absorbție. Astfel, este posibil ca toată radiația să fie absorbită în mijlocul liniei, dar să fie absorbită foarte puțin în „aripi”.”
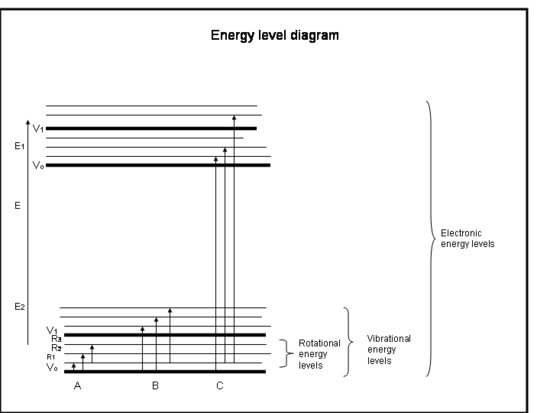
Interpretare fizică
Atomii și moleculele pot absorbi radiații (un foton) numai dacă structura lor are o diferență de energie între niveluri care se potrivește cu energia fotonului (hc/λ). În caz contrar, atomul sau molecula nu va absorbi lumina. Odată ce molecula a absorbit fotonul, aceasta poate fie pierde un foton și se poate întoarce la nivelul său inițial de energie mai scăzut, fie se poate rupe în bucăți dacă energia fotonului este mai mare decât legătura chimică care ține molecula împreună, fie se poate ciocni cu alte molecule, cum ar fi N2 sau O2, și le poate transfera energie în timp ce se întoarce la nivelul său de energie mai scăzut. Coliziunile au loc des, astfel încât energia fotonului absorbit este adesea transferată în energie termică.
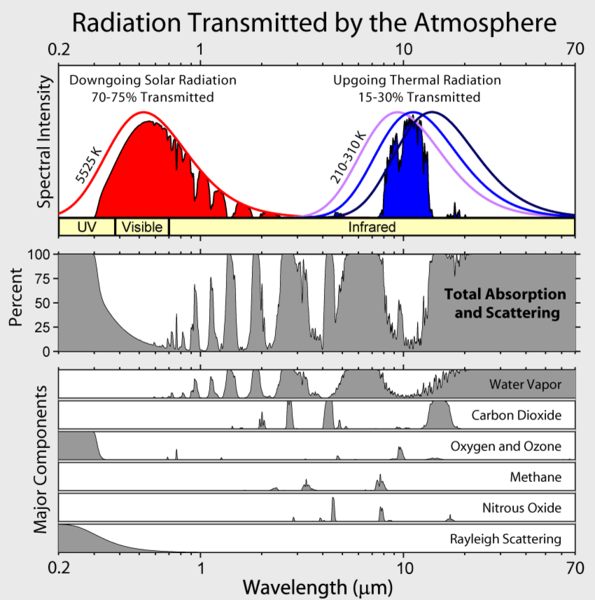
Rețineți că iradierea în infraroșu a Pământului este limitată la câteva „ferestre” atmosferice, iar iradierea la toate celelalte lungimi de undă este puternic absorbită, în principal de vaporii de apă, dar și de dioxidul de carbon, ozonul, protoxidul de azot, metanul și alte gaze mai puțin vizibile care nu sunt prezentate în figura de mai sus.