6.9 Perché gli oggetti assorbono come fanno?
L’atmosfera assorbe una quantità significativa di radiazioni nell’infrarosso ma piuttosto poco nel visibile. Inoltre, vediamo che i gas assorbono fortemente ad alcune lunghezze d’onda e non ad altre. Perché questo?
Per rispondere a questa domanda, dobbiamo guardare le configurazioni degli elettroni che girano intorno agli atomi e alle molecole. Più di 100 anni fa, gli scienziati cominciarono ad usare i prismi per disperdere la luce del sole e delle fiamme contenenti elementi diversi. Mentre il sole dava i colori dell’arcobaleno, le fiamme avevano luce in linee o bande molto distinte. Questo enigma è stato finalmente risolto poco più di 100 anni fa con l’invenzione della meccanica quantistica, che fondamentalmente dice che gli elettroni che girano intorno agli atomi e alle molecole e le vibrazioni e rotazioni delle molecole possono avere solo energie discrete che sono governate da regole di conservazione del momento angolare.

Il seguente elenco puntato è un corso intensivo di assorbimento da parte degli elettroni in atomi e molecole. Fate riferimento alla figura sotto il riquadro.
Corso intensivo: Assorbimento da parte degli elettroni negli atomi e nelle molecole
- I legami chimici e la meccanica quantistica determinano insieme i livelli di energia in cui ogni elettrone, atomo o molecola può trovarsi.
- L’energia di una molecola è la somma dell’energia relativa alla posizione degli elettroni rispetto ai loro stati elettronici di terra stabili, la vibrazione molecolare e la rotazione molecolare.
- L’assorbimento avviene quando l’energia del fotone corrisponde alla differenza tra due livelli energetici in una molecola, ΔE = Efinal – Einitial = hc/λ.
- Le regole stabilite dalla conservazione del momento angolare e dello spin degli elettroni determinano quali transizioni tra livelli energetici sono permesse.
- La quantità di assorbimento, chiamata semplicemente sezione trasversale di assorbimento, σ, deriva da molti fattori, ma varia notevolmente da molecola a molecola e da transizione a transizione. La sezione trasversale ha dimensioni di area e comunemente ha unità di cm2.
- Le transizioni elettroniche avvengono quando gli elettroni saltano effettivamente in altre orbite intorno ai nuclei. Hanno energie equivalenti alla radiazione (cioè ai fotoni) nelle lunghezze d’onda dall’ultravioletto al visibile.
- Le transizioni vibrazionali avvengono quando la molecola vibra a una frequenza diversa o in modo diverso. Le molecole biatomiche (per esempio, O2 e N2) hanno un solo modo di vibrare: avanti e indietro lungo il legame chimico che le lega. Ma molecole più complicate (per esempio, H2O e CO2) possono vibrare non solo con i nuclei che vanno verso e lontano l’uno dall’altro, ma anche piegandosi in tre direzioni. Queste transizioni vibrazionali, accompagnate da movimenti che combinano vibrazione e rotazione, hanno energie equivalenti alla radiazione dell’infrarosso vicino e medio (cioè i fotoni).
- Le transizioni rotazionali avvengono quando una molecola cambia la sua velocità di rotazione. Queste transizioni hanno energie equivalenti alla radiazione (cioè fotoni) nel lontano infrarosso fino alle lunghezze d’onda delle onde radio.
- Le energie traslazionali delle molecole nell’atmosfera terrestre, ~kT, sono generalmente un po’ più grandi dell’energia richiesta per passare da un livello rotazionale ad un altro, 10-100 volte meno dell’energia richiesta per andare da un livello vibrazionale ad un altro, e da centinaia a migliaia di volte meno di quella richiesta per andare da un livello elettronico ad un altro.
- Abbiamo già visto che alcune molecole e atomi hanno più energia cinetica di altri. Tutte le molecole con un’energia cinetica più grande della differenza di energia tra i livelli rotazionali possono scontrarsi con la molecola e darle abbastanza energia rotazionale per passare ad un livello rotazionale superiore. Così, vediamo che l’energia rotazionale è distribuita su molti livelli rotazionali, ma che i livelli vibrazionali ed elettronici sono di solito i livelli di terra (energia più bassa).
- Gli atomi non hanno vibrazioni e rotazioni simili alle molecole perché hanno un solo nucleo, quindi i loro spettri consistono solo di transizioni elettroniche.
- Una transizione netta da un livello discreto ad un altro, che appare come una linea in uno spettro, si verifica in una stretta gamma di energie circa la differenza di energia di transizione. La radiazione risultante si presenta in una stretta banda di lunghezze d’onda intorno alla lunghezza d’onda centrale della linea. La larghezza di questa linea (misurata a metà dell’altezza massima della linea) è chiamata larghezza di linea.
- Questa larghezza di linea naturale può essere ampliata dal movimento della molecola, chiamato allargamento Doppler, o da collisioni, chiamato allargamento di pressione.
- In alto nell’atmosfera, l’allargamento Doppler è dominante perché la pressione è bassa, ma in basso nell’atmosfera, l’allargamento di pressione diventa dominante anche se l’allargamento Doppler aumenta. Quindi le linee di assorbimento sono più larghe vicino alla superficie terrestre che più in alto nell’atmosfera.
La sezione trasversale di assorbimento, σ, varia significativamente sulla larghezza della linea di assorbimento. Quindi è possibile che tutta la radiazione sia assorbita al centro della linea, ma che sia assorbita molto poco nelle “ali”.”
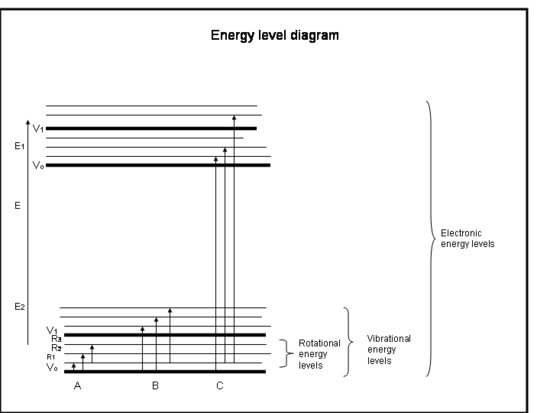
Interpretazione fisica
Atomi e molecole possono assorbire la radiazione (un fotone) solo se la loro struttura ha una differenza di energia tra livelli che corrisponde all’energia del fotone (hc/λ). Altrimenti, l’atomo o la molecola non assorbiranno la luce. Una volta che la molecola ha assorbito il fotone, può perdere un fotone e tornare al suo livello energetico inferiore originale; oppure può rompersi se l’energia del fotone è maggiore del legame chimico che tiene insieme la molecola; oppure può scontrarsi con altre molecole, come N2 o O2, e trasferire energia ad esse mentre torna al suo livello energetico inferiore. Le collisioni avvengono spesso, quindi l’energia del fotone assorbito viene spesso trasferita in energia termica.
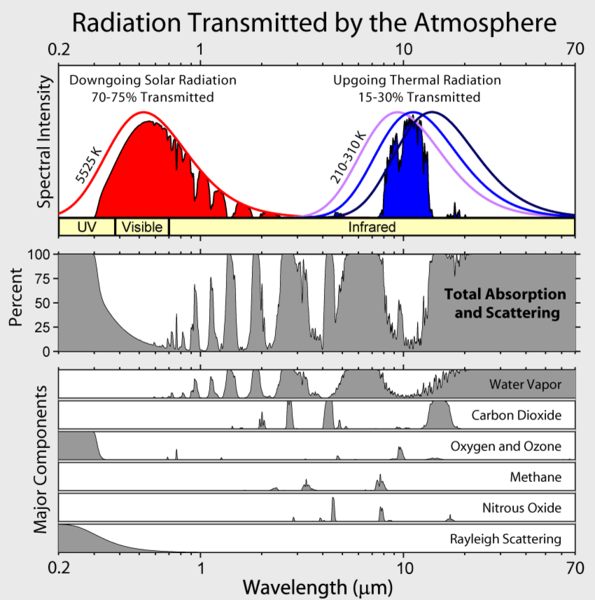
Nota che l’irradianza infrarossa in uscita dalla Terra è limitata a poche “finestre” atmosferiche e l’irradianza a tutte le altre lunghezze d’onda è fortemente assorbita, soprattutto dal vapore acqueo, ma anche da anidride carbonica, ozono, protossido di azoto, metano e altri gas più traccia che non sono mostrati nella figura sopra.