6.9 Warum absorbieren Objekte so, wie sie es tun?
Die Atmosphäre absorbiert eine beträchtliche Menge an Strahlung im Infraroten, aber eher wenig im Sichtbaren. Wir sehen auch, dass Gase bei einigen Wellenlängen stark absorbieren und bei anderen nicht. Warum ist das so?
Um diese Frage zu beantworten, müssen wir uns die Konfigurationen der Elektronen ansehen, die um Atome und Moleküle herumschwirren. Vor mehr als 100 Jahren begannen Wissenschaftler, Prismen zu verwenden, um das Licht der Sonne und von Flammen mit verschiedenen Elementen zu streuen. Während die Sonne die Farben des Regenbogens lieferte, war das Licht der Flammen in sehr deutlichen Linien oder Bändern zu sehen. Dieses Rätsel wurde schließlich vor etwas mehr als 100 Jahren mit der Erfindung der Quantenmechanik gelöst, die im Wesentlichen besagt, dass die Elektronen, die um Atome und Moleküle herumschwirren, und die Schwingungen und Drehungen der Moleküle nur diskrete Energien haben können, die den Regeln der Drehimpulserhaltung unterliegen.

Die folgende Aufzählung ist ein Crash-Kurs über die Absorption durch Elektronen in Atomen und Molekülen. Siehe die Abbildung unter dem Kasten.
Crashkurs: Absorption durch Elektronen in Atomen und Molekülen
- Chemische Bindungen und Quantenmechanik bestimmen gemeinsam die Energieniveaus, in denen sich ein Elektron, ein Atom oder ein Molekül befinden kann.
- Die Energie eines Moleküls ist die Summe der Energie, die sich aus der Position der Elektronen relativ zu ihren stabilen elektronischen Grundzuständen, der Molekülschwingung und der Molekülrotation ergibt.
- Absorption tritt auf, wenn die Energie des Photons mit der Differenz zwischen zwei Energieniveaus in einem Molekül übereinstimmt, ΔE = Efinal – Einitial = hc/λ.
- Die Regeln der Drehimpulserhaltung und des Elektronenspins bestimmen, welche Übergänge zwischen den Energieniveaus erlaubt sind.
- Das Ausmaß der Absorption, einfach Absorptionsquerschnitt σ genannt, wird von vielen Faktoren bestimmt, variiert aber erheblich von Molekül zu Molekül und von Übergang zu Übergang. Der Wirkungsquerschnitt hat die Dimension der Fläche und wird üblicherweise in cm2 angegeben.
- Elektronische Übergänge treten auf, wenn die Elektronen tatsächlich in andere Bahnen um die Kerne springen. Sie haben Energien, die einer Strahlung (d.h. Photonen) im ultravioletten bis sichtbaren Wellenlängenbereich entsprechen.
- Schwingungsübergänge treten auf, wenn das Molekül mit einer anderen Frequenz oder auf eine andere Weise schwingt. Zweiatomige Moleküle (z. B. O2 und N2) können nur auf eine Weise schwingen – hin und her entlang der chemischen Bindung, die sie verbindet. Kompliziertere Moleküle (z. B. H2O und CO2) können jedoch nicht nur schwingen, indem sich die Kerne aufeinander zu und voneinander weg bewegen, sondern auch, indem sie sich in drei Richtungen biegen. Diese Schwingungsübergänge, die mit Bewegungen einhergehen, die Schwingung und Rotation kombinieren, haben Energien, die der Strahlung im nahen und mittleren Infrarot (d.h. Photonen) entsprechen.
- Rotationsübergänge treten auf, wenn ein Molekül seine Rotationsgeschwindigkeit ändert. Diese Übergänge haben Energien, die der Strahlung (d. h.,
- Die Translationsenergien der Moleküle in der Erdatmosphäre, ~kT, sind im Allgemeinen etwas größer als die Energie, die erforderlich ist, um von einem Rotationsniveau zu einem anderen zu gelangen, 10-100 mal kleiner als die Energie, die erforderlich ist, um von einem Vibrationsniveau zu einem anderen zu gelangen, und hunderte bis tausende Male kleiner als die Energie, die erforderlich ist, um von einem elektronischen Niveau zu einem anderen zu gelangen.
- Wir haben bereits gesehen, dass einige Moleküle und Atome mehr kinetische Energie haben als andere. Alle Moleküle mit einer kinetischen Energie, die größer ist als die Energiedifferenz zwischen den Rotationsniveaus, können mit dem Molekül zusammenstoßen und ihm genug Rotationsenergie geben, um in ein höheres Rotationsniveau zu wechseln. Wir sehen also, dass die Rotationsenergie über viele Rotationsniveaus verteilt ist, aber dass die Vibrations- und Elektronenniveaus in der Regel die Grundniveaus (mit der niedrigsten Energie) sind.
- Atome haben keine molekülähnlichen Vibrationen und Rotationen, weil sie nur einen Kern haben, so dass ihre Spektren nur aus elektronischen Übergängen bestehen.
- Ein scharfer Übergang von einem diskreten Niveau zu einem anderen, der als Linie in einem Spektrum erscheint, tritt in einem engen Energiebereich um die Übergangsenergiedifferenz auf. Die daraus resultierende Strahlung tritt in einem schmalen Band von Wellenlängen um die zentrale Wellenlänge der Linie auf. Die Breite dieser Linie (gemessen bei der Hälfte der maximalen Höhe der Linie) wird als Linienbreite bezeichnet.
- Diese natürliche Linienbreite kann durch die Bewegung des Moleküls verbreitert werden, was als Dopplerverbreiterung bezeichnet wird, oder durch Zusammenstöße, was als Druckverbreiterung bezeichnet wird.
- Hoch in der Atmosphäre ist die Dopplerverbreiterung vorherrschend, weil der Druck niedrig ist, aber tiefer in der Atmosphäre wird die Druckverbreiterung vorherrschend, obwohl die Dopplerverbreiterung ebenfalls zunimmt. Die Absorptionslinien sind also in der Nähe der Erdoberfläche breiter als weiter oben in der Atmosphäre.
Der Absorptionsquerschnitt σ variiert erheblich über die Breite der Absorptionslinie. So ist es möglich, dass die gesamte Strahlung in der Mitte der Linie absorbiert wird, während in den „Flügeln“ nur sehr wenig absorbiert wird.
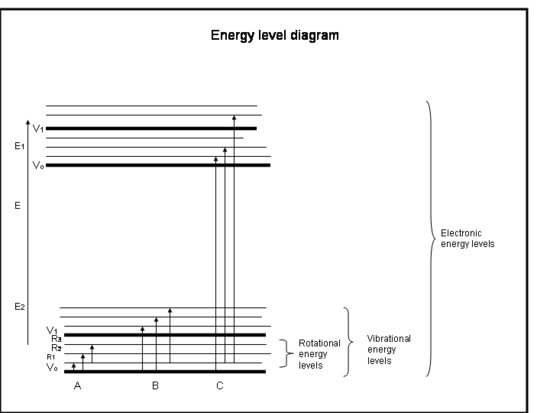
Physikalische Interpretation
Atome und Moleküle können nur dann Strahlung (ein Photon) absorbieren, wenn ihre Struktur einen Energieunterschied zwischen den Niveaus aufweist, der der Energie des Photons (hc/λ) entspricht. Andernfalls wird das Atom oder Molekül das Licht nicht absorbieren. Sobald das Molekül das Photon absorbiert hat, kann es entweder ein Photon verlieren und auf sein ursprüngliches niedrigeres Energieniveau zurückkehren, oder es kann auseinanderbrechen, wenn die Photonenenergie größer ist als die chemische Bindung, die das Molekül zusammenhält, oder es kann mit anderen Molekülen, wie N2 oder O2, zusammenstoßen und Energie an diese abgeben, während es auf sein niedrigeres Energieniveau zurückkehrt. Kollisionen kommen häufig vor, so dass die Energie des absorbierten Photons oft in Wärmeenergie umgewandelt wird.
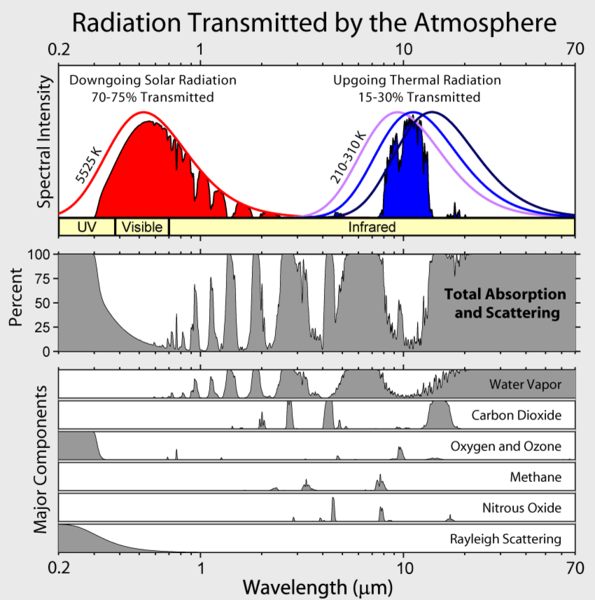
Man beachte, dass die von der Erde ausgehende Infrarotstrahlung auf einige wenige atmosphärische „Fenster“ beschränkt ist und die Strahlung bei allen anderen Wellenlängen stark absorbiert wird, vor allem durch Wasserdampf, aber auch durch Kohlendioxid, Ozon, Distickstoffoxid, Methan und andere Spurengase, die in der obigen Abbildung nicht dargestellt sind.