Lärandemål
- Definiera kovalent bindning.
- Illustrera bildandet av kovalenta bindningar med hjälp av Lewis-elektronpunktdiagram.
Ionisk bindning uppkommer typiskt sett när det är lätt för en atom att förlora en eller flera elektroner och en annan atom att få en eller flera elektroner. Vissa atomer avger eller får dock inte lätt elektroner. Ändå deltar de ändå i bildandet av föreningar. Hur då? Det finns en annan mekanism för att få ett komplett valensskal: att dela elektroner. När elektroner delas mellan två atomer bildar de en bindning som kallas kovalent bindning.
Låt oss illustrera en kovalent bindning med hjälp av H-atomer, med tanke på att H-atomer bara behöver två elektroner för att fylla 1s-subskalet. Varje H-atom börjar med en enda elektron i sitt valensskal:
\
De två H-atomerna kan dela på sina elektroner:
\
Vi kan använda cirklar för att visa att varje H-atom har två elektroner runt kärnan, vilket fullständigt fyller varje atoms valensskal:
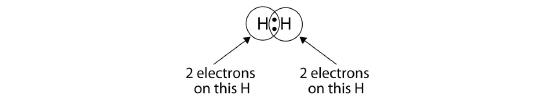
Då varje H-atom har ett fyllt valensskal är denna bindning stabil och vi har skapat en tvåatomig vätemolekyl. (Detta förklarar varför väte är ett av de tvåatomiga grundämnena.) För enkelhetens skull är det inte ovanligt att representera den kovalenta bindningen med ett streck i stället för med två punkter:
H-H
Om två atomer delar på ett elektronpar kallas denna kovalenta bindning för en enkelbindning. Ett annat exempel är fluor. F-atomer har sju elektroner i sitt valensskal:
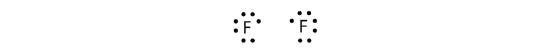
Dessa två atomer kan göra samma sak som H-atomerna gjorde; de delar sina oparade elektroner för att skapa en kovalent bindning.

Bemärk att varje F-atom har en komplett oktett runt sig nu:
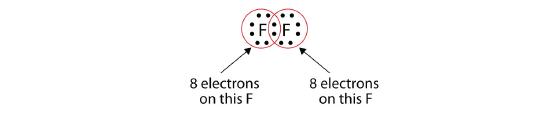
Vi kan också skriva detta med hjälp av ett bindestreck för att representera det delade elektronparet:
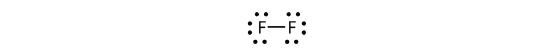
Det finns två olika typer av elektroner i den diatomiska fluormolekylen. Det bindande elektronparet skapar den kovalenta bindningen. Varje F-atom har tre andra elektronpar som inte deltar i bindningen; de kallas lone pair-elektroner. Varje F-atom har ett bindande elektronpar och tre ensamma elektronpar.
Kovalenta bindningar kan också göras mellan olika grundämnen. Ett exempel är HF. Varje atom börjar med ett udda antal elektroner i sitt valensskal:
De två atomerna kan dela med sig av sina oparade elektroner för att skapa en kovalent bindning:
Vi noterar att H-atomen har ett fullt valensskal med två elektroner, medan F-atomen har en komplett oktett av elektroner.
Exempel \(\PageIndex{1}\):
Använd Lewis elektronpunktdiagram för att illustrera bildandet av kovalenta bindningar i HBr.
Lösning
HBr är mycket lik HF, förutom att det har Br i stället för F. Atomerna ser ut på följande sätt:

De två atomerna kan dela på sin oparade elektron:
Övningsuppgift \(\PageIndex{1}\)
Använd Lewis elektronpunktdiagram för att illustrera bildandet av den kovalenta bindningen i Cl2.
Svar: 
När man arbetar med kovalenta strukturer ser det ibland ut som om man har överblivna elektroner. Du tillämpar de regler du lärt dig hittills och det finns fortfarande några elektroner som hänger där ute utan att vara bundna. Du kan inte bara lämna dem där. Så var lägger man dem?
Mångfaldiga kovalenta bindningar
Vissa molekyler kan inte uppfylla oktettregeln genom att bara göra enkla kovalenta bindningar mellan atomerna. Tänk på föreningen eten, vars molekylformel är \(\ce{C_2H_4}\). Kolatomerna är bundna till varandra och varje kolatom är också bunden till två väteatomer.
två \(\ce{C}\) atomer \(= 2 \ gånger 4 = 8\) valenceelektroner
fyra \(\ce{H}\) atomer \(= 4 \ gånger 1 = 4\) valenceelektroner
total 12 valenceelektroner i molekylen
Om Lewis-elektronernas punktstruktur ritades med en enkel bindning mellan kolatomerna och med oktettregeln följd, skulle den se ut så här:

Denna Lewisstruktur är felaktig eftersom den innehåller totalt 14 elektroner. Lewisstrukturen kan dock ändras genom att eliminera de ensamma paren på kolatomerna och att de måste dela på två par istället för bara ett par.
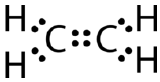
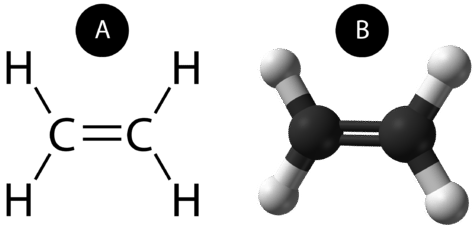
En dubbel kovalent bindning är en kovalent bindning som bildas av atomer som delar två elektronpar. Den dubbla kovalenta bindningen som uppstår mellan de två kolatomerna i etan kan också representeras med en strukturformel och med en molekylmodell som visas i figuren nedan.
En trippelkovalent bindning är en kovalent bindning som bildas av atomer som delar tre elektronpar. Grundämnet kväve är en gas som utgör större delen av jordens atmosfär. En kväveatom har fem valenceelektroner, som kan visas som ett par och tre enskilda elektroner. När de kombineras med en annan kväveatom för att bilda en tvåatomig molekyl, kombineras de tre enskilda elektronerna på varje atom för att bilda tre delade elektronpar.
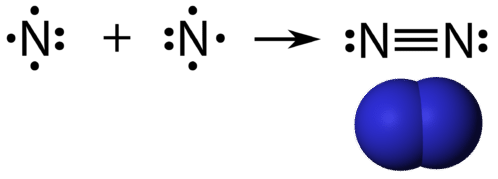
Varje kväveatom följer oktettregeln med ett ensamt elektronpar och sex elektroner som delas mellan atomerna.
Sammanfattning
- Kovalenta bindningar bildas när atomer delar elektroner.
- Lewis elektronpunktsdiagram kan ritas för att illustrera bildandet av kovalenta bindningar.
- Dubbelbindningar eller trippelbindningar mellan atomer kan vara nödvändiga för att korrekt illustrera bindningarna i vissa molekyler.
Contributors and Attributions
-
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Anonym
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)