Obiective de învățare
- Definiți legătura covalentă.
- Ilustrați formarea legăturii covalente cu ajutorul diagramelor cu puncte electronice Lewis.
Legătura ionică apare de obicei atunci când este ușor pentru un atom să piardă unul sau mai mulți electroni și pentru un alt atom să câștige unul sau mai mulți electroni. Cu toate acestea, unii atomi nu cedează sau nu câștigă electroni cu ușurință. Cu toate acestea, ei participă totuși la formarea compușilor. Cum? Există un alt mecanism de obținere a unui înveliș de valență complet: schimbul de electroni. Atunci când electronii sunt partajați între doi atomi, aceștia realizează o legătură numită legătură covalentă.
Să ilustrăm o legătură covalentă folosind atomi de H, înțelegând că atomii de H au nevoie doar de doi electroni pentru a umple subshell-ul 1s. Fiecare atom de H începe cu un singur electron în învelișul de valență:
\
Cei doi atomi de H își pot împărți electronii:
\
Potem folosi cercuri pentru a arăta că fiecare atom de H are doi electroni în jurul nucleului, umplând complet învelișul de valență al fiecărui atom:
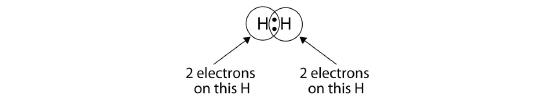
Pentru că fiecare atom de H are un strat de valență plin, această legătură este stabilă și am realizat o moleculă de hidrogen diatomic. (Acest lucru explică de ce hidrogenul este unul dintre elementele diatomice.) De dragul simplității, nu este neobișnuit să reprezentăm legătura covalentă cu o liniuță, în loc de două puncte:
H-H
Pentru că doi atomi împart o pereche de electroni, această legătură covalentă se numește legătură simplă. Ca un alt exemplu, luați în considerare fluorul. Atomii de F au șapte electroni în învelișul de valență:
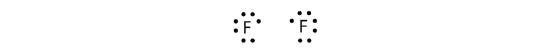
Cei doi atomi pot face același lucru pe care l-au făcut atomii de H; ei își împart electronii nepereche pentru a face o legătură covalentă.

Observați că fiecare atom F are acum un octet complet în jurul său:
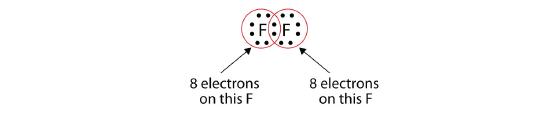
Potem scrie, de asemenea, acest lucru folosind o liniuță pentru a reprezenta perechea de electroni partajați:
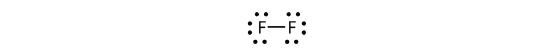
Există două tipuri diferite de electroni în molecula diatomică de fluor. Perechea de electroni de legătură realizează legătura covalentă. Fiecare atom de F are alte trei perechi de electroni care nu participă la legătură; ele se numesc electroni de pereche solitară. Fiecare atom de F are o pereche de electroni de legătură și trei perechi de electroni solitari.
Legăturile covalente se pot realiza și între elemente diferite. Un exemplu este HF. Fiecare atom începe cu un număr impar de electroni în învelișul de valență:
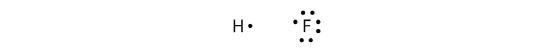
Cei doi atomi își pot împărți electronii nepereche pentru a realiza o legătură covalentă:
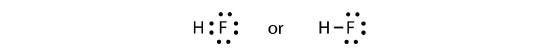
Notăm că atomul H are un înveliș de valență complet cu doi electroni, în timp ce atomul F are un octet complet de electroni.
Exemplu \(\PageIndex{1}\):
Utilizați diagramele cu puncte electronice Lewis pentru a ilustra formarea legăturii covalente în HBr.
Soluția
HBr este foarte asemănător cu HF, cu excepția faptului că are Br în loc de F. Atomii sunt după cum urmează:

Cei doi atomi își pot împărți electronul nepereche:
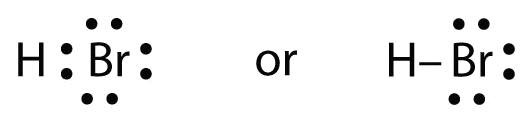
Exercițiu \(\PageIndex{1}\)
Utilizați diagramele cu puncte electronice Lewis pentru a ilustra formarea legăturii covalente în Cl2.
Răspundeți: 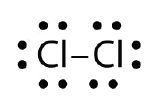
Când se lucrează cu structuri covalente, uneori se pare că aveți electroni restanți. Aplici regulile pe care le-ai învățat până acum și încă mai sunt câțiva electroni care atârnă neatașați. Nu poți să-i lași acolo pur și simplu. Deci, unde îi pui?
Legături covalente multiple
Câteva molecule nu sunt capabile să satisfacă regula octetului făcând doar legături covalente simple între atomi. Luați în considerare compusul etenă, care are formula moleculară \(\ce{C_2H_4}\). Atomii de carbon sunt legați între ei, fiecare atom de carbon fiind, de asemenea, legat de doi atomi de hidrogen.
doi atomi de \(\ce{C}\) \(= 2 \ ori 4 = 8\) electroni de valență
patru atomi de \(\ce{H}\) \(= 4 \ ori 1 = 4\) electroni de valență
total de 12 electroni de valență în moleculă
Dacă structura cu puncte electronice Lewis a fost desenată cu o singură legătură între atomii de carbon și cu respectarea regulii octetului, ar arăta în felul următor:

Această structură Lewis este incorectă deoarece conține un total de 14 electroni. Cu toate acestea, structura Lewis poate fi modificată prin eliminarea perechilor singuratice de pe atomii de carbon și prin faptul că trebuie să împartă două perechi în loc de o singură pereche.
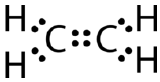
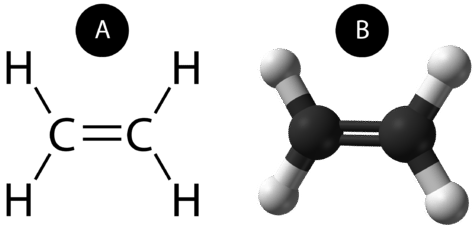
O legătură covalentă dublă este o legătură covalentă formată de atomi care împart două perechi de electroni. Legătura covalentă dublă care apare între cei doi atomi de carbon din etenă poate fi reprezentată și printr-o formulă structurală și cu un model molecular, așa cum se arată în figura de mai jos.
O legătură covalentă triplă este o legătură covalentă formată de atomi care împart trei perechi de electroni. Elementul azot este un gaz care compune cea mai mare parte a atmosferei terestre. Un atom de azot are cinci electroni de valență, care pot fi reprezentați sub forma unei perechi și a trei electroni simpli. Atunci când se combină cu un alt atom de azot pentru a forma o moleculă diatomică, cei trei electroni unici de pe fiecare atom se combină pentru a forma trei perechi comune de electroni.
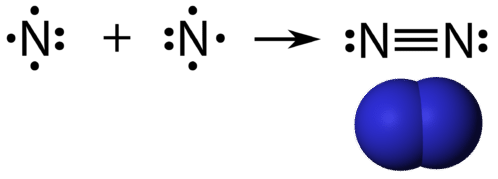
Care atom de azot urmează regula octetului cu o pereche de electroni solitari și șase electroni care sunt împărțiți între atomi.
Rezumat
- Legăturile covalente se formează atunci când atomii împart electroni.
- Pentru a ilustra formarea legăturilor covalente pot fi desenate diagramele cu puncte electronice Lewis.
- Pot fi necesare legături duble sau legături triple între atomi pentru a ilustra în mod corespunzător legăturile din unele molecule.
Contribuții și atribuții
-
FundațiaCK-12 de Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson și Jean Dupon.
- Anonim
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
.