6.9 Porque é que os objectos absorvem da forma como o fazem?
Atmosfera absorve uma quantidade significativa de radiação no infravermelho, mas bastante pequena no visível. Além disso, vemos que os gases absorvem fortemente em alguns comprimentos de onda e não em outros. Porque é que isto?
Para responder a esta pergunta, precisamos de olhar para as configurações dos electrões que estão a fazer zoom à volta dos átomos e moléculas. Há mais de 100 anos, os cientistas começaram a usar prismas para dispersar a luz do sol e das chamas que continham diferentes elementos. Enquanto o sol dava as cores do arco-íris, as chamas tinham luz em linhas ou bandas muito distintas. Este puzzle foi finalmente resolvido há pouco mais de 100 anos com a invenção da mecânica quântica, que basicamente diz que os electrões que fazem zoom em torno dos átomos e moléculas e as vibrações e rotações das moléculas podem ter apenas energias discretas que são regidas por regras de conservação do momento angular.

A seguinte lista de bulleted é um curso de choque na absorção pelos elétrons em átomos e moléculas. Consulte a figura abaixo da caixa.
Curso de colisão: Absorção pelos elétrons em átomos e moléculas
- As ligações químicas e mecânica quântica juntas determinam os níveis de energia que qualquer elétron, átomo ou molécula pode ter.
- A energia de uma molécula é a soma da energia relacionada com a posição dos elétrons em relação aos seus estados eletrônicos terrestres estáveis, a vibração molecular, e a rotação molecular.
- Absorção ocorre quando a energia do fotão corresponde à diferença entre dois níveis de energia numa molécula, ΔE = Efinal – Einicial = hc/λ.
- Regras estabelecidas pela conservação do momento angular e do spin dos electrões determinam quais as transições entre níveis de energia que são permitidas.
- A quantidade de absorção, chamada simplesmente de secção transversal de absorção, σ, vem de muitos factores, mas varia significativamente de molécula para molécula e de transição para transição. A seção transversal tem dimensões de área e geralmente tem unidades de cm2.
- Transições eletrônicas ocorrem quando os elétrons realmente saltam para outras órbitas ao redor dos núcleos. Eles têm energias equivalentes à radiação (isto é, fótons) no ultravioleta para comprimentos de onda visíveis.
- Transições vibratórias ocorrem quando a molécula vibra em uma freqüência diferente ou de uma maneira diferente. As moléculas diatómicas (por exemplo, O2 e N2) têm apenas uma forma de vibrar para a frente e para trás ao longo da ligação química que as liga. Mas moléculas mais complicadas (por exemplo, H2O e CO2) podem vibrar não só com os núcleos indo em direção e afastando-se uns dos outros, mas também dobrando-se em três direções. Estas transições vibracionais, acompanhadas de movimentos que combinam vibração e rotação, têm energias equivalentes à radiação infravermelha próxima e média (isto é, fótons).
- Transições rotacionais ocorrem quando uma molécula muda sua taxa de rotação. Estas transições têm energias equivalentes à radiação (i.e., fótons), fótons) no infravermelho distante para comprimentos de onda de rádio.
- As energias translaccionais das moléculas na atmosfera terrestre, ~kT, são geralmente um pouco maiores que a energia necessária para passar de um nível de rotação para outro, 10-100 vezes menos que a energia necessária para passar de um nível vibracional para outro, e centenas a milhares de vezes menos que a energia necessária para passar de um nível electrónico para outro.
- Já vimos que algumas moléculas e átomos têm mais energia cinética que outras. Todas as moléculas com energia cinética maior que a diferença de energia entre os níveis rotacionais podem colidir com a molécula e dar-lhe energia rotacional suficiente para mudar para um nível rotacional superior. Assim, vemos que a energia rotacional está distribuída por muitos níveis rotacionais, mas que os níveis vibracionais e electrónicos são normalmente os níveis de terra (energia mais baixa).
- Os átomos não têm vibrações e rotações semelhantes às das moléculas porque têm apenas um núcleo, pelo que os seus espectros consistem apenas em transições electrónicas.
- Uma transição brusca de um nível discreto para outro, que aparece como uma linha num espectro, ocorre numa gama estreita de energias sobre a diferença de energia de transição. A radiação resultante ocorre em uma faixa estreita de comprimentos de onda sobre o comprimento de onda central da linha. A largura desta linha (medida na metade da altura máxima da linha) é chamada de largura de linha.
- Esta largura de linha natural pode ser ampliada pelo movimento da molécula, chamado Doppler alargando, ou por colisões, chamado de alargamento de pressão.
- Alto na atmosfera, Doppler alargando é dominante porque a pressão é baixa, mas mais baixa na atmosfera, alargamento de pressão torna-se dominante mesmo que Doppler alargando também aumenta. Assim, as linhas de absorção são mais largas perto da superfície terrestre do que são mais altas na atmosfera.
A secção transversal de absorção, σ, varia significativamente ao longo da largura da linha de absorção. Assim, é possível que toda a radiação seja absorvida no meio da linha, mas muito pouco absorvida nas “asas”
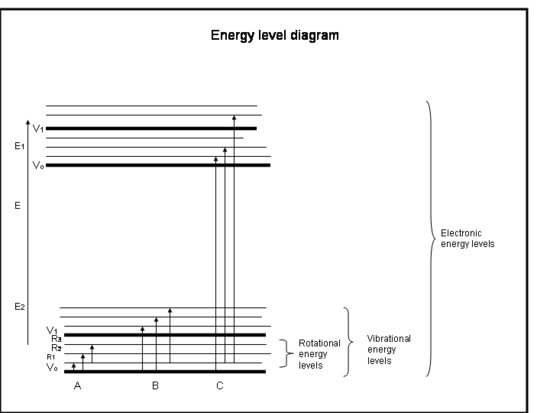
Interpretação Física
Atomos e moléculas só podem absorver radiação (um fotão) se a sua estrutura tiver uma diferença de energia entre níveis que corresponda à energia do fotão (hc/λ). Caso contrário, o átomo ou molécula não irá absorver a luz. Uma vez que a molécula tenha absorvido o fotão, pode perder um fotão e voltar ao seu nível original de energia inferior; ou pode desfazer-se se a energia do fotão for maior do que a ligação química que mantém a molécula junta; ou pode colidir com outras moléculas, tais como N2 ou O2, e transferir energia para elas enquanto volta ao seu nível de energia inferior. As colisões acontecem frequentemente, portanto a energia do fotão absorvido é frequentemente transferida para energia térmica.
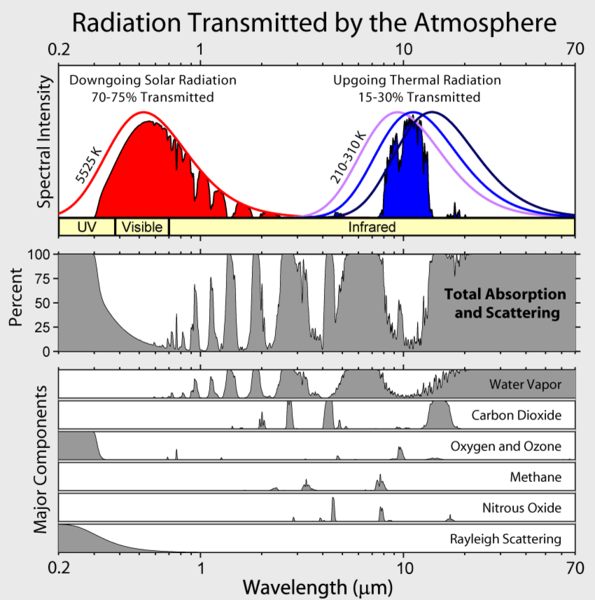
Notem que a irradiação infravermelha de saída da Terra é limitada a algumas “janelas” atmosféricas e a irradiação em todos os outros comprimentos de onda é fortemente absorvida, principalmente pelo vapor de água, mas também pelo dióxido de carbono, ozônio, óxido nitroso, metano e outros gases mais vestigiais que não são mostrados na figura acima.