Objetivos de aprendizado
- Definir ligação covalente.
- Illustrate formação de ligação covalente com diagramas de pontos eletrônicos Lewis.
A ligaçãoônica tipicamente ocorre quando é fácil para um átomo perder um ou mais elétrons e outro átomo ganhar um ou mais elétrons. Entretanto, alguns átomos não desistem ou ganham elétrons facilmente. No entanto, eles ainda participam na formação de compostos. Como? Há outro mecanismo para obter uma concha de valência completa: compartilhando elétrons. Quando os electrões são partilhados entre dois átomos, eles fazem uma ligação chamada ligação covalente.
Deixe-nos ilustrar uma ligação covalente usando átomos H, com o entendimento de que os átomos H precisam apenas de dois electrões para preencher a subesfera de 1s. Cada átomo de H começa com um único electrão na sua concha de valência:
Os dois átomos de H podem partilhar os seus electrões:
Podemos usar círculos para mostrar que cada átomo de H tem dois electrões à volta do núcleo, preenchendo completamente a concha de valência de cada átomo:
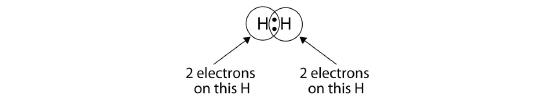
Porque cada átomo de H tem uma concha de valência cheia, esta ligação é estável, e fizemos uma molécula de hidrogénio diatómica. (Isto explica porque é que o hidrogénio é um dos elementos diatómicos). Para simplificar, não é invulgar representar a ligação covalente com um traço, em vez de com dois pontos:
H-H
Porque dois átomos partilham um par de electrões, esta ligação covalente é chamada uma ligação única. Como outro exemplo, considere o flúor. Os átomos F têm sete electrões na sua casca de valência:
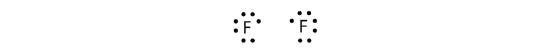
Estes dois átomos podem fazer a mesma coisa que os átomos H fizeram; eles partilham os seus electrões não pareados para fazer uma ligação covalente.
>
Nota que cada átomo F tem agora um octeto completo à sua volta:
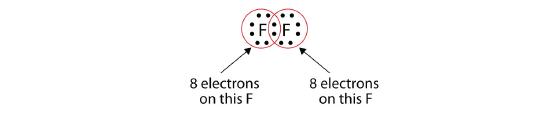
Também podemos escrever isto usando um traço para representar o par de electrões partilhados:
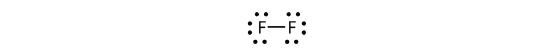 >
>
Existem dois tipos diferentes de electrões na molécula diatómica do flúor. O par de elétrons de ligação faz a ligação covalente. Cada átomo F tem três outros pares de elétrons que não participam da ligação; eles são chamados de pares solitários de elétrons. Cada átomo F tem um par de elétrons de ligação e três pares de elétrons solitários.
As ligações covalentes também podem ser feitas entre diferentes elementos. Um exemplo é HF. Cada átomo começa com um número ímpar de electrões na sua concha de valência:
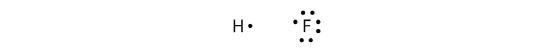
Os dois átomos podem partilhar os seus electrões não pareados para fazer uma ligação covalente:
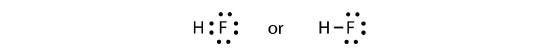
Notemos que o átomo H tem uma concha de valência completa com dois electrões, enquanto que o átomo F tem um octeto completo de electrões.
Exemplo \(\PageIndex{1}}):
Utilizar diagramas de pontos electrónicos Lewis para ilustrar a formação de ligação covalente no HBr.
>
Solução
HBr é muito semelhante a HF, excepto que tem Br em vez de F. Os átomos são os seguintes:

Os dois átomos podem partilhar o seu electrão não pareado:
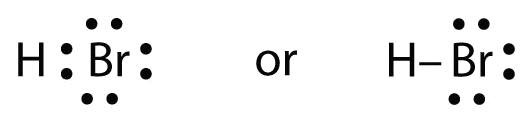
Exercício \(\PageIndex{1}})
Utilizar diagramas de pontos electrónicos Lewis para ilustrar a formação de ligação covalente em Cl2.
Resposta: 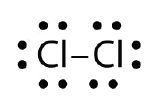
Quando se trabalha com estruturas covalentes, às vezes parece que se tem restos de electrões. Você aplica as regras que aprendeu até agora e ainda há alguns elétrons pendurados lá fora sem ligação. Você não pode simplesmente deixá-los lá. Então onde você os coloca?
Ligações Covalentes Múltiplas
Algumas moléculas não são capazes de satisfazer a regra do octeto fazendo apenas ligações covalentes entre os átomos. Considere o eteno composto, que tem uma fórmula molecular de {C_2H_4}). Os átomos de carbono são ligados entre si, sendo que cada carbono também é ligado a dois átomos de hidrogénio.
dois átomos de valência
dois átomos de valência
de quatro átomos de valência
de quatro átomos de valência
total de 12 electrões de valência na molécula
Se a estrutura de pontos electrónicos de Lewis fosse desenhada com uma única ligação entre os átomos de carbono e com a regra do octeto seguida, pareceria assim:

Esta estrutura de Lewis está incorrecta porque contém um total de 14 electrões. No entanto, a estrutura de Lewis pode ser alterada eliminando os pares únicos nos átomos de carbono e tendo de partilhar dois pares em vez de apenas um par.
>
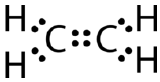
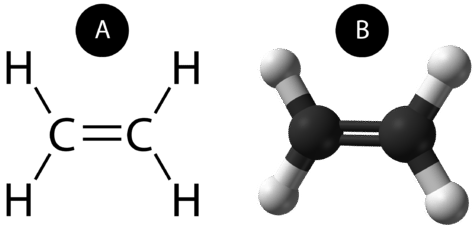
A dupla ligação covalente é uma ligação covalente formada por átomos que partilham dois pares de electrões. A dupla ligação covalente que ocorre entre os dois átomos de carbono no etano também pode ser representada por uma fórmula estrutural e com um modelo molecular como mostrado na figura abaixo.
A ligação covalente tripla é uma ligação covalente formada por átomos que compartilham três pares de elétrons. O elemento nitrogênio é um gás que compõe a maior parte da atmosfera terrestre. Um átomo de nitrogênio tem cinco elétrons de valência, que podem ser mostrados como um par e três elétrons simples. Quando combinados com outro átomo de nitrogênio para formar uma molécula diatômica, os três elétrons simples em cada átomo combinam para formar três pares compartilhados de elétrons.
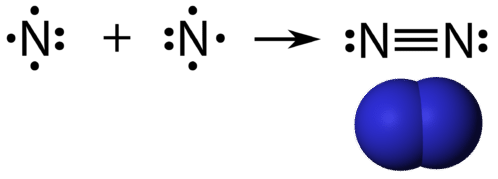
Cada átomo de azoto segue a regra do octeto com um único par de electrões e seis electrões que são partilhados entre os átomos.
Sumário
- As ligações covalentes formam-se quando os átomos partilham electrões.
- Digramas de pontos de electrões Lewis podem ser desenhados para ilustrar a formação de ligações covalentes.
- As ligações duplas ou triplas entre átomos podem ser necessárias para ilustrar adequadamente a ligação em algumas moléculas.
Contribuintes e Atribuições
-
CK-12 Foundation de Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, e Jean Dupon.
- Anónimo
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)