6.9 Dlaczego obiekty pochłaniają promieniowanie w taki sposób, w jaki to robią?
Atmosfera pochłania znaczną ilość promieniowania w podczerwieni, ale raczej niewiele w zakresie widzialnym. Widzimy również, że gazy silnie absorbują przy niektórych długościach fal, a przy innych nie. Dlaczego tak jest?
Aby odpowiedzieć na to pytanie, musimy przyjrzeć się konfiguracjom elektronów, które krążą wokół atomów i cząsteczek. Ponad 100 lat temu naukowcy zaczęli używać pryzmatów do rozpraszania światła pochodzącego ze słońca oraz z płomieni zawierających różne pierwiastki. Podczas gdy słońce dawało kolory tęczy, płomienie miały światło w bardzo wyraźnych liniach lub pasmach. Ta zagadka została ostatecznie rozwiązana nieco ponad 100 lat temu wraz z wynalezieniem mechaniki kwantowej, która zasadniczo mówi, że elektrony krążące wokół atomów i cząsteczek oraz wibracje i obroty cząsteczek mogą mieć tylko dyskretne energie, które są regulowane przez zasady zachowania pędu.

Następująca lista wypunktowana jest kursem poglądowym na temat absorpcji przez elektrony w atomach i cząsteczkach. Odnieś się do rysunku poniżej pola.
Crash Course: Absorpcja przez elektrony w atomach i cząsteczkach
- Wiązania chemiczne i mechanika kwantowa wspólnie określają poziomy energetyczne, na których może znajdować się każdy elektron, atom lub cząsteczka.
- Energia cząsteczki jest sumą energii związanej z położeniem elektronów względem ich stabilnych stanów elektronowych, drgań molekularnych i rotacji molekularnej.
- Absorpcja zachodzi, gdy energia fotonu odpowiada różnicy pomiędzy dwoma poziomami energetycznymi w cząsteczce, ΔE = Efinal – Einitial = hc/λ.
- Reguły określone przez zachowanie pędu i spinu elektronu określają, które przejścia pomiędzy poziomami energetycznymi są dozwolone.
- Wielkość absorpcji, zwana po prostu przekrojem poprzecznym absorpcji, σ, wynika z wielu czynników, ale różni się znacznie w zależności od cząsteczki i przejścia. Przekrój poprzeczny ma wymiary powierzchni i powszechnie ma jednostki cm2.
- Przejścia elektronowe występują, gdy elektrony faktycznie przeskakują na inne orbity wokół jąder. Mają energie, które są równoważne do promieniowania (tj. fotonów) w ultrafiolecie do widzialnych długości fal.
- Przejścia wibracyjne występują, gdy cząsteczka wibruje z inną częstotliwością lub w inny sposób. Diatomiczne cząsteczki (np. O2 i N2) mają tylko jeden sposób na wibracje – tam i z powrotem wzdłuż wiązania chemicznego, które je łączy. Ale bardziej skomplikowane cząsteczki (np. H2O i CO2) mogą drgać nie tylko w ten sposób, że ich jądra poruszają się do siebie i od siebie, ale także wyginając się w trzech kierunkach. Te przejścia wibracyjne, wraz z ruchami łączącymi wibrację i rotację, mają energie równoważne promieniowaniu w bliskiej i średniej podczerwieni (tj. fotonom).
- Przejścia rotacyjne występują, gdy cząsteczka zmienia szybkość obrotu. Te przejścia mają energie równoważne promieniowaniu (tj, fotonów) w zakresie od dalekiej podczerwieni do fal radiowych.
- Energie translacyjne cząsteczek w atmosferze ziemskiej, ~kT, są na ogół nieco większe niż energia wymagana do przejścia z jednego poziomu rotacyjnego na inny, 10-100 razy mniejsze niż energia wymagana do przejścia z jednego poziomu wibracyjnego na inny i setki do tysięcy razy mniejsze niż to, co jest wymagane do przejścia z jednego poziomu elektronowego na inny.
- Widzieliśmy już, że niektóre cząsteczki i atomy mają większą energię kinetyczną niż inne. Wszystkie cząsteczki o energii kinetycznej większej niż różnica energii pomiędzy poziomami rotacyjnymi mogą zderzyć się z cząsteczką i dać jej wystarczającą energię rotacyjną, aby przejść na wyższy poziom rotacyjny. Widzimy więc, że energia rotacyjna jest rozłożona na wiele poziomów rotacyjnych, ale poziomy wibracyjne i elektronowe są zwykle poziomami podstawowymi (o najniższej energii).
- Atomy nie mają drgań i rotacji podobnych do molekuł, ponieważ mają tylko jedno jądro, więc ich widma składają się tylko z przejść elektronicznych.
- Ostre przejście z jednego poziomu dyskretnego na inny, które pojawia się jako linia w widmie, występuje w wąskim zakresie energii o różnicy energii przejścia. Wynikające z tego promieniowanie występuje w wąskim paśmie długości fal o centralnej długości fali linii. Szerokość tej linii (mierzona w połowie maksymalnej wysokości linii) nazywa się szerokością linii.
- Ta naturalna szerokość linii może być poszerzona przez ruch cząsteczki, zwany poszerzeniem dopplerowskim, lub przez zderzenia, zwane poszerzeniem ciśnieniowym.
- Wysoko w atmosferze, poszerzenie dopplerowskie jest dominujące, ponieważ ciśnienie jest niskie, ale niżej w atmosferze, poszerzenie ciśnieniowe staje się dominujące, mimo że poszerzenie dopplerowskie również wzrasta. Tak więc linie absorpcyjne są szersze przy powierzchni Ziemi niż wyżej w atmosferze.
Przekrój absorpcyjny, σ, zmienia się znacznie na szerokości linii absorpcyjnej. Jest więc możliwe, że całe promieniowanie jest pochłaniane w środku linii, ale bardzo mało w „skrzydłach”.”
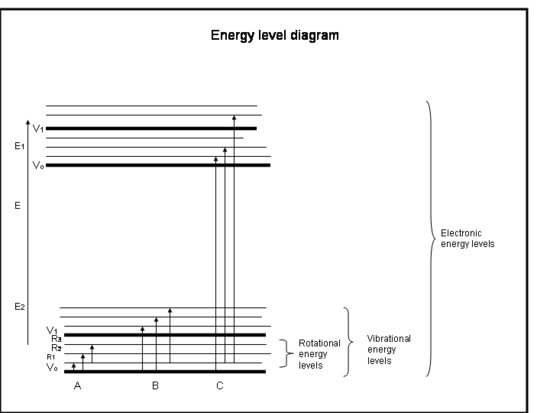
Interpretacja fizyczna
Atomy i cząsteczki mogą absorbować promieniowanie (foton) tylko wtedy, gdy ich struktura ma różnicę energii między poziomami, która odpowiada energii fotonu (hc/λ). W przeciwnym razie atom lub cząsteczka nie zaabsorbuje światła. Gdy cząsteczka zaabsorbuje foton, może albo stracić foton i wrócić na swój pierwotny niższy poziom energetyczny; albo może się rozpaść, jeśli energia fotonu jest większa niż energia wiązania chemicznego trzymającego cząsteczkę razem; albo może zderzyć się z innymi cząsteczkami, takimi jak N2 lub O2, i przekazać im energię, podczas gdy sama wróci na swój niższy poziom energetyczny. Kolizje zdarzają się często, więc energia zaabsorbowanego fotonu jest często przenoszona na energię cieplną.
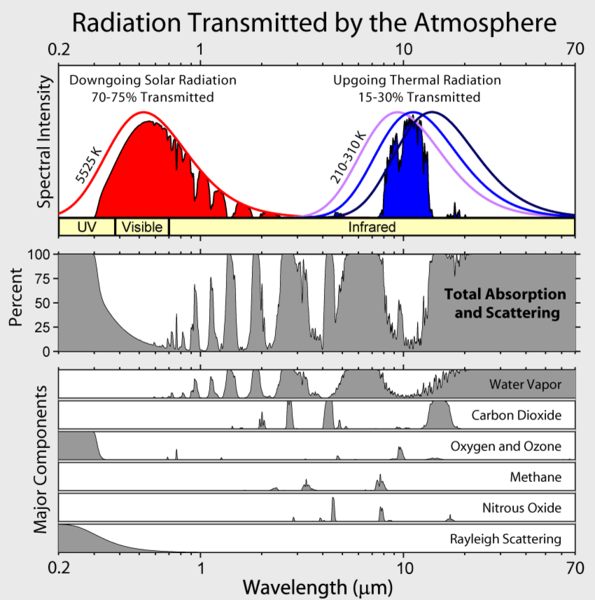
Zauważ, że wychodzące promieniowanie podczerwone Ziemi jest ograniczone do kilku atmosferycznych „okien”, a promieniowanie przy wszystkich innych długościach fal jest silnie pochłaniane, głównie przez parę wodną, ale także przez dwutlenek węgla, ozon, podtlenek azotu, metan i inne bardziej śladowe gazy, które nie są pokazane na powyższym rysunku.
.