6.9 Waarom absorberen voorwerpen zoals ze dat doen?
De atmosfeer absorbeert een aanzienlijke hoeveelheid straling in het infrarood maar vrij weinig in het zichtbare. Ook zien we dat gassen op sommige golflengten sterk absorberen en op andere niet. Hoe komt dit?
Om deze vraag te beantwoorden, moeten we kijken naar de configuraties van de elektronen die rond atomen en moleculen zoemen. Meer dan 100 jaar geleden begonnen wetenschappers prisma’s te gebruiken om het licht van de zon en van vlammen met verschillende elementen te verspreiden. Terwijl de zon de kleuren van de regenboog gaf, hadden de vlammen licht in zeer duidelijke lijnen of banden. Dit raadsel werd uiteindelijk iets meer dan 100 jaar geleden opgelost met de uitvinding van de kwantummechanica, die in feite zegt dat de elektronen die rond atomen en moleculen zoemen en de trillingen en rotaties van moleculen slechts discrete energieën kunnen hebben die worden beheerst door regels van behoud van impulsmoment.

De volgende lijst met opsommingstekens is een spoedcursus in absorptie door de elektronen in atomen en moleculen. Verwijs naar de figuur onder het kader.
Crash Course: Absorptie door de elektronen in atomen en moleculen
- Chemische bindingen en kwantummechanica bepalen samen de energieniveaus waarin elk elektron, atoom of molecuul zich kan bevinden.
- De energie van een molecuul is de som van de energie gerelateerd aan de positie van elektronen ten opzichte van hun stabiele elektronische grondtoestanden, de moleculaire trilling, en de moleculaire rotatie.
- Absorptie treedt op wanneer de energie van het foton overeenkomt met het verschil tussen twee energieniveaus in een molecuul, ΔE = Efinal – Einitial = hc/λ.
- Regels gesteld door behoud van impulsmoment en elektronenspinsel bepalen welke overgangen tussen energieniveaus zijn toegestaan.
- De hoeveelheid absorptie, kortweg de absorptiedoorsnede, σ genoemd, is het gevolg van vele factoren, maar varieert aanzienlijk van molecuul tot molecuul en van overgang tot overgang. De doorsnede heeft afmetingen van oppervlakte en heeft gewoonlijk eenheden van cm2.
- Elektronische overgangen doen zich voor wanneer de elektronen daadwerkelijk in andere banen rond de kernen springen. Zij hebben energieën die overeenkomen met straling (d.w.z. fotonen) in de ultraviolette tot zichtbare golflengten.
- Vibratie-overgangen treden op wanneer het molecuul op een andere frequentie of op een andere manier trilt. Diatome moleculen (b.v. O2 en N2) hebben slechts één manier om te trillen – heen en weer langs de chemische binding die hen bindt. Maar meer gecompliceerde moleculen (b.v. H2O en CO2) kunnen niet alleen vibreren met de kernen naar elkaar toe en van elkaar af, maar ook door in drie richtingen te buigen. Deze trillingstransities, die gepaard gaan met bewegingen die trilling en rotatie combineren, hebben energieën die overeenkomen met de nabij- en midden-infrarode straling (d.w.z. fotonen).
- Rotatie-overgangen treden op wanneer een molecuul zijn rotatiesnelheid verandert. Deze overgangen hebben energieën die overeenkomen met straling (d.w.z, fotonen) in het verre infrarood tot radiogolflengten.
- Translatie-energieën van moleculen in de atmosfeer van de aarde, ~kT, zijn in het algemeen iets groter dan de energie die nodig is om van het ene rotatieniveau naar het andere te gaan, 10-100 maal kleiner dan de energie die nodig is om van het ene trillingsniveau naar het andere te gaan, en honderden tot duizenden malen kleiner dan wat nodig is om van het ene elektronische niveau naar het andere te gaan.
- We hebben al gezien dat sommige moleculen en atomen meer kinetische energie hebben dan andere. Alle moleculen met een kinetische energie groter dan het energieverschil tussen de rotatieniveaus kunnen met het molecuul botsen en het voldoende rotatie-energie geven om naar een hoger rotatieniveau over te gaan. Zo zien we dat de rotatie-energie over vele rotatieniveaus is verdeeld, maar dat de trillings- en elektronische niveaus gewoonlijk de grondniveaus (met de laagste energie) zijn.
- Atomen hebben geen molecuulachtige trillingen en rotaties omdat zij slechts één kern hebben, zodat hun spectra alleen uit elektronische overgangen bestaan.
- Een scherpe overgang van het ene discrete niveau naar het andere, die als een lijn in een spectrum verschijnt, doet zich voor in een smal bereik van energieën rond het energieverschil van de overgang. De resulterende straling komt voor in een smalle band van golflengten rond de centrale golflengte van de lijn. De breedte van deze lijn (gemeten op de helft van de maximale hoogte van de lijn) wordt de lijnbreedte genoemd.
- Deze natuurlijke lijnbreedte kan worden verbreed door de beweging van het molecuul, Dopplerverbreding genoemd, of door botsingen, drukverbreding genoemd.
- Hoog in de atmosfeer is Dopplerverbreding dominant omdat de druk laag is, maar lager in de atmosfeer wordt drukverbreding dominant, hoewel Dopplerverbreding ook toeneemt. De absorptielijnen zijn dus breder nabij het aardoppervlak dan hoger in de atmosfeer.
De absorptiedoorsnede, σ, varieert aanzienlijk over de breedte van de absorptielijn. Het is dus mogelijk dat alle straling in het midden van de lijn wordt geabsorbeerd, maar zeer weinig in de “vleugels.”
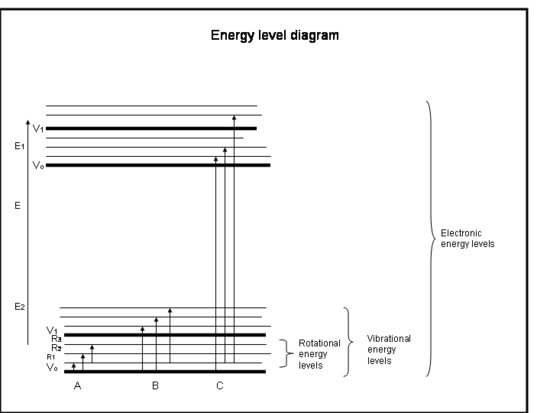
Physische interpretatie
Atomen en moleculen kunnen alleen straling (een foton) absorberen als hun structuur een energieverschil tussen niveaus heeft dat overeenkomt met de energie van het foton (hc/λ). Anders zal het atoom of molecuul het licht niet absorberen. Zodra het molecuul het foton heeft geabsorbeerd, kan het ofwel een foton verliezen en terugkeren naar zijn oorspronkelijke lagere energieniveau; ofwel kan het uiteenvallen als de energie van het foton groter is dan de chemische binding die het molecuul bijeenhoudt; ofwel kan het in botsing komen met andere moleculen, zoals N2 of O2, en energie aan hen overdragen terwijl het terugkeert naar zijn lagere energieniveau. Botsingen komen vaak voor, zodat de energie van het geabsorbeerde foton vaak in thermische energie wordt omgezet.
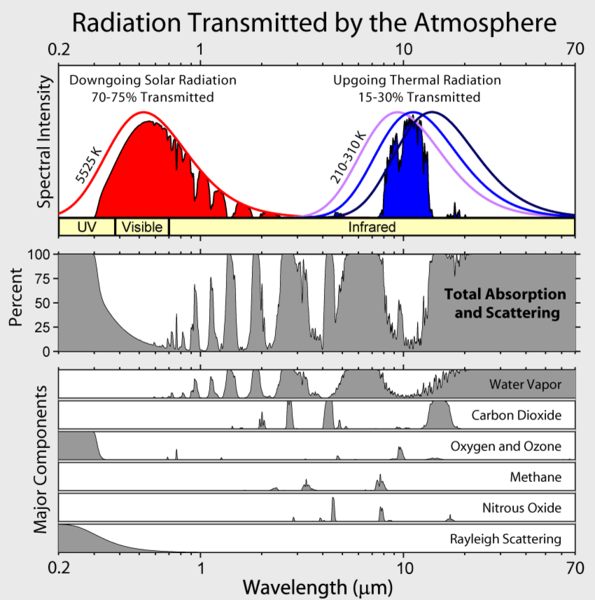
Merk op dat de uitgaande infrarode straling van de aarde beperkt is tot enkele atmosferische “vensters” en dat de straling op alle andere golflengten sterk wordt geabsorbeerd, meestal door waterdamp, maar ook door kooldioxide, ozon, distikstofoxide, methaan, en andere meer spoorgassen die niet in de bovenstaande figuur zijn aangegeven.