Obiettivi di apprendimento
- Definire il legame covalente.
- Illustrare la formazione del legame covalente con i diagrammi a punti degli elettroni di Lewis.
Il legame ionico si verifica tipicamente quando è facile per un atomo perdere uno o più elettroni e un altro atomo guadagnare uno o più elettroni. Tuttavia, alcuni atomi non cedono o guadagnano elettroni facilmente. Eppure partecipano ancora alla formazione dei composti. Come? C’è un altro meccanismo per ottenere un guscio di valenza completo: la condivisione degli elettroni. Quando gli elettroni sono condivisi tra due atomi, creano un legame chiamato legame covalente.
Illustriamo un legame covalente usando atomi H, con la consapevolezza che gli atomi H hanno bisogno solo di due elettroni per riempire il sottoguscio 1s. Ogni atomo H inizia con un solo elettrone nel suo guscio di valenza:
I due atomi H possono condividere i loro elettroni:
Possiamo usare i cerchi per mostrare che ogni atomo H ha due elettroni intorno al nucleo, riempiendo completamente il guscio di valenza di ogni atomo:
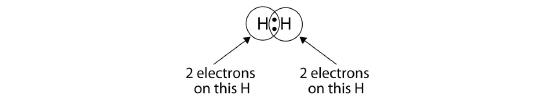
Perché ogni atomo di H ha un guscio di valenza pieno, questo legame è stabile, e abbiamo fatto una molecola di idrogeno biatomica. (Per semplicità, non è insolito rappresentare il legame covalente con un trattino, invece che con due punti:
H-H
Perché due atomi condividono una coppia di elettroni, questo legame covalente è chiamato legame singolo. Come altro esempio, consideriamo il fluoro. Gli atomi F hanno sette elettroni nel loro guscio di valenza:
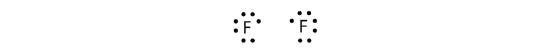
Questi due atomi possono fare la stessa cosa che hanno fatto gli atomi H; condividono i loro elettroni spaiati per fare un legame covalente.

Nota che ogni atomo di F ha un ottetto completo intorno a sé ora:
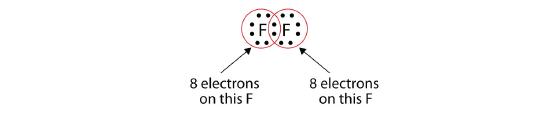
Possiamo anche scrivere questo usando un trattino per rappresentare la coppia di elettroni condivisa:
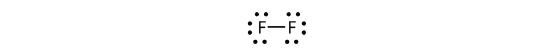
Ci sono due diversi tipi di elettroni nella molecola biatomica del fluoro. La coppia di elettroni di legame crea il legame covalente. Ogni atomo di F ha altre tre coppie di elettroni che non partecipano al legame; sono chiamati elettroni di coppia solitaria. Ogni atomo di F ha una coppia di elettroni di legame e tre coppie di elettroni solitari.
I legami covalenti possono essere fatti anche tra elementi diversi. Un esempio è l’HF. Ogni atomo inizia con un numero dispari di elettroni nel suo guscio di valenza:
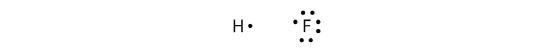
I due atomi possono condividere i loro elettroni spaiati per fare un legame covalente:
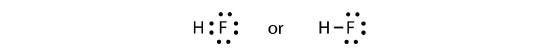
Si noti che l’atomo H ha un guscio di valenza completo con due elettroni, mentre l’atomo F ha un ottetto completo di elettroni.
Esempio \(\PageIndex{1}\):
Utilizzare i diagrammi a punti degli elettroni di Lewis per illustrare la formazione del legame covalente in HBr.
Soluzione
HBr è molto simile a HF, tranne che ha Br invece di F. Gli atomi sono i seguenti:

I due atomi possono condividere il loro elettrone spaiato:
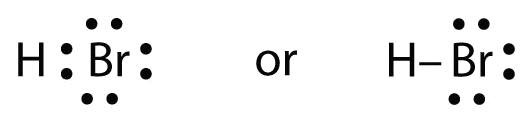
Esercizio \(\PageIndex{1})
Usa i diagrammi a punti degli elettroni di Lewis per illustrare la formazione del legame covalente in Cl2.
Risposta: 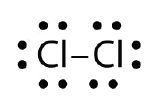
Quando lavori con strutture covalenti, a volte sembra che tu abbia degli elettroni in più. Applichi le regole che hai imparato finora e ci sono ancora alcuni elettroni che pendono là fuori non attaccati. Non puoi lasciarli lì. Quindi dove li metti?
Legami covalenti multipli
Alcune molecole non sono in grado di soddisfare la regola dell’ottetto facendo solo legami covalenti singoli tra gli atomi. Consideriamo il composto etene, che ha una formula molecolare di \(\ce{C_2H_4}\). Gli atomi di carbonio sono legati tra loro, e ogni carbonio è anche legato a due atomi di idrogeno.
due atomi di \ce{C} (= 2 volte 4 = 8) elettroni di valenza
quattro atomi di \ce{H} (= 4 volte 1 = 4) elettroni di valenza
totale di 12 elettroni di valenza nella molecola
Se la struttura a punti degli elettroni di Lewis fosse disegnata con un solo legame tra gli atomi di carbonio e con la regola dell’ottetto seguita, avrebbe questo aspetto:

Questa struttura di Lewis non è corretta perché contiene un totale di 14 elettroni. Tuttavia, la struttura di Lewis può essere modificata eliminando le coppie solitarie sugli atomi di carbonio e dovendo condividere due coppie invece di una sola coppia.
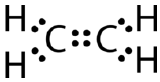
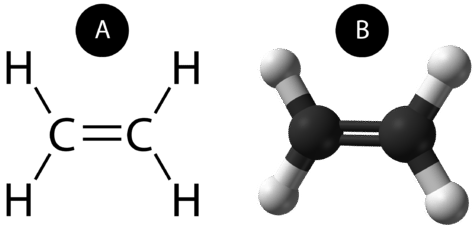
Un doppio legame covalente è un legame covalente formato da atomi che condividono due coppie di elettroni. Il doppio legame covalente che si verifica tra i due atomi di carbonio nell’etano può anche essere rappresentato con una formula strutturale e con un modello molecolare come mostrato nella figura seguente.
Un triplo legame covalente è un legame covalente formato da atomi che condividono tre coppie di elettroni. L’elemento azoto è un gas che compone la maggior parte dell’atmosfera terrestre. Un atomo di azoto ha cinque elettroni di valenza, che possono essere mostrati come una coppia e tre elettroni singoli. Quando si combina con un altro atomo di azoto per formare una molecola biatomica, i tre elettroni singoli su ogni atomo si combinano per formare tre coppie condivise di elettroni.
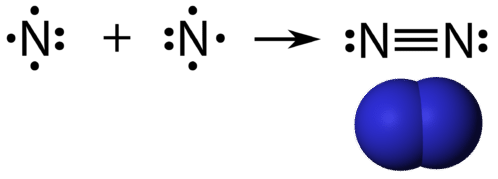
Sommario
- I legami covalenti si formano quando gli atomi condividono gli elettroni.
- I diagrammi di punti elettronici di Lewis possono essere disegnati per illustrare la formazione dei legami covalenti.
- Possono essere necessari doppi o tripli legami tra gli atomi per illustrare correttamente il legame in alcune molecole.
Contribuenti e attribuzioni
-
C-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Anonimo
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)