6.9 Miért nyelik el a tárgyak a sugárzást?
A légkör jelentős mennyiségű sugárzást nyel el az infravörös tartományban, de meglehetősen keveset a látható tartományban. Azt is látjuk, hogy a gázok bizonyos hullámhosszakon erősen elnyelnek, míg másokon nem. Miért van ez?
A kérdés megválaszolásához meg kell vizsgálnunk az atomok és molekulák körül keringő elektronok konfigurációit. Több mint 100 évvel ezelőtt a tudósok prizmákat kezdtek használni a napfény és a különböző elemeket tartalmazó lángok fényének szétszórására. Míg a nap a szivárvány színeit adta, addig a lángok fénye nagyon határozott vonalakban vagy sávokban jelent meg. Ezt a rejtélyt végül valamivel több mint 100 évvel ezelőtt oldották meg a kvantummechanika feltalálásával, amely alapvetően azt mondja ki, hogy az atomok és molekulák körül száguldozó elektronoknak, valamint a molekulák rezgéseinek és forgásának csak diszkrét energiái lehetnek, amelyeket a szögimpulzus megőrzésének szabályai szabályoznak.

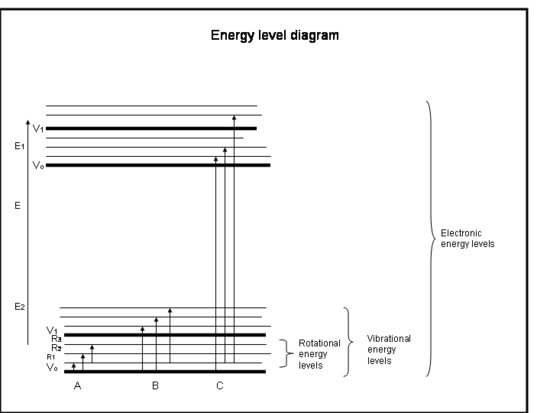
A következő felsorolás az atomok és molekulák elektronjainak elnyeléséről szóló gyorstalpaló tanfolyam. Lásd a doboz alatti ábrát.
Ökriskurzus: Abszorpció az elektronok által az atomokban és molekulákban
- A kémiai kötések és a kvantummechanika együttesen határozzák meg azokat az energiaszinteket, amelyekben bármely elektron, atom vagy molekula tartózkodhat.
- A molekula energiája az elektronoknak a stabil alapelektronikai állapotukhoz viszonyított helyzetéhez, a molekuláris rezgéshez és a molekuláris forgáshoz kapcsolódó energiák összege.
- Az abszorpció akkor következik be, amikor a foton energiája megegyezik a molekula két energiaszintje közötti különbséggel, ΔE = Efinal – Einitial = hc/λ.
- A szögimpulzus és az elektronspin megmaradása által meghatározott szabályok határozzák meg, hogy mely energiaszintek közötti átmenetek megengedettek.
- Az abszorpció mértéke, amelyet egyszerűen abszorpciós keresztmetszetnek, σ-nek neveznek, számos tényezőből adódik, de molekulánként és átmenetről átmenetre jelentősen változik. A keresztmetszetnek területi méretei vannak, és általában cm2 -ben kifejezett egységekkel rendelkezik.
- Elektronikus átmenetek akkor következnek be, amikor az elektronok ténylegesen más pályára ugranak az atommagok körül. Ezek energiája az ultraibolya és a látható hullámhosszak közötti sugárzásnak (azaz fotonoknak) felel meg.
- Vibrációs átmenetek akkor következnek be, amikor a molekula más frekvencián vagy más módon rezeg. A kétatomos molekulák (pl. az O2 és az N2) csak egyféleképpen rezeghetnek – oda-vissza az őket összekötő kémiai kötés mentén. A bonyolultabb molekulák (pl. a H2O és a CO2) azonban nemcsak úgy rezeghetnek, hogy az atommagok egymás felé és egymástól távolodnak, hanem három irányban elhajolva is. Ezek a rezgési átmenetek a rezgést és a forgást kombináló mozgásokkal együtt a közeli és a középső infravörös sugárzásnak (azaz a fotonoknak) megfelelő energiával rendelkeznek.
- Rotációs átmenetek akkor következnek be, amikor a molekula megváltoztatja forgási sebességét. Ezeknek az átmeneteknek a sugárzással egyenértékű energiájuk van (ill, fotonoknak) felel meg a távoli infravörös és a rádióhullámok hullámhosszán.
- A molekulák forgási energiája a Föld légkörében, ~kT, általában valamivel nagyobb, mint az egyik forgási szintről a másikra való átmenethez szükséges energia, 10-100-szor kisebb, mint az egyik rezgési szintről a másikra való átmenethez szükséges energia, és százszor, ezerszer kisebb, mint az egyik elektronszintről a másikra való átmenethez szükséges energia.
- Már láttuk, hogy egyes molekulák és atomok mozgási energiája nagyobb, mint másoké. Minden olyan molekula, amelynek mozgási energiája nagyobb, mint a forgási szintek közötti energiakülönbség, ütközhet a molekulával, és elegendő forgási energiát adhat neki ahhoz, hogy magasabb forgási szintre váltson. Így azt látjuk, hogy a forgási energia sok forgási szintre oszlik el, de a rezgési és elektronikus szintek általában az alap (legalacsonyabb energiájú) szintek.
- Az atomok nem rendelkeznek molekulaszerű rezgésekkel és forgásokkal, mivel csak egy atommaggal rendelkeznek, így spektrumuk csak elektronikus átmenetekből áll.
- Az egyik diszkrét szintről a másikra való éles átmenet, amely vonalként jelenik meg a spektrumban, az átmenet energiakülönbség körüli szűk energiatartományban következik be. A keletkező sugárzás a vonal központi hullámhossza körüli keskeny hullámhosszú sávban jelentkezik. Ennek a vonalnak a szélességét (a vonal maximális magasságának felénél mérve) vonalszélességnek nevezzük.
- Ezt a természetes vonalszélességet szélesítheti a molekula mozgása, az úgynevezett Doppler-szélesedés, vagy az ütközések, az úgynevezett nyomásszélesedés.
- A légkörben magasan a Doppler-szélesedés dominál, mert a nyomás alacsony, de a légkörben alacsonyabban a nyomásszélesedés válik dominánssá, bár a Doppler-szélesedés is nő. Az abszorpciós vonalak tehát szélesebbek a földfelszín közelében, mint a légkörben magasabban.
Az abszorpciós keresztmetszet, σ, jelentősen változik az abszorpciós vonal szélessége szerint. Így lehetséges, hogy a vonal közepén az összes sugárzás elnyelődik, de a “szárnyakon” csak nagyon kevés abszorbeálódik.”
Fizikai értelmezés
Az atomok és molekulák csak akkor képesek sugárzást (fotont) elnyelni, ha szerkezetükben a szintek közötti energiakülönbség megfelel a foton energiájának (hc/λ). Ellenkező esetben az atom vagy molekula nem nyeli el a fényt. Miután a molekula elnyelte a fotont, vagy elveszíthet egy fotont, és visszatérhet az eredeti alacsonyabb energiaszintjére; vagy széteshet, ha a foton energiája nagyobb, mint a molekulát összetartó kémiai kötés; vagy összeütközhet más molekulákkal, például N2-vel vagy O2-vel, és energiát adhat át nekik, miközben visszatér az alacsonyabb energiaszintjére. Ütközések gyakran történnek, így az elnyelt foton energiája gyakran átadódik hőenergiává.
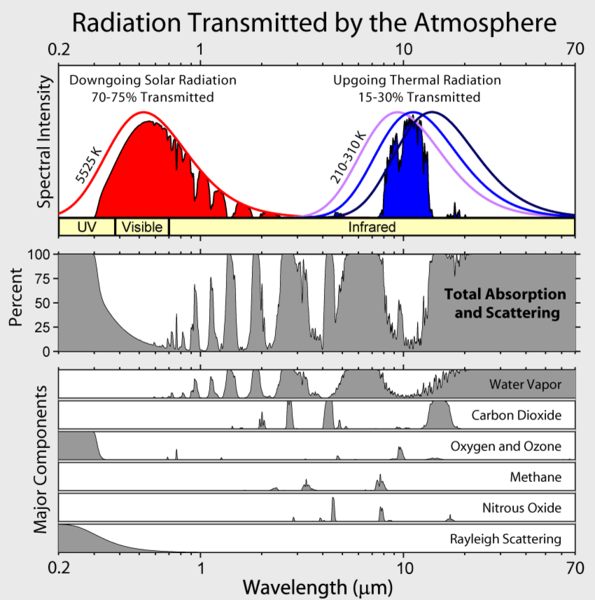
Megjegyezzük, hogy a Föld kimenő infravörös sugárzása néhány légköri “ablakra” korlátozódik, és az összes többi hullámhosszon a sugárzás erősen elnyelődik, főként a vízgőz, de a szén-dioxid, az ózon, a dinitrogén-oxid, a metán és más, a fenti ábrán nem látható nyomokban lévő gázok is.